壳聚糖微花对原花青素吸附机理的研究
焦思宇,许丁予,姚先超,刘 鑫,林春燕,何丽欣,林日辉
(广西民族大学化学化工学院,广西多糖材料与改性重点实验室,林产化学与工程国家民委重点实验室,广西林产化学与工程重点实验室,广西南宁 530006)
原花青素(Procyanidins,PC)是由不同量的儿茶素或表儿茶素通过C-C 键缩合形成的聚合物,也称为缩合单宁[1]。它存在于不同的食物中,如茶、水果、蔬菜、葡萄、葡萄酒、和豆类等[2]。PC 被认为是一种天然抗氧化剂,其抗氧化能力是维生素C 的20 倍,是维生素E 的50 倍[3-4]。PC 还具有药理作用,如抗菌、抗炎和抗癌[5]。因此,PC 被用作癌症和炎症的治疗剂或抑制剂。虽然PC 有上述生物活性,但是由于其自身的一些缺陷限制了其应用范围。如当pH 高于7.4 或温度超过60 ℃时,PC 容易分解[6-7]。此外,PC 对氧气、光线和水分也很敏感[8-9]。然而采用天然生物材料负载PC 既解决了这些问题也提高了其生物利用度。Tie 等[10]使用明胶和海藻酸钠复合物来包埋PC。在相同的紫外光照射下,负载后PC 的保留率比游离的PC 的保留率要高25%;而在70 和80 ℃条件下处理12 h 后,保留率分别增加了37%和16%。Liu 等[11]以淀粉纳米粒子为载体来吸附PC,其吸附量为23.45 mg/g。研究表明,负载后的PC 在80 ℃的条件下处理30 min 后,其对DPPH 自由基清除的IC50值比纯PC 低25%。Liu 等[12]制备了低聚原花青素/白芨多糖/壳聚糖微球,通过抗氧化实验证明微球的自由基清除率比纯PC 提高了10%。
壳聚糖(Chitosan,CS)是一种天然阳离子多糖。由于其优异的性能(可降解性和生物相容性)、来源广泛和成本低廉等特点,而被认为是潜在的药物载体[13]。通过将壳聚糖进行微米化、纳米化或者是化学修饰,可以使其负载各种脂溶性和水溶性药物。Luo 等[14]采用离子凝胶法制备壳聚糖/磷酸钙微花颗粒用来包埋槲皮素,其包封率达到80%;体外缓释实验表明,CS 载药微粒具有缓释效果(药物释放时间大于24 h)和pH 敏感释药特性。Dhavale 等[15]将壳聚糖接枝到Fe3O4磁性纳米粒子上作为替米沙坦(TEL)的载体,载药量达到50%;MNP-CS-TEL 具有较好的缓释性能,最长释药时间可达50 h,且细胞毒性低于纯TEL。Sohail 等[16]制备了海藻酸钠-壳聚糖纳米颗粒作为生物相容性药物递送剂来包埋苦杏仁苷,其药物包埋率为90%,且载药纳米颗粒在不同pH 条件下均表现出缓释效果。Liang 等[17]用壳聚糖纳米粒包埋茶多酚。纳米粒的最大药物含量和包埋率分别为16 %和83 %,而负载在壳聚糖纳米粒上的茶多酚可通过诱导癌细胞坏死和凋亡进而来抑制HepG2 细胞的增殖。
课题组前期通过离子交联法制备了壳聚糖微花(chitosan microflower,CSMF),并用CSMF 作为吸附剂来负载PC。最大吸附量达到352.88 mg/g,是Jiang 等[18]和Ji 等[19]的负载量的4~5 倍。体外实验也证明原花青素壳聚糖载药微花(procyanidins chitosan drug-loaded microflower, PC-CSMF)具有缓释作用,PC 得生物活性也得到提高[20]。为了深入了解CSMF 对PC 的吸附机理,本文在较低的PC 质量浓度下,系统地研究了CSMF 对PC 的吸附动力学、吸附等温线和吸附热力学。此外,通过分子扩散模型,研究了CSMF 对PC 吸附的过程。
1 材料与方法
1.1 材料与仪器
壳聚糖(CS)(脱乙酰度≥95%)、三聚磷酸钠(TPP)(AR) 上海麦克林生化有限公司;原花青素(PC,纯度≥95%) BR,上海源叶生物科技有限公司;冰醋酸 AR,上海阿拉丁生化技术有限公司;过氧化氢(H2O2) AR,天津致远化学试剂有限公司。
JY92-IIN 超声波细胞粉碎机 宁波新芝生物科技股份有限公司;TG1650-WS 型台式高速离心机上海卢湘仪离心机仪器有限公司;MQL-61R 立式振荡培养箱 上海旻泉仪器有限公司;SUPRA 55 Sapphire 型场发射扫描电子显微镜 德国卡尔蔡司公司;MiniFlex600 X-射线衍射仪 日本理学公司;TGA55 热重分析仪 美国TA 仪器。
1.2 实验方法
1.2.1 原花青素壳聚糖载药微花的制备 通过离子交联法制备CS-TPP 微花。首先,在磁力搅拌下将1.0 g 壳聚糖溶解在1 wt%的乙酸溶液中。并向CS 溶液中加入10 mL 6% H2O2进行辅助溶解,在45 ℃的条件下磁力搅拌20 min。其次,将完全溶解的壳聚糖溶液超声粉碎(功率为100%)30 min。然后,在超声粉碎下将5 wt%的TPP 溶液加入到CS 溶液中。通过离心(6000 r/min)法收集微花,并用乙醇洗涤三次,用蒸馏水洗涤一次。最后,冷冻干燥后得到CSMF 粉末。再将0.05 g CSMF 放入10 mL 1 mg/mL 的PC 溶液中。用摇床混合5 min 后,通过离心(8000 r/min) 和冷冻干燥法收集载有原花青素的壳聚糖微花(procyanidins chitosan microflower,PC-CSMF)。
通过UV-2600 分光光度法检测PC 含量。PC的最大吸收峰在280 nm,标准曲线的回归方程为Y=11.94X+0.00367,决定系数R2=0.9998[20]。使用以下方程计算PC 的负载量(q):
式中:q 为吸附载药量,mg/g;C1为PC 溶液质量浓度,mg/mL;C2为吸附后的PC 溶液质量浓度,mg/mL;V 为PC 溶液体积,mL;m 为CSMF 吸附剂用量,g。
1.2.2 样品表征 用扫描电子显微镜(SEM)、傅里叶变换红外光谱(FTIR)、X-射线衍射(XRD)和热重(TGA)对样品进行了表征,具体操作如下。
1.2.2.1 SEM 分析 用场发射扫描电子显微镜(FESEM)(SUPRA 55 Sapphire, Carl Zeiss, Germany)在工作电压2.0 kV,电流3.20 A,工作距离为5.5~6.5 mm 下观察CSMF。样品表面喷铂处理。
1.2.2.2 FTIR 分析 红外光谱分析用傅里叶变换红外光谱仪(Perkin Elmer Spectrum)记录,每个光谱在4000~400 cm-1范围内扫描,分辨率为2 cm-1。样品与KBr 混合,压缩成颗粒。
1.2.2.3 XRD 分析 用MiniFlex600 型X 射线衍射仪对样品进行XRD 表征,射线为CuKa,工作电压为40 kV,工作电流为20 Ma, 在室温下以2°/min 的速度扫描4°~60°范围。
1.2.2.4 TGA 分析 用德国STA449F3Jupiter 热分析仪测定样品的热稳定性。在氮气作为保护气的条件下,以20 ℃/min 的扫描速度从35 ℃加热到800 ℃,样品用量大约15 mg。
1.2.3 吸附动力学 将5 mg 的CSMF 放在比色皿的底部,贴壁加入3 mL 0.15 mg/mL 的PC 溶液,通过分光光度计每20 s 测量一次吸光度值,直至吸光度值不在变化,达到吸附平衡。并由公式(1)计算出吸附量。采用准一级模型(pseudo-first-order,PFO)、准二级模型(pseudo-second-order,PSO)和颗粒内扩散模型(intra-particle diffusion,IPD)[21-22]研究CSMF对PC 对的吸附机理。
PFO 模型表达如下:
PSO 模型表达如下:
IPD 模型表达如下:
式中,qe表示平衡时的吸附量,mg/g;qt表示t 时刻的吸附量,mg/g;t 表示吸附时间(S);k1表示PFO 模型的速率常数,s-1;k2表示PSO 模型的速率常数,g/(mg·s);kd表示IPD 速率常数。
1.2.4 吸附等温线 取0.05 g CSMF,分别在15、25 和35 ℃下对10 mL 质量浓度为0.2、0.4、0.6、,0.8 和1.0 mg/mL 的PC 溶液进行吸附10 min。并由公式(1)计算出吸附量。采用Langmuir 和Freundlich 模型[21]描述了CSMF 对PC 的吸附行为。
Langmuir 吸附等温线表示如下:
Freundlich 吸附等温线表示如下:
式中:qe为平衡吸附量,mg/g;Ce为平衡浓度,mg/L;qm为理论最大平衡吸附量,mg/g;KL为Langmuir 模型常数;KF和n 是Freundlich 模型常数。
1.3 数据处理
所有实验重复三次并取平均值。实验数据用Excel 进行统计。使用Origin 对实验数据进行分析和绘图。
2 结果与分析
2.1 样品的结构表征
2.1.1 CSMF 和PC-CSMF 的SEM 分析 用扫描电子显微镜观察了CSMF 和PC-CSMF 的形貌,其结果如图1 所示。由图1a 可明显地观察到CS 颗粒的生长呈现花朵型结构。微花的直径为1~2 μm,是由厚约为30 nm 的片状花瓣组成。微花表面有许多不规则的层状结构。这种微花表面的层状结构大大增加了微花的比表面积,从而改善了微花的吸附性能。微花的BET 测试结果为48.9 m2/g,且微花的花瓣与花瓣之间有一定的间隙,使更多的吸附位点裸露出来。因此,吸附质更容易与微花表面相结合,提高了微花的吸附能力。当CSMF 吸附负载PC 后,CSMF的形貌没有显著的变化(图1b)。然而,负载PC 后的微花尺寸略大于CSMF。造成这种现象的原因可能是因为CSMF 在水中吸附的亲水性物质PC 时,导致了更多的水分子进入CSMF 中,这导致了CSMF的溶胀和微花尺寸的增大。其次,吸附PC 后,CSMF 的形貌由扁平变为椭圆形或球形,层间距变小。产生这种现象的原因可能是PC 吸附在CSMF瓣与瓣之间的空隙中所致。

图1 CSMF(a)和PC-CSMF(b)的电镜图Fig.1 SEM image of CSMF (a) and PC-CSMF (b)
2.1.2 CSMF、PC 和PC-CSMF 的FTIR 分析 CSMF、PC 和PC-CSMF 的FTIR 光谱如图2 所示。CSMF有如下特征峰:在3247 cm-1处的宽峰带是O-H 键和N-H 键的伸缩振动峰的结合;在1643 和1542 cm-1处出现的特征峰归因为酰胺I(C=O 伸缩振动)和酰胺II(NH2弯曲振动);1382 cm-1处的特征峰对应于-CH2的弯曲振动;在1083 和890 cm-1处的特征峰是由于C-O 的伸缩振动和C-O-C 骨架振动[23]。然而,在PC 的FTIR 光谱中,可以看到3383 cm-1处有较强吸收峰,这是由于PC 中多酚类结构-OH 伸缩振动所致;1618 和1108 cm-1处的吸收峰归因于多酚类化合物的特征官能团。芳香族化合物的特征峰位于1523 和1452 cm-1[24-25]。对比CSMF 和PC-CSMF的红外光谱,可以看出PC-CSMF 在1456 cm-1处有产生一个新的特征峰,这是芳香族化合物的特征峰,表明PC 已成功负载到CSMF 上。
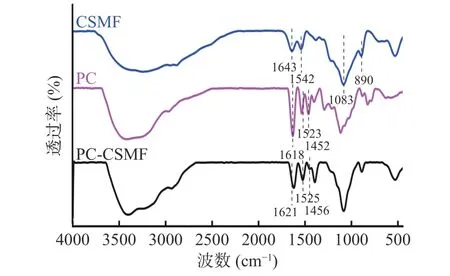
图2 CSMF、PC 和PC-CSMF 的FTIR 图谱Fig.2 Fourier transform infrared spectroscopic spectra of CSMF, PC and PC-CSMF
2.1.3 CS、CSMF 和PC-CSMF 的XRD 分析 CS、CSMF 和PC-CSMF 的X 射线衍射结果如图3 所示。CS 在20.08°处有一个尖锐的特征衍射峰,这是典型的CS 指纹图谱,具有明显的半结晶结构[26]。CSMF 的特征峰为2θ=11.9°、18.6°和23.28°,这些特征峰表明了CSMF 是一种多晶型结构,在文献中被称为“肌腱”水合多晶型。其产生的原因为TPP 的加入改变了壳聚糖的晶体结构,影响了壳聚糖分子间和分子内氢键的排列,进而出现了这些新的衍射峰[27]。比较PC-CSMF 和CSMF 的X 射线衍射图,可知两者没有显著差异。PC-CSMF 的衍射峰也位于11.9°、18.6°和23.28°附近。推测这一现象的原因是PC 通过分子间作用力在CSMF 的各层之间均匀分布。因此,它不会影响CSMF 分子间和分子内氢键的排列,进而不会产生新的衍射峰。
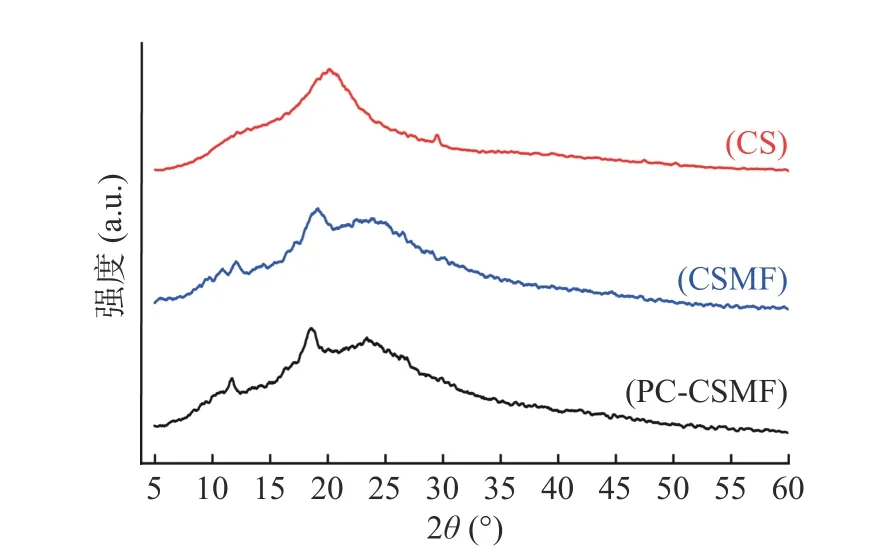
图3 CS、CSMF 和PC-CSMF 的XRD 图Fig.3 X-ray diffractogram of CS, CSMF, and PC-CSMF
2.1.4 CSMF 和PC-CSMF 的TGA 分析 CSMF和PC-CSMF 在30~800 ℃范围内的TGA 热谱如图4 所示。如图4a 和图图4b 所示,CSMF 有两个失重阶段,CSMF 第一阶段失重发生在温度为60~150 ℃范围内,重量损失约12 wt%,其原因是CSMF表面的自由水和结合水的溢出[23],这一阶段的最大失重速率温度约为97 ℃。第二阶段发生在175~320 ℃,失重约为30 wt%,这与CS 糖苷键的断裂有关[28],这一阶段的最大失重速率温度约为249 ℃。对比分析图4c 和图4d可知,PC-CSMF 的失重也分为两个阶段。第一阶段温度低于158 ℃,失重率约为10 wt%,最大失重速率温度约为99 ℃。第二阶段发生在175~350 ℃,失重约为27 wt%,最大失重速率温度约为251℃。这两个阶段的失重的原因与CSMF 中的相同。造成CSMF 和PC-CSMF最大失重速率温度略有不同的原因可能是由于PC 是通过分子间作用力负载在CSMF 上的,所以PC-CSMF 最大失重速率的温度略高于CSMF。
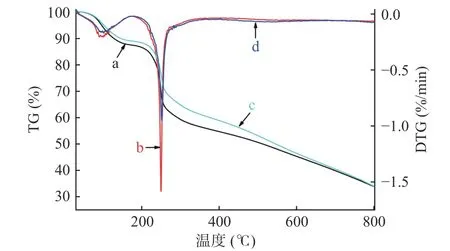
图4 CSMF 和PC-CSMF 的TGA-DTG 图Fig.4 TGA-DTG diagram of CSMF and PC-CSMF
2.2 吸附动力学模型
为了了解CSMF 对PC 吸附过程和吸附机理,运用了三个最常用的动力学模型,即准一级(PFO)、准二级(PSO)和颗粒内扩散(IPD)模型,研究了PC 初始浓度为150 mg/L 时CSMF 对其吸附过程。Qt随t 的变化如图5 所示。如图5 所示,CSMF 对PC 的吸附速率前期较快,后期趋于平缓。520 s 时达到吸附平衡,平衡吸附量为32.55 mg/g。
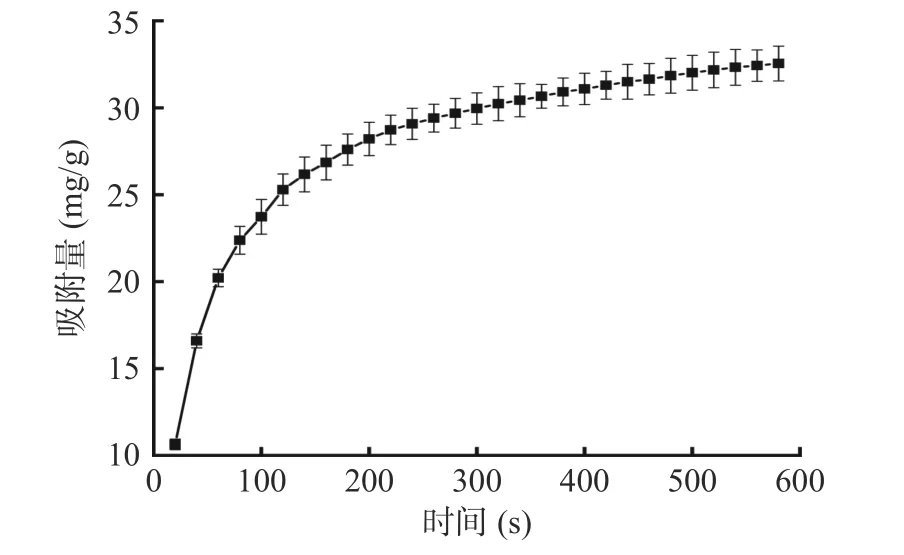
图5 吸附量随时间的变化Fig.5 Change of adsorption amount with time
PSO 和PFO 的拟合结果如表1 所示。由表1可知,准二级动力学模型的线性决定系数(R2=0.9998)优于准一级动力学模型的线性决定系数(R2=0.9519)。而由准二级动力学模型得到的理论吸附量(qe=34.965 mg/g)与实验值(qe=32.55 mg/g)更加接近。因此准二级动力学模型更能准确地描述CSMF 对PC 的吸附过程[21]。与Jiang 等[18]的CS吸附PC 的动力学结果一致。

表1 CSMF 对PC 的吸附动力学参数Table 1 Kinetics parameters for PC adsorption onto the CSMF
PSO 动力学模型不能给出明确的吸附机理。因此,采用Weber 和Morris 的颗粒内扩散模型对吸附数据进行处理。他们认为吸附质可以通过三个连续的步骤从溶液相转移到吸附剂上[29]:被吸附离子向吸附剂外表面的输送(膜扩散);被吸附分子在吸附剂孔内的输送(颗粒内扩散);被吸附分子在吸附剂内表面上的吸附。
IPD 拟合结果如图6 所示。如果整个过程是穿过原点的一条直线直线,则表明该吸附过程是受独颗粒扩散速率影响。但拟合结果为多条直线,则表明吸附过程涉及两个或两个以上步骤。从图6 可以看出,吸附过程分为三个不同的阶段:瞬时吸附或快速外表面吸附阶段;颗粒内扩散受速率控制的逐步吸附阶段;由于溶液中PC 浓度较低以及可用吸附位置较少而导致的最终平衡阶段[29-30]。因此,整个吸附过程可以描述为:首先,当CSMF 与PC 接触时,CSMF的外表面有较多的吸附位点,PC 的浓度也较高。所以它们很快就发生了表面吸附。其次,随着整个吸附过程的推进,微花外表面的吸附位点被大量占据。PC 需要扩散到CSMF 层与层之间的间隙中,从而与CSMF 形成内部结合。最后,当PC 在整个体系中的浓度降低到一定程度时,整个吸附过程趋于平衡。因此,颗粒扩散和边界层扩散相互作用影响了CSMF 对PC 的吸附。
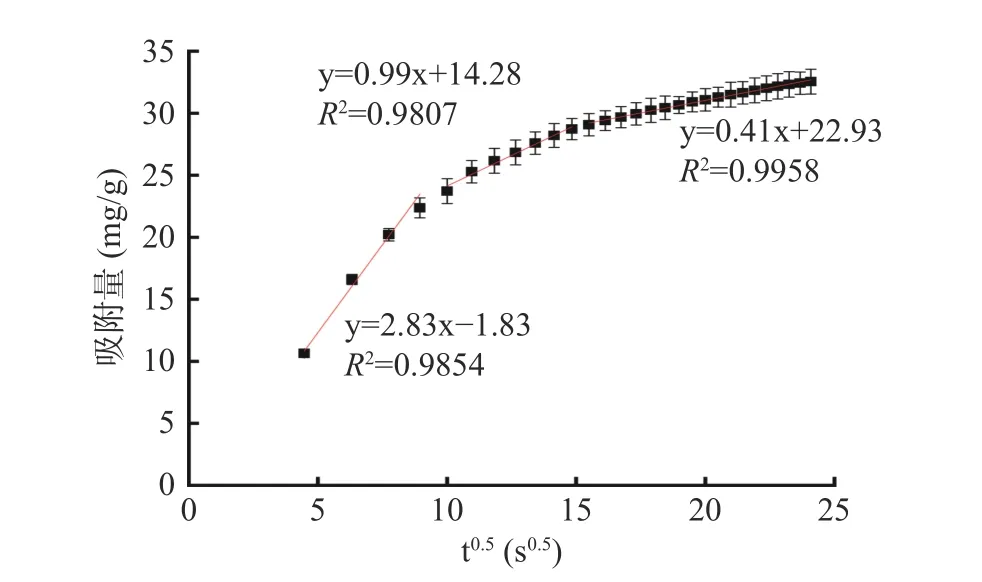
图6 颗粒扩散动力学曲线Fig.6 Kinetic curves for particle diffusion
2.3 吸附等温线模型
不同温度条件下吸附量随浓度的变化如图7 所示。CSMF 对PC 的吸附量随着PC 初始浓度的增加而增加。这可能是由于初始浓度作为驱动力克服了PC 和CSMF 表面之间的传质阻力。温度的升高对吸附量没有显著影响。
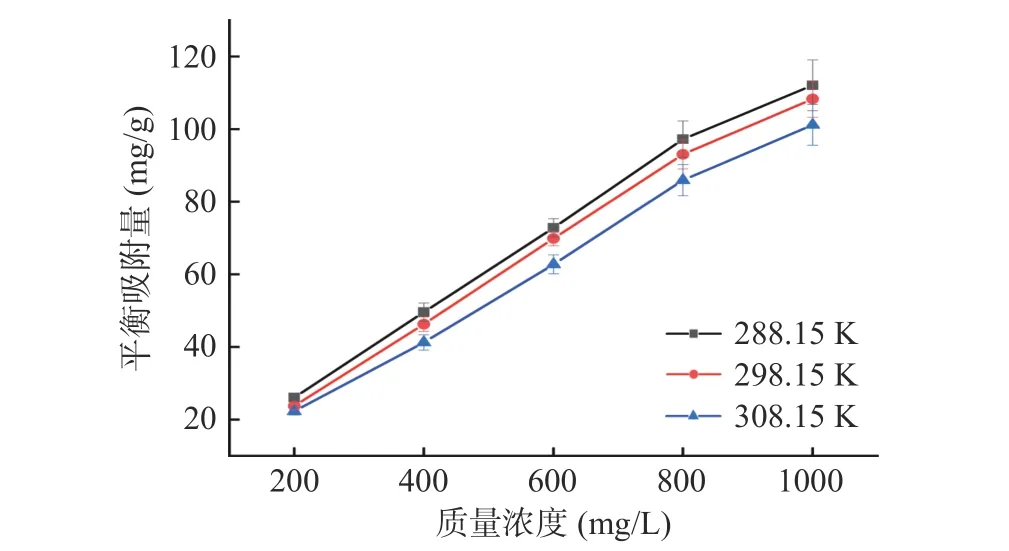
图7 不同温度下吸附量随浓度的变化Fig.7 Variation of adsorption capacity with concentration at different temperatures
当吸附达到平衡时,吸附等温线可以给出吸附分子在液、固两相之间分布等信息。最常见的模型为Langmuir 和Freundlich 等温线模型。因此,采用Langmuir 和Freundlich 模型来描述CSMF 对PC 的吸附平衡时PC 的分布情况。Langmuir 方程适用于均相吸附并有以下假设:a.分子只能吸附在一定数量的特定位置上;b.吸附为单分子层吸附;c.吸附剂表面是均匀的;d.不同吸附位点的分子之间没有相互作用[30]。而Freundlich 吸附等温式更适用于非理想状态吸附或多层吸附。有以下基本假设:a.吸附热随着吸附量的增加而减小;b.不同的吸附位点具有不同的吸附能[30]。因此以Ce为横坐标,Ce/qe为纵坐标,对Langmuir 方程进行线性拟合。同时,以lnCe为横坐标,lnqe为纵坐标,对Freundlich 方程进行了线性拟合。其拟合结果如表2 所示。
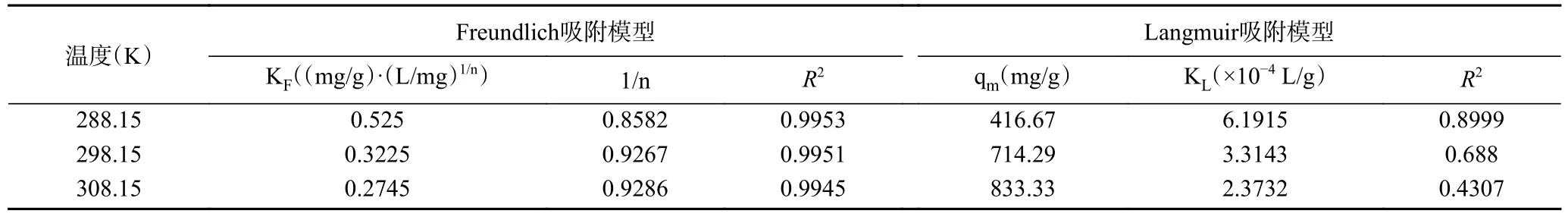
表2 CSMF 对PC 的吸附等温线方程及参数Table 2 Adsorption isotherm equation and parameters of PC on CSMF
如表2 所示,Freundlich 吸附等温线模型的R2系数要优于Langmuir 等温线模型。而1/n 是Freundlich 的吸附指数,其值说明了吸附的类型。当0<1/n<1 时,吸附是有利的;当1/n>2 时,吸附是不利的[21]。表2 所示,1/n 值表明CSMF 对PC 的吸附是有利的。这说明Freundlich 吸附等温线能更准确地反映吸附过程。因此,CSMF 对PC 的吸附是表面能不均匀的多层吸附。这可能是由于CSMF 表面不规则的层状结构导致其不同吸附位点的吸附能不同所致。
2.4 吸附热力学
吸附热力学是研究吸附机理的必要手段之一,本文用过三个基本的热力学参数(吉布斯自由能变(ΔG),焓变(ΔH)和熵变(ΔS))来研究CSMF 对PC 的吸附机理,因为PC 在CSMF 上的吸附过程符合Freundlich 等温线模型,因此ΔG 可由下式计算[31]:
用Clausius-Clapeyron 方程计算ΔH[31]:
用Gibbs-Helmholtz 方程计算ΔS:
式中:T 表示绝对温度,K;R 表示气体常数;n 表示Freundlich 常数;Ce表示平衡浓度,mg/L;C 表示积分常数。
热力学参数如表3 所示。

表3 CSMF 的热力学参数Table 3 Thermodynamic parameters of CSMF
如表3 所示,ΔG 在不同温度下均为负值,表明CSMF 对PC 的吸附是一个自发过程。ΔG 值均在-20~0 kJ/mol 范围内,表明该过程主要为物理吸附过程为主[32]。ΔH 值也为负值,说明整个吸附过程为放热过程。ΔH 的绝对值在0~40 kJ/mol 范围内,这也表明CSMF 对PC 的吸附是物理吸附[33]。这些结果与前面的分析是一致的。负熵则表明PC 吸附在CSMF 上后,体系的混乱度降低[34-35]。所有热力学参数表明,PC 是通过分子间作用力自发地与CSMF 结合,从而降低了整个体系的混乱程度。
3 结论
本研究将CSMF 作为药物载体负载亲水性药物PC,并对其进行了系统的表征。FTIR 结果表明,PC-CSMF 红外光谱在1456 cm-1处有一个新的衍射峰,代表芳香族化合物的衍射峰,从而证明了PC 负载成功。通过吸附动力学、吸附等温线和吸附热力学等方法系统地研究了壳聚糖基材料对PC 的吸附机理。结果表明,整个吸附过程是自发的,PC 通过分子间作用力在CSMF 表面及瓣与瓣之间的空隙中形成多层附着。整个吸附过程可以描述为:首先,CSMF 与PC 接触,此时CSMF 外表面有较多的吸附位点,此时PC 的浓度也较高,因此,首先在CSMF 表面进行了快速吸附。其次,随着吸附过程的进行,微花外表面的吸附位点被大量占据。此时溶液中的PC 需要扩散到CSMF 的层间空隙中,并与CSMF 形成内部附着。最后,当整个体系中PC 的浓度降低到一定程度时,整个吸附速率趋于平缓,从而达到吸附平衡。本工作为壳聚糖基材料负载PC 提供了理论依据。

