定量血流分数测量对经皮冠状动脉介入治疗后患者主要不良心血管事件发生的预测价值
张小敏 肖栋 柏中胜 曹龙兴 彭朝梅 肖国胜
冠心病(coronary heart disease,CHD)是最常见的心血管疾病类型,由于其高患病率、高致死率及高致残率给人民带来了沉重的经济负担。据最新统计,现患CHD达1 139万,农村及城市CHD死亡率分别为121.59/10万和130.14/10万[1]。CHD的主要治疗手段是经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)。近10年来我国PCI例数保持15%~20%的年均增长率。然而随着药物洗脱支架(drug-eluting stent,DES)使用数量剧增,支架内再狭窄(in-stent restenosis,ISR)、晚期支架内血栓形成(late stent thrombosis,LST)、支架断裂移位、边支受累、支架处血管炎症反应、金属过敏、支架贴壁不良等问题日益突出。得益于DES技术和材料的不断改进,近年来患者PCI术后的远期临床预后得到明显改善,但DES术后ISR及LST每年发生的风险仍接近2%,PCI术后再发心绞痛、心肌梗死、心原性死亡、靶血管血运重建(target vessel revascularization,TVR)等主要不良心血管事件(major adverse cardiovascular events,MACE)并不少见。有研究显示,PCI术后2~3年患者MACE的发生率高达20%~30%,而导致PCI术后MACE发生的主要原因包括:ISR、残余狭窄、斑块脱垂、边缘夹层、支架膨胀不良等[2-3]。
多项研究指出,可以通过测量血流储备分数(fractional flow reserve,FFR)预测PCI术后患者MACE发生的风险,预测MACE的FFR最佳临界值为0.90~0.92,并且一致认为,PCI术后FFR值越高,临床预后越好[4-6]。但由于FFR是一项有创性的检查,需使用压力导丝,操作复杂且有血管损伤的风险,还需要腺苷等扩血管药物,部分患者不耐受或有副作用,检查耗时影响手术效率,目前FFR在国内的使用率不到1%,在全球范围内的使用率不到10%[7]。
定量血流分数(quantitative flow ratio,QFR)是一种基于冠状动脉造影(coronary angiography,CAG)获得血管造影图像,进而通过血管的3D重建和血流动力学分析,评估血管内血流动力学状况的生理学功能诊断技术,也是一种CAG衍生的FFR测量方法。QFR的测量不需要使用压力导丝及腺苷诱导充血,测定过程简单快捷,可以在手术全程中多次反复测量,而且可同时获取血管2D和3D结构定量信息,目前临床上主要用于判别CHD临界病变、评估急 性冠状动脉综合征非罪犯血管、模拟虚拟支架置入并指导PCI以及长弥漫、分叉等复杂冠状动脉病变。多项研究表明,QFR在诊断冠状动脉狭窄是否导致严重缺血方面有较高的准确度,与FFR具有高度相关性和一致性,以“金标准”FFR为参考标准,QFR的诊断准确度能达到86%~94%[8-10]。此外,与FFR测量时回拉压力导丝一样,QFR可以对整条血管进行检测分析,这有助于区分是支架段还是其他部位导致的缺血[9]。
但是目前,关于QFR的研究主要是验证QFR与FFR的相关性及一致性,关于PCI术后QFR值与CHD患者远期MACE发生的关系研究较少,尤其是预测MACE发生的最佳临界值仍存在争议。因此本研究的目的是探讨PCI术后患者发生MACE的最佳QFR临界值,分析可能会影响QFR值、MACE发生的相关因素,并进一步探讨QFR对PCI术后患者MACE发生的预测价值。
1 对象与方法
1.1 研究对象
选取2020年1—6月在厦门大学附属心血管病医院接受DES的384例患者。包括急性冠状动脉综合征及慢性冠状动脉综合征者。经过严格筛选后符合条件的患者总共273例,QFR未能成功测量29例,失访13例,最终完成QFR测量及随访的有231例。排除标准:(1)冠状动脉旁路移植术后或有明确冠状动脉旁路移植术指征;(2)心原性休克或需体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)支持、心肺复苏术后;(3)严重心脏瓣膜病,如主动脉瓣重度狭窄;(4)严重肾功能不全,如估算的肾小球滤过率<30 ml/min、尿毒症;(5)CAG图像无法进行QFR测量,如血管显影不清,严重重叠、短缩或扭曲,血管边界模糊等。所有患者均签署知情同意书。已通过厦门大学附属心血管病医院医学伦理委员会审核。
1.2 PCI手术及QFR测量原理、方法
所有患者均在厦门大学附属心血管病医院心脏导管室由2名高年资心内科介入医师经桡动脉或股动脉路径完成CAG及PCI,术后所有患者均在治疗基础疾病基础上给予CHD二级预防治疗。通过查阅智业电子病历系统及飞利浦影像系统收集所有入组患者的临床基线资料及CAG资料,术后由1名QFR工程师及1名高年资介入医师使用导管室的QFR检测仪(AngioPlus Galley,上海搏动医疗科技股份有限公司)进行QFR测量并记录。QFR测算原理[11-12]:与FFR类似,定义为当前冠状动脉为下游心肌提供的最大血流量(QSmax)与假设冠状动脉完全健康时提供的最大血流量(QNmax)之比。由于使用微循环扩张药物,如腺苷或腺苷三磷酸等,在心肌最大充血状态时冠状动脉微循环阻力达到最小极限值,心肌血流量与灌注压呈线性相关,因此可用冠状动脉远端压力(Pd)与冠状动脉开口压力(Pa)的比值近似代表血流量的比值。QFR最大充血状态下血流速度可通过计算CAG过程中对比剂充盈的平均血流速度转换得到,结合3D重建获得管腔形态变化参数,通过血流动力学分析可计算冠状动脉病变节段内压力阶差,进而得到QFR值。QFR计算包含三种不同的血流模型:固定血流模型QFR(fixed-flow QFR,fQFR)、对比剂血流模型QFR(contrast-flow QFR,cQFR)和诱导充血血流模型QFR(adenosine-flow QFR,aQFR)。三者的不同之处在于最大充血血流速度的获得方法,fQFR以大量临床数据的血流速度经验值作为边界条件进行QFR计算,cQFR和aQFR分别是通过注射对比剂和腺苷后采集的造影影像,结合心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)数帧法来计算患者个体化血流速度。FAVOR Pilot研究[13]分别对比了fQFR、cQFR和aQFR的诊断准确度,结果证实以FFR作为金标准,cQFR诊断精度优于fQFR(P=0.006),cQFR与aQFR的差异无统计学意义(P=0.646)。由于cQFR不需要腺苷等微循环扩张药,使用更加方便,故推荐临床上用cQFR作为QFR诊断的准确结果,故本研究也是采用cQFR血流模型来计算QFR。QFR测量方法:(1)导管室采集标准CAG影像;(2)将两个体位差>25°的CAG影像通过影像数据传输系统输送至AngioPlus Galley测量系统;(3)在线分析完成冠状动脉血管的分割、3D重建与血流动力学计算,进而实时快速计算出QFR。
1.3 终点和临床随访
主要临床终点为MACE,包括心原性死亡、非致死性急性心肌梗死和缺血驱动的血运重建。次要终点为MACE中的TVR。通过电话或查阅电子病历查看就诊记录来随访患者PCI术后2年内MACE发生情况。
1.4 统计学分析
所有数据均通过SPSS 25.0软件进行统计分析。非正态分布计量资料表示为中位数(四分位数间距),组间比较采用Wilcoxon秩和检验。正态分布计量资料表示为均值±标准差,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较使用卡方检验或Fisher精确概率法检验。通过受试者工作特征(receiver operating characteristic,ROC)曲线分析CHD-PCI术后QFR测量对患者发生MACE的诊断功效。使用广义线性模型对可能影响术后QFR值大小的临床因素进行分析。使用Kaplan-Meier法绘制生存曲线,组间比较使用Log-rank检验。使用多因素Cox回归分析MACE及TVR的影响因素。双侧检验以P<0.05为差异有统计学意义。
2 结果
2.1 QFR对PCI术后患者MACE发生的诊断效能
最终有231例患者纳入研究,绘制ROC曲线,计算Youden指数得到预测PCI术后患者发生MACE的QFR最佳临界值为0.92。根据该临界值将患者分成两组:QFR>0.92组(166例,71.9%),QFR≤0.92组(65例,28.1%)。结果显示,PCI术后QFR≤0.92对患者MACE发生有较好的预测价值,敏感度为0.655,特异度为0.772,曲线下面积(area under curve,AUC)为0.768(95%CI0.676~0.860,P<0.001,图1)。
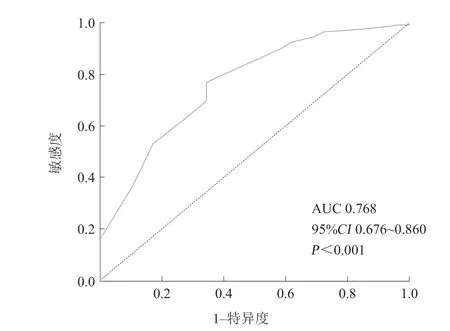
图1 QFR 对PCI 术后患者发生MACE 的诊断效能Figure 1 Diagnostic effi cacy of QFR for the occurrence of MACE events in patients after PCI
2.2 两组患者的基线资料比较
两组患者最小管腔直径及最大面积狭窄率比较,差异均有统计学意义(均P<0.05),其余基线特征指标比较差异均无统计学意义(均P>0.05,表1)。
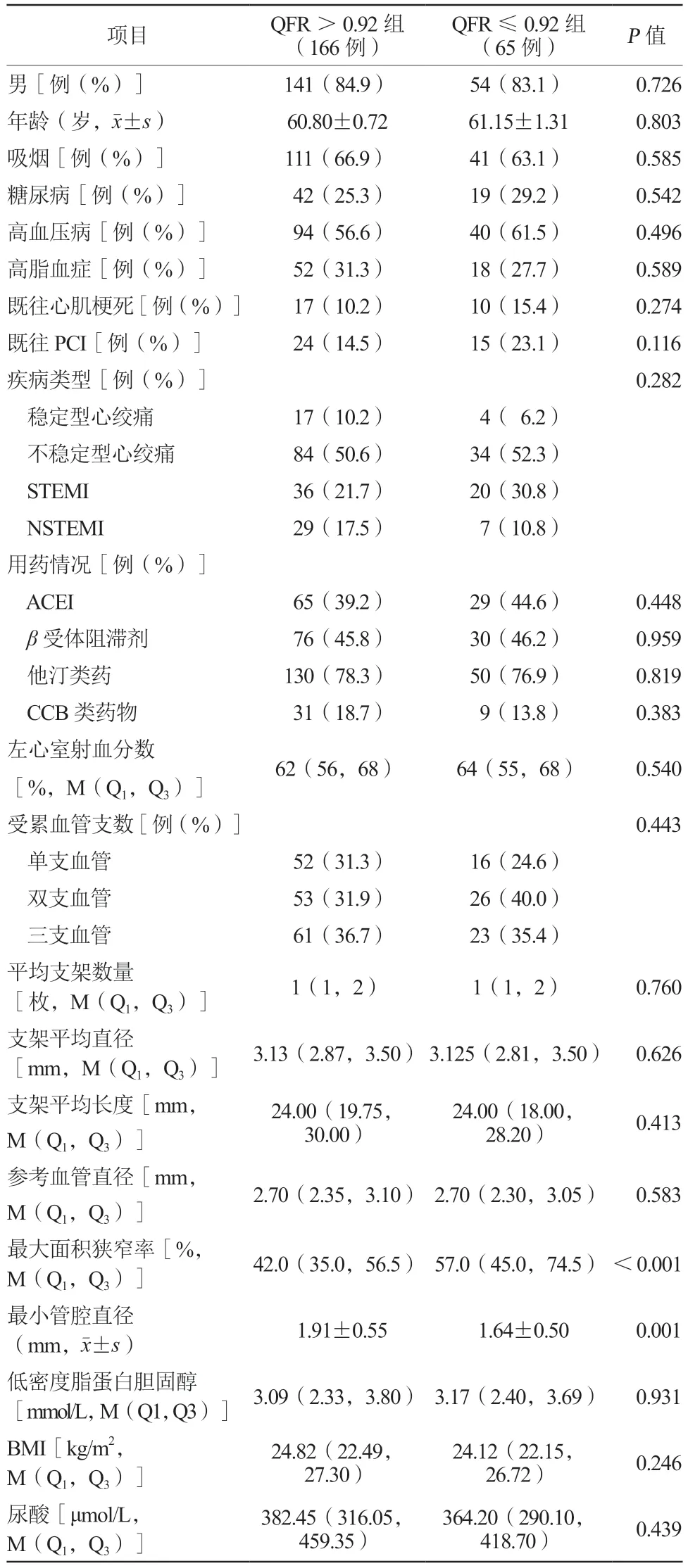
表1 两组患者的基线特征比较Table 1 Comparison of the baseline characteristics of the two groups of patients
2.3 患者的临床和血管特征的广义线性混合模型
对可能与PCI术后QFR相关的临床和血管特征进行广义线性混合模型分析,结果发现,糖尿病、高血压病、心肌梗死、三支血管病变、平均支架直径(每增加0.1 mm)、最小管腔直径与PCI术后QFR值均无明显相关(均P>0.05),而靶血管的最大面积狭窄率与PCI术后QFR值存在明显负相关(P<0.001),即靶血管的最大面积狭窄率越大,PCI术后QFR值越低(表2)。
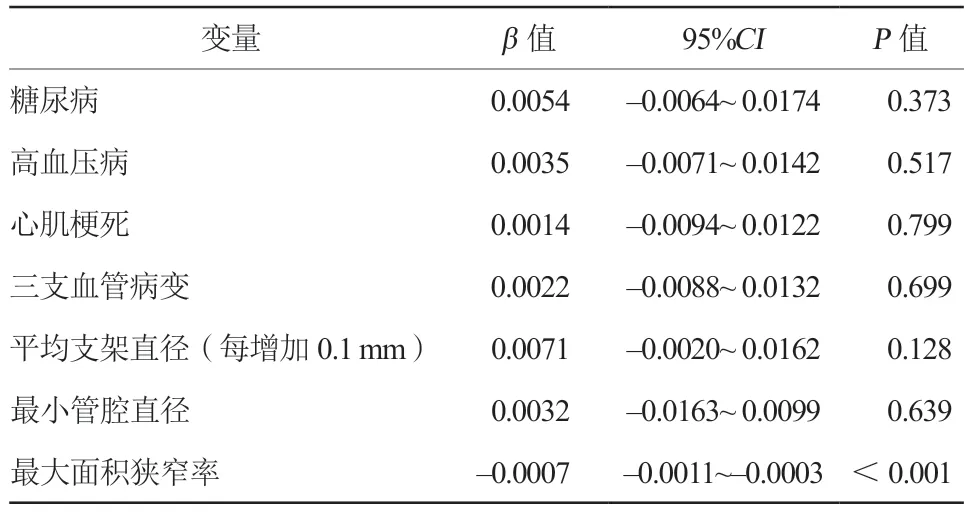
表2 患者的临床和血管特征的广义线性混合模型Table 2 Generalised linear mixed model of the patient’s clinical and vascular characteristics
2.4 MACE与Non-MACE患者PCI术后QFR值的比较
根据患者2年内是否发生MACE进行分组,发生MACE(29例)的患者(MACE组)PCI术后QFR值明显低于未发生MACE(202例)的患者(Non-MACE组)[0.91(0.86,0.95)比0.96(0.93,0.97),P<0.05],差异有统计学意义。
2.5 患者MACE情况
PCI术后2年发生MACE的患者有29例(12.6%)。其中,QFR>0.92组的患者有10例(6.0%),QFR≤0.92组的患者有19例(29.2%),差异有统计学意义(P<0.05)。心原性死亡的患者有2例(0.9%),急性心肌梗死有3例(1.3%),均发生在QFR≤0.92组的患者。缺血驱动的血运重建27例(11.7%),QFR>0.92组有10例(6.0%),QFR≤0.92组的患者有17例(26.2%)。TVR有10例(4.3%),其中QFR>0.92组的患者有3例(1.8%),QFR≤0.92组的患者有7例(10.8%),差异有统计学意义(P<0.05)。血运重建的方式包括DES置入术及药物洗脱球囊扩张术。DES置入术21例(9.1%),QFR>0.92组的患者有8例(4.8%),QFR≤0.92组有13例(20.0%)。药物洗脱球囊扩张术6例(2.6%),QFR>0.92组的患者有2例(1.2%),QFR≤0.92组的患者有4例(6.2%,表3)。
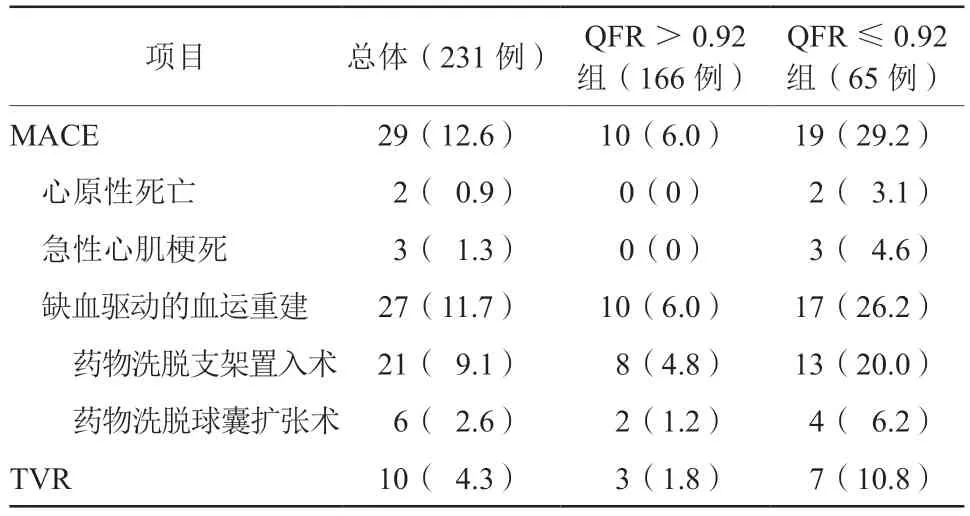
表3 患者MACE 情况[例(%)]Table 3 Distribution of MACE in patients[cases(%)]
2.6 患者MACE发生的单因素Cox回归分析
单因素Cox分析发现,高血压病、三支血管病变、最小管腔直径、最大面积狭窄率、PCI术后QFR值与患者MACE的发生有关,差异均有统计学意义(均P<0.05,表4)。
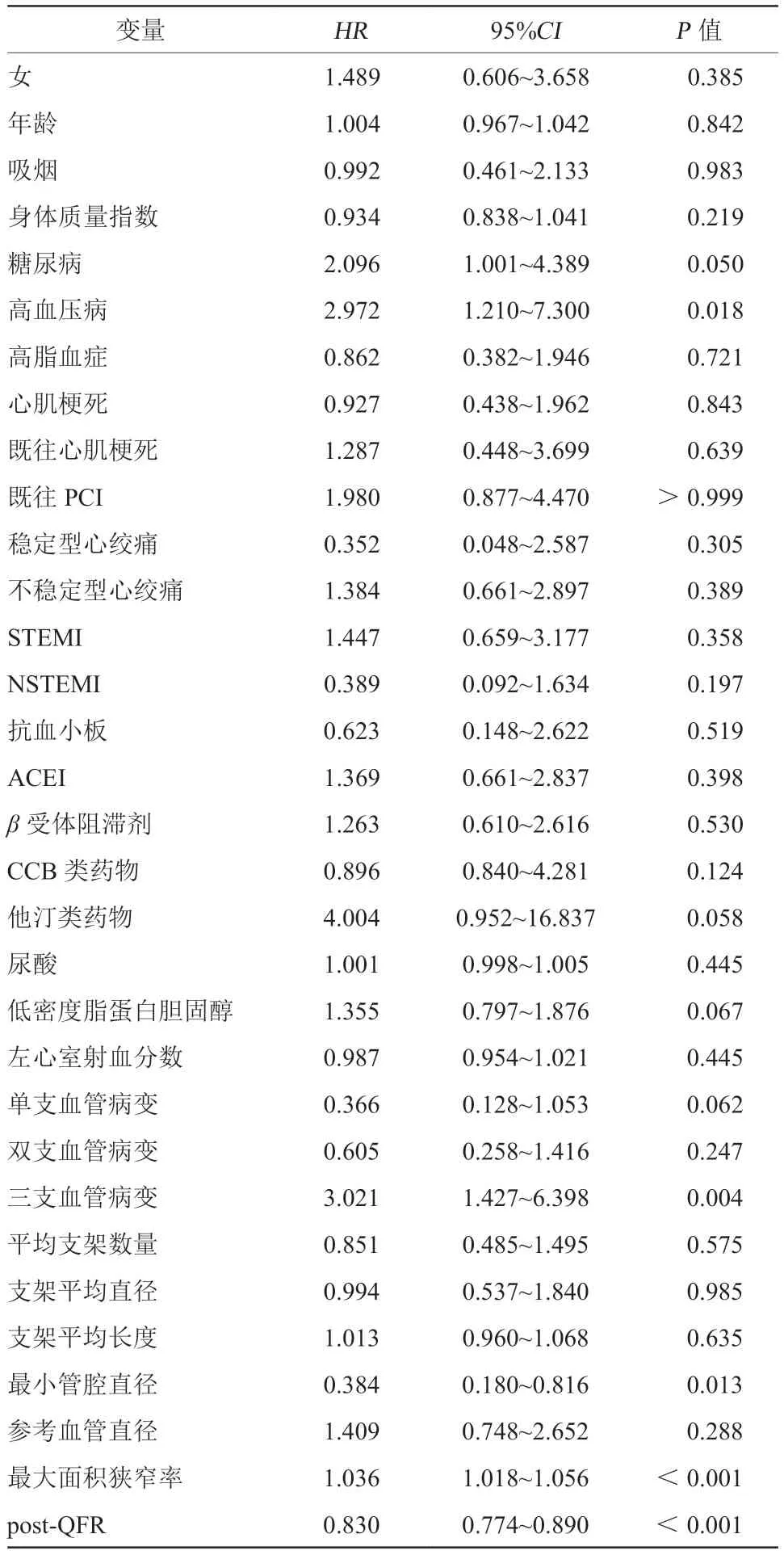
表4 患者发生MACE 相关的单因素Cox 回归分析Table 4 Univariate Cox regression analysis associated with the occurrence of MACE events in patients
2.7 患者发生MACE的多因素Cox回归分析
以患者是否发生MACE为因变量,将上述单因素分析获得的显著性指标以及潜在影响患者MACE发生的因素(包括急性心肌梗死、陈旧性心肌梗死、既往PCI)为因变量,进行多因素Cox回归分析显示,PCI术后QFR≤0.92(HR5.10,95%CI2.27~11.44)、三支血管病变(HR2.86,95%CI1.31~6.24)、最大面积狭窄率(HR1.03,95%CI1.00~1.06)是患者MACE发生的独立危险因素(图2)。
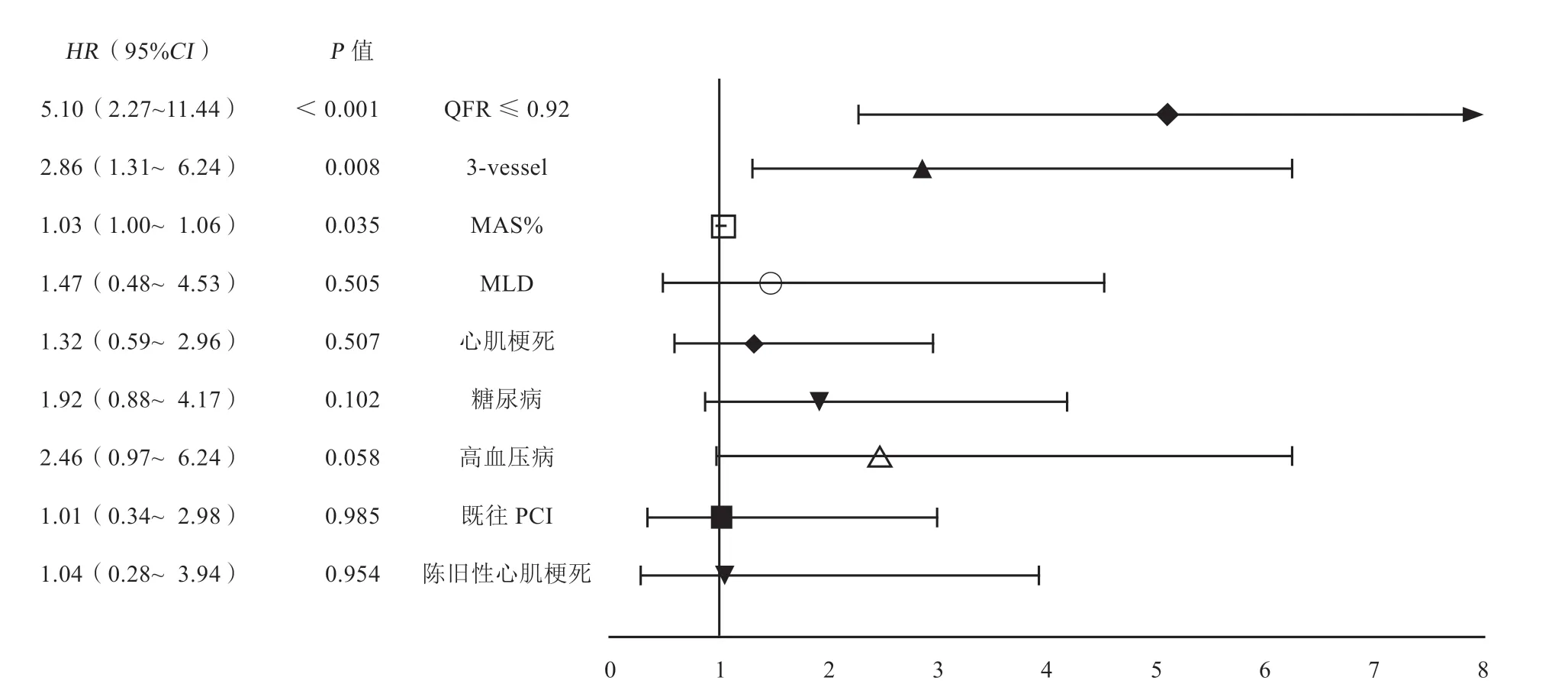
图2 患者发生MACE 相关的多因素Cox 回归分析Figure 2 Multi-factor Cox regression analysis associated with the occurrence of MACE events in patients
2.8 患者发生TVR的多因素Cox回归分析
以患者是否发生TVR为因变量,将上述单因素分析获得的显著性指标以及潜在影响患者TVR的因素(包括本次心肌梗死、陈旧性心肌梗死、既往PCI)为因变量,进行多因素Cox回归分析显示,PCI术后QFR≤0.92(HR5.45,95%CI 1.36~21.77)是TVR的独立危险因素(图3)。
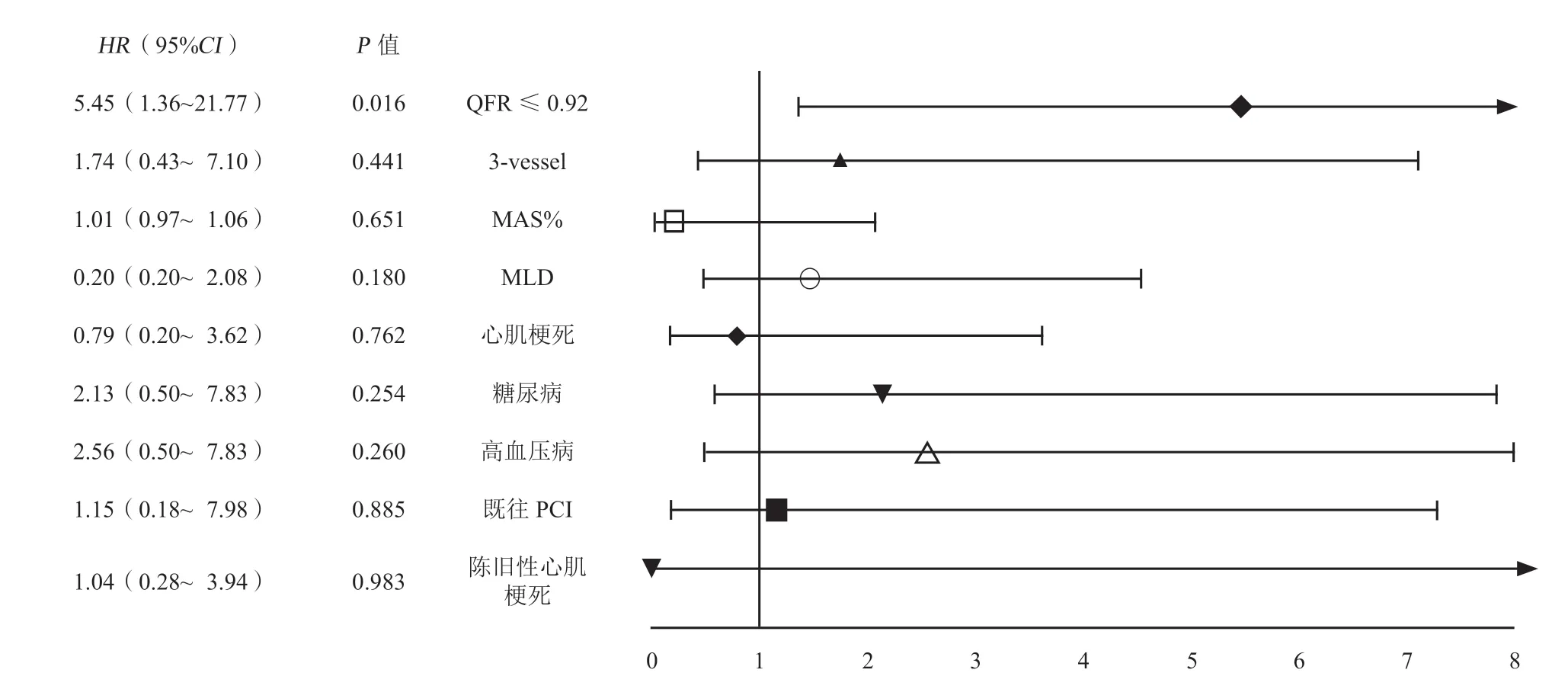
图3 患者发生TVR 相关的多因素Cox 回归分析Figure 3 Multi-factor Cox regression analysis related to target vessel revascularisation in patients
3 讨论
CHD患者PCI术后MACE发生现已成为临床关注的重点[14]。有研究显示,急性心肌梗死患者PCI术后1~7年内MACE的累积发生率为28.4%(每年增加4%~6%)[15]。另一项研究显示,PCI术后早期(1年内)比晚期(1年后)ISR引发心肌缺血的风险明显升高(37.5%比5.5%,P<0.001),TVR的风险也明显升高(37.5%比5.0%,P<0.001)[16]。近年来随着PCI技术的发展,如血管内超声(intravascular ultrasound,IVUS)、光学相干断层成像(optical coherence tomography,OCT)、FFR等越来越多的新技术用于优化PCI,PCI术后患者的预后已得到明显改善,已有多项研究推荐PCI术后应常规行FFR检测等功能学评估,并且一致认为PCI术后较高的FFR值与患者更好的临床结局相关。一项荟萃分析发现,PCI术后预测MACE的FFR临界值为0.90,且FFR≥0.90的患者MACE发生率显著下降(HR0.71,95%CI0.59~0.85,P=0.003),TVR风险也显著下降(HR0.43,95%CI0.34~0.56,P<0.0001)[17]。由于血管内压力导丝位置的敏感点不同,FFR测量不仅会受到支架段和非支架段的影响,还会受到远端血管病变和微循环障碍的影响。因此,目前各研究PCI术后FFR的临界值尚不一致,但一致认为PCI术后FFR值越高,患者临床预后越好[10]。
多项研究已证实QFR与FFR有高度相关性和一致性[8-9,18],而QFR研发的核心理念是为临界性冠状动脉病变的诊断提供一种更为简单、安全及准确的方法,已有相关研究显示使用QFR指导冠状动脉临界病变血运重建的患者远期临床结局更好[19]。FAVOR Ⅲ China[20]显示,QFR指导组PCI术后患者2年内MACE发生率仅为8.5%,与造影指导组(12.5%)相比,相对风险显著降低了34%,这主要得益于QFR可以避免目测指导带来的偏差从而改变介入治疗策略。在QFR指导组中完全符合QFR指导(QFR≤0.80的血管均接受PCI)的患者所占比例更高,MACE发生率更低,也就是临床预后更好。
但是目前临床上PCI术后QFR与CHD患者远期MACE发生关系的研究仍较少,其结论尚存在争议。本研究主要探讨了PCI术后QFR对CHD患者2年内MACE发生的预测价值,并探究其最佳临界值,进一步分析与PCI术后QFR值、患者MACE发生相关的影响因素。本研究发现,预测CHD患者PCI术后2年内患者MACE发生的最佳临界值为0.92,AUC为0.768(95%CI0.676~0.860,P<0.001),QFR≤0.92组的患者MACE发生的风险明显升高(HR5.10,95%CI2.27~11.44,P<0.001)。Kogame等[10]研究显示,三支血管病变患者PCI术后QFR的中位数为0.93(0.87,0.97),预测PCI术后2年内血管相关复合终点(vessel-oriented composite endpoint,VOCE)的最佳临界值为0.91,AUC为0.702(95%CI0.633~0.772,P<0.001),PCI术后QFR<0.91的患者VOCE发生的风险明显升高(HR3.37,95%CI1.91~5.97)。而HAWKEYE研究[21]显示,PCI术后QFR的中位数为0.97(0.92,0.99),预测PCI术后2年内VOCE发生的最佳QFR临界值为0.89,AUC为0.77(95%CI0.74~0.80,P<0.001),PCI术后QFR≤0.89的患者VOCE发生的风险明显升高(HR2.91,95%CI1.63~5.19)。本研究QFR临界值与Kogam等研究接近,Kogame等[10]研究纳入的均是三支血管病变患者,本研究三支血管病变病例也较多。而HAWKEYE研究QFR较低,其纳入的人群约半数为稳定型心绞痛患者,而本研究纳入的病例急性冠状动脉综合征占大部分。有研究显示急性冠状动脉综合征患者由于急性心肌损伤,或不稳定斑块及血栓的脱落通常会导致微循环障碍[22],导致微循环阻力指数升高,使心肌的供血范围缩小,使冠状动脉远端压力升高,测得的FFR值会偏高,进而导致测得的cQFR值也会偏高。因此,临床上对于合并急性冠状动脉综合征等微循环障碍高危人群应该高度重视,QFR的临界值应该控制得更加严格,应采取更加积极的治疗方案(如延迟双联抗血小板时间、注射PCSK9抑制剂等),以改善患者远期预后。
本研究QFR>0.92组及QFR≤0.92组患者的基线特征基本一致,除了最小管腔直径和靶血管最大面积狭窄率,其余差异均无统计学意义(均P>0.05)。本次研究根据既往PCI术后QFR与患者MACE发生的研究设计,选择了糖尿病、高血压病、急性心肌梗死、陈旧性心肌梗死、既往PCI、三支血管病变、平均支架直径,另外还增加了PCI术后靶血管的最大面积狭窄率及最小管腔直径纳入广义线性混合模型进行分析,结果显示PCI术后靶血管的最大面积狭窄率与QFR值呈负相关,即靶血管最大面积狭窄率越大,测得的QFR值越低。Biscaglia等[21]研究也显示PCI术后靶血管的直径狭窄率与QFR值呈负相关。QFR是通过CAG过程对比剂的充盈速度模拟计算出最大充血血流,结合血管壁的形态变化,计算冠状动脉病变血管段压力下降的数值(∆P),进而得到血管远端压力和近端压力的比值。血流经过狭窄血管段与管壁的摩擦增大,在扩张段血流紊乱,均可导致能量损失,使得血管近端与远端的压差增加,导致远端压力下降,而导致QFR下降。可见靶血管最大面积狭窄率越大则会增加压差,进一步降低QFR值。但本研究并未发现PCI术后QFR值与糖尿病、既往心肌梗死等相关,分析可能的原因是本研究的样本量较少,且存在测量误差,未来需进一步扩大样本量验证。
本研究中,PCI术后2年患者MACE发生率为12.6%,其中心原性死亡率0.9%,急性心肌梗死发生率1.3%,TVR发生率4.3%。而Abdel-Wahab等[23]研究显示,PCI术后中位数15个月内患者MACE发生率为17.7%,其中心原性死亡率4.4%,心肌梗死率3.4%,TVR的发生率为9.9%。可见本研究MACE发生率较低,分析原因可能是Abdel-Wahab等研究纳入的是复杂、严重钙化病变的患者,而本研究中这类人群相对较少,冠状动脉血管严重钙化的患者可能会导致支架贴壁不良、支架膨胀不全等,而这些因素是导致PCI术后MACE发生的重要原因。另外有研究显示,经过旋磨术处理的冠状动脉严重钙化的患者PCI术后QFR预测3年靶病变失败的最佳临界值为0.94,QFR>0.94的患者靶病变失败率为9.4%,而QFR≤0.94的患者靶病变失败率则高达66.7%[24]。而本研究中QFR预测2年患者MACE发生的最佳临界值是0.92,QFR>0.92的患者TVR发生率为1.8%,QFR≤0.92的患者TVR的发生率为10.8%,可见冠状动脉严重钙化患者PCI术后远期预后较差。严重钙化病变多存在冠状动脉远端微循环阻力指数升高,且钙化病变经过旋磨术处理后靶病变狭窄程度会明显减轻,靶血管的最大面积狭窄率会降低,测得的QFR值自然偏高。在临床上对于严重钙化的CHD患者需要引起足够的重视,一旦发现PCI后QFR值低于该临界值,往往提示支架膨胀不良,仍残留较多钙化病变,则建议采用冲击波球囊等有效手段进一步优化DES置入,进而提高PCI后QFR值,以帮助改善患者远期临床预后。
本研究单因素分析发现,高血压病、三支血管病变、最小管腔直径、靶血管最大面积狭窄率、PCI术后QFR值与患者MACE的发生有关,将上述因素纳入多因素Cox回归分析并调整了潜在混杂因素后,发现PCI术后QFR≤0.92、三支血管病变、靶血管最大面积狭窄率是患者MACE发生的独立预测危险因素,且QFR ≤0.92组的患者比QFR>0.92组发生MACE的风险显著升高(HR5.10,95CI% 2.27~11.44,P<0.001)。前面已经证实靶血管最大面积狭窄率越高,测得QFR值越低。Erbay等[25]也研究显示,PCI术后QFR ≤0.89、三支血管病变是CHD患者发生MACE的独立预测因素。因此,临床上对于合并三支血管病变,术后QFR≤0.92及靶血管最大面积狭窄率较大的PCI术后患者应该引起足够的重视,应该采取更加积极的治疗策略及更加严格的危险因素控制来帮助改善患者的远期预后。
综上所述,CHD患者PCI术后常规进行QFR测量十分关键,对患者PCI术后的远期MACE发生具有较高的预测价值。PCI术后较低的QFR值与患者不良临床结局明显相关,对于PCI术后QFR≤0.92的CHD患者,临床上应该引起高度重视,应采取更加积极的优化干预手段以提高患者术后QFR值,帮助改善患者远期临床预后。
本研究为单中心前瞻性研究,研究样本量较少,多因素Cox纳入因素较多,存在一定的选择偏倚,且未严格区分CHD类型,存在一定的局限性。此外本研究没有测量FFR,并未验证QFR和FFR的一致性,未来可结合FFR检测来进一步验证QFR评估PCI术后远期预后的应用价值。有研究指出不稳定斑块可能与患者PCI术后的MACE发生相关[26],但本研究并未使用IVUS、OCT等腔内影像学技术对血管内斑块的性质进行检测,需要后续研究进一步验证。
利益冲突所有作者均声明不存在利益冲突

