程序性铁死亡及其与蜱唾液腺退化关系的研究进展
袁冬琪,曹杰,周金林
(中国农业科学院上海兽医研究所,上海 200241)
1 程序性铁死亡
2012年,Dixon等[3]首次报道了程序性铁死亡(Ferroptosis)相关的研究。程序性铁死亡是一种铁依赖性的,由一种新型化合物Erastin诱导的,区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞死亡方式。铁作为人体必需的微量元素,主要存在于血液的血红蛋白中,参与氧的运输以及生物氧化过程[4]。然而,细胞内铁含量过载时,可以引起线粒体氧化磷酸化途径异常,产生大量的活性氧类(reactive oxygen species,ROS),在二价铁或酯氧合酶的作用下,氧化细胞膜上高表达的不饱和脂肪酸发生脂质过氧化,从而诱导细胞死亡。因此,在细胞形态上,程序性铁死亡较为标志性的表现为细胞线粒体变小,膜密度增高,嵴减少;细胞成分上表现为脂质过氧化增高以及ROS增高。
根据目前的相关研究来看,程序性铁死亡通过清除环境中缺乏关键营养素或因感染或环境压力而受损的细胞,在抑制肿瘤发生中起着关键作用,逐渐被认为是消除恶性细胞、减轻毒素损伤的一种适应性特征[5]。可见于一些病理损伤,如脂质过氧化引起的毒素作用,缺血再灌注损伤,血色素沉着小鼠模型,而且可能在谷氨酸诱导的兴奋性毒性过程中导致细胞死亡。也有报道说明程序性铁死亡与神经退行性疾病有关[4]。这些研究表明,程序性铁死亡是一种程序性细胞死亡方式,且可能与动物生理和病理进程密切相关。
1.2 程序性铁死亡与细胞凋亡、自噬、坏死的区别及联系 细胞死亡的方式依照表观形态学可分为细胞凋亡、细胞自噬以及细胞坏死等不同的死亡方式[6]。细胞凋亡是为了维持体内环境稳定,由基因控制的自发的、有序的死亡方式[7]。在形态上表现为细胞体积缩小,与周围的细胞脱离,细胞质密度增加,核质浓缩,核膜核仁破碎,最终形成凋亡小体[8]。细胞自噬则会形成与溶酶体融合的自噬小体[9]。而细胞坏死则表现出明显的炎症反应,细胞器肿胀,细胞质膜破裂,胞内物质释放[9]。
与以上三种细胞死亡方式均不同,程序性铁死亡在生物化学方面会出现铁离子累积、谷胱甘肽(Glutataione,GSH)耗竭,在细胞形态上主要表现为线粒体变小、膜密度增高、线粒体嵴减少或消失、细胞膜断裂和出泡等,细胞核中变化不明显[3,10]。但程序性铁死亡尚未有类似凋亡小体形成的特征性形态表现被发现,目前对程序性铁死亡是否发生的表观形态学判断主要依赖于线粒体形态的变化。
根据现有的一些研究,程序性铁死亡可能与其他细胞死亡方式存在一些联系。2015年,Fearnhead等[5]发现,在癌症发展中有介导细胞凋亡作用的蛋白p53,对程序性铁死亡也有调控作用。2019年,Zhang等[11]报道了BRD7-P53-SLC25A28形成的信号通路在调节肝星状细胞(Hepatic stellate cells,HSCs)铁死亡过程中起关键作用。这表明程序性铁死亡可能与细胞凋亡存在互作。马德亮等[12]认为,铁死亡/凋亡混合途径是一种新的癌症治疗策略。2018年,Zhang等[13]发现,ELAVL1与BECN1 mRNA的相互作用是触发自噬激活的关键分子事件,可促进自噬型铁蛋白降解,进而导致程序性铁死亡。2019年,根据Wu等[14]的研究,分子伴侣介导的细胞自噬参与了程序性铁死亡的执行。同时有研究表明,铁蛋白的自噬转化(Ferritinophagy)是引起程序性铁死亡的关键[15]。由此可见,程序性铁死亡是一个细胞自噬性死亡过程[16]。
2 程序性铁死亡的机制
2020年,Hadian等[17]绘制了较详细的程序性铁死亡通路图(图1)。程序性铁死亡会由脂质代谢异常、铁代谢异常以及氨基酸代谢异常引起。本文将从此三个方向阐释程序性铁死亡机制并总结程序性铁死亡在近年来的研究进展。
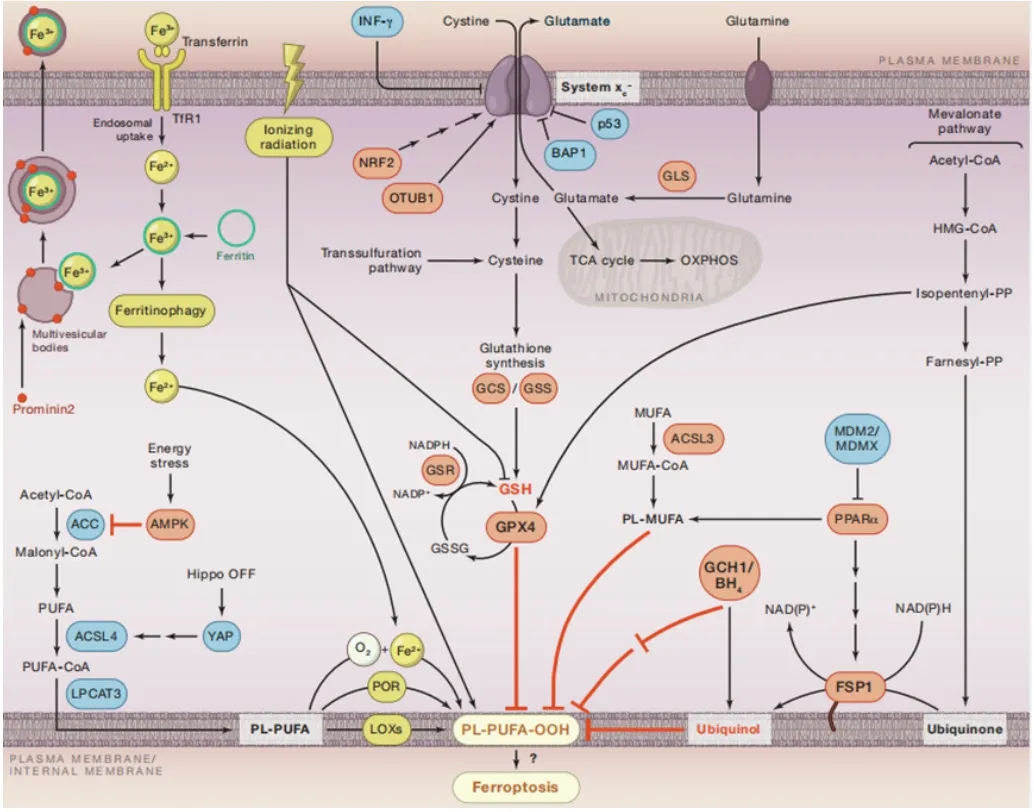
图1 程序性铁死亡机制[17]Fig.1 The mechanism of ferroptosis
2.1 脂质代谢异常 脂质作为构成生命体的基本物质来说,其代谢与生命体执行正常功能密不可分。在细胞死亡方面,细胞内饱和脂肪酸与单聚不饱和脂肪酸的比例增加,是启动细胞凋亡途径的信号之一[18];而长链脂肪酸增加时,细胞坏死途径可被启动[19]。对于程序性铁死亡来说,脂质氧化应激及其引起的膜损伤是致使其发生的关键[20]。而其中,具有不稳定的碳碳双键的多不饱和脂肪酸(fatty acids,PUFAs)是引起脂质过氧化形成大量脂质活性氧的主要来源[21]。
在室女绝户继承体现了女性财产权的相对独立。所谓相对,代表女性依旧不是可以和男子享有相同财产权利的民事主体,这是“一准乎礼”的法律制度下的必然结果。所谓独立是指,女子的继承权尤其是在南宋时期扩大了,女性在继承份额、对奁资的处分权等方面都有所扩大,它的存在具有与此相对应的社会、法律、经济基础。
程序性铁死亡的调节涉及控制关键磷脂底物的丰度,驱动其过氧化作用的因素,以及消除这些脂质过氧化物的因素[20]。当程序性铁死亡发生时,由于对过氧化化学的固有敏感性,过氧化反应的底物是具有多不饱和酰基尾的磷脂(PL-PUFAs),这些PL-PUFAs是由ACSL4和LPCATs等酶产生的,这些酶可以激活游离的PUFAs并将其转化为磷脂[17]。2016年,Yang等[21]发现脂氧合酶(lipoxygenases,LOXs)通过依赖于磷酸化酶激酶G2(phosphorylase kinase G2,PHKG2)的铁池来氧化PUFAs,这对于程序性铁死亡的发生是必要的[21]。亦有研究证明PUFAs的含量和定位会对细胞内发生脂质过氧化的程度造成一定影响,继而影响程序性铁死亡发生的剧烈程度[22]。
2.2 铁代谢异常 血液中含有丰富的铁离子,是大多数生命体所必需的微量元素之一,其代谢与生命体维持稳态与正常活动息息相关。因此,生物体内铁的稳态受到严密的调控。正常情况下,在生物体中,细胞膜上的膜蛋白转铁蛋白受体1(transferrin receptor 1,TfR1)将三价铁离子转运至细胞内,在内质网中被金属还原酶STEAP3还原为二价铁离子,之后在溶质载体家族11成员2/二价金属离子转运体(SLC11A2/DMT1)的介导下,从内体(Endosome),即膜包裹的囊泡结构,释放到细胞质不稳定铁池中[23]。当铁离子代谢异常造成铁蓄积时,即细胞内二价铁离子增多时,会发生芬顿反应。芬顿反应指二价铁离子与过氧化氢(H2O2)混合溶液发生的反应,具有将羧酸、醇、酯类等常见有机化合物氧化为无机态的强氧化性。在这里,细胞内过量的游离二价铁与过氧化氢反应,产生可损害细胞DNA、蛋白质、脂质等的羟基自由基和高反应性的ROS,诱导程序性铁死亡的发生[23]。2020年,Fang等[24]证明了将与三价铁离子结合并对其进行转运的铁蛋白(Ferritin)基因敲除后,会加速心脏的程序性铁死亡。铁蛋白发生自噬释放二价铁离子后,促进过氧化,推动程序性铁死亡的发生。程序性铁死亡发生期间,当PL-PUFAs被纳入到膜环境中,铁依赖的酶和不稳定的铁使用分子氧(O2)进行过氧化反应,产生PL-PUFA-OOH[20]。2017年,Doll等[25]发现程序性铁死亡发生时,大量铁离子分布于细胞线粒体及内质网中。因此,铁的摄取、转运和储存都会对铁死亡产生一定的调节作用[12]。
2.3 氨基酸代谢异常 氨基酸的代谢在程序性铁死亡中也发挥着重要作用,主要表现在谷氨酸代谢方面。
胱氨酸/谷氨酸反向转运体(System Xc-),由轻链亚基(SLC7A11)和重链亚基(SLC3A2)通过二硫键连接形成的异二聚体,是细胞重要的抗氧化系统,Xc-在将细胞内的谷氨酸转运到细胞外时,可将等量的胱氨酸转运至细胞内[26]。胱氨酸进入细胞内后被还原成半胱氨酸,参与谷胱甘肽(glutathione,GSH)的合成。GSH作为细胞抗氧化系统的重要组成部分,可以清除自由基。在GPx4的催化作用下,GSH能够将对细胞有毒性作用的脂质过氧化物还原为无毒的脂肪醇[27]。因此,高浓度的谷氨酸环境以及药物如Erastin等可通过抑制Xc-对胱氨酸的转运继而影响GSH的合成,导致无法及时清理脂质过氧化物,诱导程序性铁死亡发生[3]。因此,氨基酸代谢异常所引起的程序性铁死亡本质上依然归结于脂质过氧化物的产生。
2.4 程序性铁死亡的关键分子 对于程序性铁死亡来说,调节铁死亡的关键是参与铁代谢和脂质过氧化的各种分子和信号。
根据现有的研究来看,程序性铁死亡的其中一条机制与谷氨酸的代谢有关。在最早报道程序性铁死亡的研究中,新型化合物Erastin和谷氨酸一样,通过抑制胱氨酸/谷氨酸的反向转运体(Xc-)对胱氨酸的吸收,在细胞的抗氧化防御中创造一个空洞,最终导致铁依赖性的氧化死亡[3]。GPx4作为抗氧化系统中维持谷胱甘肽平衡的关键酶,被认为是调控程序性铁死亡的重要靶点[28]。2019,Gong等[29]研究证明GPx4敲除细胞会引起脂质过氧化物堆积最终引起程序性铁死亡。2015年,Jiang等[30]报道抑癌蛋白p53通过抑制胱氨酸/谷氨酸反向转运体的关键成分SLC7A11的表达,抑制胱氨酸摄取并使细胞对程序性铁死亡作用敏感。2019,Fang等[24]研究证明心肌细胞膜上胱氨酸/谷氨酸反向转运体的功能亚基SLC7A11下调导致的胞内胱氨酸和还原型谷胱甘肽(GSH)缺乏是诱发心肌细胞发生程序性铁死亡的主要机制。由此可见,SLC7A11是程序性铁死亡发生的一种关键作用分子。近年来,HMGB1逐渐被认为是程序性铁死亡中的关键作用分子。HMGB1是一种通过RAS-JNK/p38通路的新型程序性铁死亡调节因子[31],Wen等[32]证明了HMGB1是由发生程序性铁死亡的细胞以自噬依赖的方式释放的一种损伤相关分子模式分子。
3 蜱唾液腺退化
3.1 硬蜱简介 蜱对于生活在热带和温带地区的人类来说,是很常见的生物。在人类和动物之间的疾病传播中,蜱起着重大作用,是仅次于蚊子的第二大传播媒介。可对公共卫生、畜牧行业造成巨大影响。
蜱是专性寄生虫,完全以大部分哺乳动物、鸟类等脊椎动物的血液为食。与其他节肢动物叮咬宿主快速吸血的方式不同,蜱进化出了一种特殊的长时间地附着于宿主皮肤上的吸血方式,即利用口器作为附着器,用来吸食血液。当到达宿主皮肤时,蜱虫插入它的螯肢,切割并撕裂角质层、细胞表皮层和真皮外层,然后嵌入口器。血液很快从破裂的血管流到伤口部位,形成一个供血池。硬蜱在血池中缓慢吸血发育几天,且吸血量较大,过程时长视成长阶段而定。同时消耗所吸食血液,使身体逐渐扩张。
利用这种附着吸血方式,蜱的唾液腺通过在吸血过程中分泌大量生物活性分子,发挥抗凝血、抗炎症、免疫抑制等功能[33]。促进血液和其他液体的流动,避免被宿主识别和排斥,由此吸食到大量血液,从而使蜱体型大大增加。快速吸血的软蜱体重可达吸血前的5~10倍,而硬蜱可高达100倍。在吸血过程中,蜱成功完成病原的传播,蜱唾液是病原体传播和建立的主要决定因素。
3.2 蜱唾液腺退化的发生 随着吸血功能的完成,成蜱唾液腺存在显著的退化现象,唾液腺在蜱饱血后体积急速变小,多数腺泡出现自溶解。在蜱唾液腺退化同时,蜱通过消化吸收所吸食血液中的营养成分,促进卵巢发育并为产卵做准备。因此,了解蜱唾液腺退化对蜱的防治防控有重要意义。
根据Friesen等[34]在2009年的报道,雌蜱唾液腺退化的先决条件是超过临界重量,脱离宿主是触发因素。2008年,L'Amoreaux等[35]揭示了血红扇头蜱(Rhinpicephalussanguineus)雄蜱唾液腺退化时的形态特征,如唾液腺分泌物减少且部分存在颗粒性损伤,细胞间的界线变模糊,细胞形状以及细胞核形态均发生变化,胞质收缩呈空泡状态。这些变化共同导致细胞破裂释放凋亡小体。
3.3 蜱的红细胞消化及铁离子代谢 在大多数真核生物中,血红素和铁的稳态基于血红素生物合成和血红素加氧酶介导的动态平衡,自身血红素的合成主要通过发生在线粒体和胞浆中进化保守的多酶途径。而蜱缺乏血红素加氧酶编码基因,血红素生物合成途径不完全。2016年,Perner等[36]发现蜱无法从血红蛋白衍生的血红素中获得生物可利用的铁,需要吸食宿主血液为外源性血红素来源,用以繁殖后代。因此,血液和铁离子的代谢是一个不可忽视的重要抗蜱靶点。
与哺乳动物铁蛋白主要起储存铁功能不同的是,在节肢动物中,铁蛋白承担了运输铁离子的功能。例如蚊子的铁蛋白通过血淋巴携带铁离子,然后将铁传递到其他组织。昆虫铁蛋白的晶体结构是由12个重链和12个轻链亚基组成的四面体对称结构,而哺乳动物铁蛋白的晶体结构则是由24个重链和24个轻链亚基组成的八面体对称结构[37]。2013年,Galay等[38]在长角血蜱(Haemaphysalis longicornis)体内发现两种铁蛋白——HlFer1和HlFer2,这两种铁蛋白在蜱体内转录及翻译水平较高,且对于蜱的吸血及成功繁殖有重要影响。蜱吸食血液后,在中肠中消化吸收,部分宿主来源分子穿过肠壁进入血淋巴,在开放体腔中进入唾液腺。蜱通过铁蛋白转运来自宿主血液的大量铁离子。
然而,近年来有研究发现,镰型扇头蜱的唾液腺以及唾液中的外泌体中均有与铁离子消化有关的铁蛋白,对此现象进一步研究发现铁蛋白可能参与蜱唾液腺退化过程,并提示蜱唾液腺退化可能有程序性铁死亡的参与[39]。
3.4 蜱唾液腺退化的分子机制 蜱唾液腺及唾液内容物复杂且多变,2018年,Perner等[40]揭示了蜱唾液内容物随时间变化而变化,同时指出了单个蜱体内唾液的独特性。最早在上世纪80年代,有研究人员观察到蜱的唾液腺退化现象,并发现蜕皮激素在体外实验中可以诱导蜱唾液腺退化。
在以往的研究中,研究人员认为蜱的唾液腺退化,既不是坏死,也不是病理性,其被认为是蜱体高度精准调控的程序化细胞死亡的生理学过程。在针对节肢动物的研究中,程序化细胞死亡已有一定的研究基础。在节肢动物中,研究人员以果蝇作为模式生物在节肢动物的细胞程序性死亡上取得了一定的突破。多项针对多种节肢动物的研究显示,节肢动物中细胞凋亡通路依赖于细胞色素C的介导,例如果蝇中发现的一种细胞色素C基因cyt-c-d参与胱天蛋白酶原(caspase)激活,鳞翅目中一氧化氮诱导的细胞凋亡涉及细胞色素C的释放[7]。不仅如此,多项研究表明脂类小分子、蜕皮激素等都可以诱导节肢动物细胞的自噬程序性死亡[7]。
目前,随着科学技术手段的进步,多用组学及差异分析技术在蜱唾液腺退化过程中的应用,证明了细胞程序性死亡是蜱饱血后唾液腺退化的主要机制。2018年,王笑[41]利用iTRAQ定量蛋白质组学技术分析了长角血蜱雌蜱唾液腺退化过程中4个时间点所有蛋白的表达量变化并进行了GO及KEGG通路分析,结果显示,细胞凋亡通路在唾液腺退化过程中起到重要作用。他们对在节肢动物细胞凋亡通路中起重要作用的细胞色素C、凋亡诱导因子等逐一进行RNA干扰,结果显示雌蜱饱血体重、产卵量和孵化率等均发生下降。同年,有研究报道,通过对未吸血和饱血后的蜱唾液腺进行转录组测序并进行差异分析,对不同吸血时期蜱唾液腺中自噬和凋亡相关的关键基因进行动态检测,对镰形扇头蜱(Rhipicephalushaemaphysaloides)中的ATG5同源基因进行鉴定和功能研究,发现蜱唾液腺的退化与细胞自噬和细胞凋亡紧密相关[42]。2020年,Xiao等[43]通过RNA干扰实验发现促进凋亡的Hippo蛋白在长角血蜱唾液腺退化中发挥作用。同年,Wang等[44]以镰型扇头蜱为研究对象,发现参与细胞凋亡的Caspase家族在蜱唾液腺退化中起作用。
2020年,Jia等[45]共同构建了多种蜱的基因组,探索了蜱类常见的血红素和血红蛋白消化、铁代谢、活性氧代谢等遗传基础,为针对蜱的研究奠定了基础。
4 展望
蜱与其他吸血昆虫不同,其利用唾液腺分泌大量活性分子,逃避宿主识别达到大量吸血的目的,蜱吸食血液后,在中肠中消化吸收,部分宿主来源分子穿过肠壁进入血淋巴,在开放体腔中进入唾液腺,由此在吸血过程中传播大量病原。Galay等[38]研究证实了蜱体内存在较高转录及翻译水平的铁蛋白,且对于蜱的吸血及成功繁殖有重要影响[38]。蜱通过铁蛋白转运,消化来自宿主血液的大量铁离子。然而,近年来有研究发现,蜱的唾液腺以及唾液中的外泌体中均有与铁离子消化有关的铁蛋白[39]。同时,铁离子的代谢作为程序性铁死亡发生机制的一个重要组成部分,由铁蛋白参与调控。
以上证据引起我们的猜测,近年来新发现的、可能与细胞凋亡存在互作关系的程序性铁死亡是否参与细胞凋亡占主导的蜱唾液腺退化过程?蜱特有的铁蛋白是否参与蜱体内的程序性铁死亡?因此,能否利用程序性铁死亡机制是否可以作为抗蜱靶点阻断蜱的吸血过程从而达到阻断病原传播过程,还有待进一步研究。

