牛传染性鼻气管炎病毒gB ELISA抗体与中和抗体相关性分析
史喜绢,申超超,张大俊,杨 博,张 婷,郑海学,张克山
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 国家口蹄疫参考实验室,兰州 730046)
牛传染性鼻气管炎(infection bovine rhinotrcheitis,IBR)是由牛传染性鼻气管炎病毒(Infection bovine rhinotracheitis virus,IBRV)引起的高度接触性传染病。主要表现为牛上呼吸道炎、结膜炎、传染性脓疱性外阴道炎或龟头包皮炎、新生胎牛的全身性感染,有时也可诱发小牛脑炎等其他类型的疾病[1-2]。该病具有广泛的嗜组织性,且呈世界性分布,给养牛业和乳制品行业造成了不可估量的经济损失[3-4]。IBRV又称牛Ⅰ型疱疹病毒(Bovine herpesvirus 1,BHV-1),属于疱疹病毒科水痘病毒属,只有1个血清型,分4个亚型[5]。该病毒是有囊膜的双股DNA病毒,囊膜蛋白在病毒致病中发挥了重要作用。BHV-1基因组有70多种结构蛋白,其中10种为糖蛋白[6]。gB作为最重要的结构糖蛋白,在病毒吸附、进入细胞及细胞间扩散和融合中起着重要作用,可刺激机体产生大量的中和抗体,是BHV-1中最保守的抗原蛋白[7-8],也是疫苗研发或诊断的主要靶点[9]。
IBR具有宿主特异性,虽然牛被认为是该病毒唯一的宿主,但也有猪、羊等动物感染本病的报道[10],病牛和带毒牛为主要的传染源,其中最危险的便为隐性带毒动物[11]。目前,除少数国家彻底消灭了IBRV以外,其他大多数国家均有不同程度的IBRV的流行。1993年全球范围内IBRV的检测率达到了60%,1995年对大型牛场进行IBRV普查,结果表明了IBRV 的检出率为50%,在意大利、新西兰、英格兰等对牛场进行检测,均发现IBRV[12]。我国于1982年首次在从大洋洲进口的牛中分离得到IBRV,但当时对该病毒的危害认识不够深,没有采取及时有效的管控措施,导致该病毒在国内流行[13]。
目前对于IBR的防控主要采用疫苗免疫和扑杀两种措施,欧美一些国家多年坚持对带病牛进行扑杀的策略。而快速有效的诊断IBRV及其评估牛群体内的IBRV抗体对该病的防控显得尤为重要。目前临床上普遍使用ELISA和VNT,在研究牛疱疹病毒4载体疫苗能否引起抗原特异性的保护性免疫反应时,采用ELISA进行BVDV和BoHV-1诊断,利用VNT试验测定中和抗体滴度[14]。ELISA检测灵敏度高易于操作,但ELISA抗体水平高并不能说明一定产生攻毒保护;VNT是评价抗体保护效力的重要方法之一,即VNT抗体水平高意味着能免受病毒攻击,但VNT操作复杂耗时较长,对试验人员及环境要求较高,不适用于临床检测。gB虽然可以作为IBRV诊断和治疗研究的靶点,但目前尚无使用gB ELISA抗体水平评估牛群中IBRV抗体保护效果的报道。因此,本研究试对某牛场采集的50份血清进行gB ELISA抗体检测,利用VNT试验对本次血清样品进行IBRV中和抗体的检测,目的是探索IBRV gB抗体和中和抗体效价的相关性,为使用gB ELISA抗体评估牛群对IBRV抗体抵抗病毒感染能力及简便评估疫苗保护效价提供依据。
1 材料与方法
1.1 材料 血清样本采自某IBRV发病且康复奶牛场。牛肾细胞(madin-darby bovine kidney,MDBK)及IBRV由本实验室提供。CIVTEST BOVIS IBRgB抗体试剂盒购自天科生物科技有限公司;细胞培养用胎牛血清、链霉素,青霉素、0.25%Trypsin及MEM培养基均购自Gibco公司;血细胞计数仪购自SYSMIX公司;BioTek多功能酶标仪购自美国伯腾仪器有限公司。
1.2 阻断ELISA检测方法 包被板上加入100 μL阳性、阴性对照及待检血清样品;在36℃~38℃条件下孵育60 min;弃去板中液体,洗板4次;加入100 μL酶标记物,轻轻混匀后在36℃~38℃条件下孵育60 min;弃液洗4次;加入100 μL底物液,混匀2 s;在室温20℃~25℃条件下避光孵育10 min;加入100 μL终止液。选择酶标仪450 nm波长进行测定,阴性对照阻断率(IN%)大于0.65%,阳性对照(IN%)大于60%时试验成立。血清样品结果判定:IN%<35%,判定为IBRV抗体阴性;IN%>35%,判定为IBRV抗体阳性。
1.3 血清VNT检测方法 血清灭活,取IBRV阳性血清、阴性血清和待检血清各650 μL,置56℃水浴30 min。血清稀释:用维持培养液将待检血清均作1∶2、1∶4、1∶8、1∶16稀释,同时设标准阴阳性血清对照。毒株的稀释:将IBRV用维持培养液稀释至100 TCID50/0.1mL。混合IBRV分别与待检血清和标准阴阳性血清等量混合,置37℃孵育4 h。接种细胞:将100 μL混合液加入单层MDBK细胞的96孔培养板中,做4个重复,同时设阳性和阴性细胞对照,置37℃、5% CO2温箱中培养,逐日观察并记录CPE,共观察7 d。结果判定,在阴阳性对照成立的条件下,待检血清以至少1/2孔均没有出现CPE的血清最大稀释度为中和抗体效价。
1.4 相关性分析 通过统计学的分析判断IBRV gB ELISA抗体IN%值与中和抗体效价值的相关性,相关系数的计算公式[15]如下:
x为血清样本中和抗体效价平均值的倒数;y为血清样本gB ELISA抗体平均S/P值;n为gB ELISA抗体S/P值分段组。如果r>0,表示其为正相关;r<0,表示其为负相关。一般来说,相关系数取绝对值后,0.09为没有相关性,0.1~0.3为弱相关,>0.3~0.5为中等相关,>0.5~1.0为强相关。
2 结果
2.1 ELISA检测gB抗体结果 以50份待检血清,阴性及阳性对照进行阻断IBRV gB-ELISA检测,结果显示,阳性19份,阴性31份(表1)。
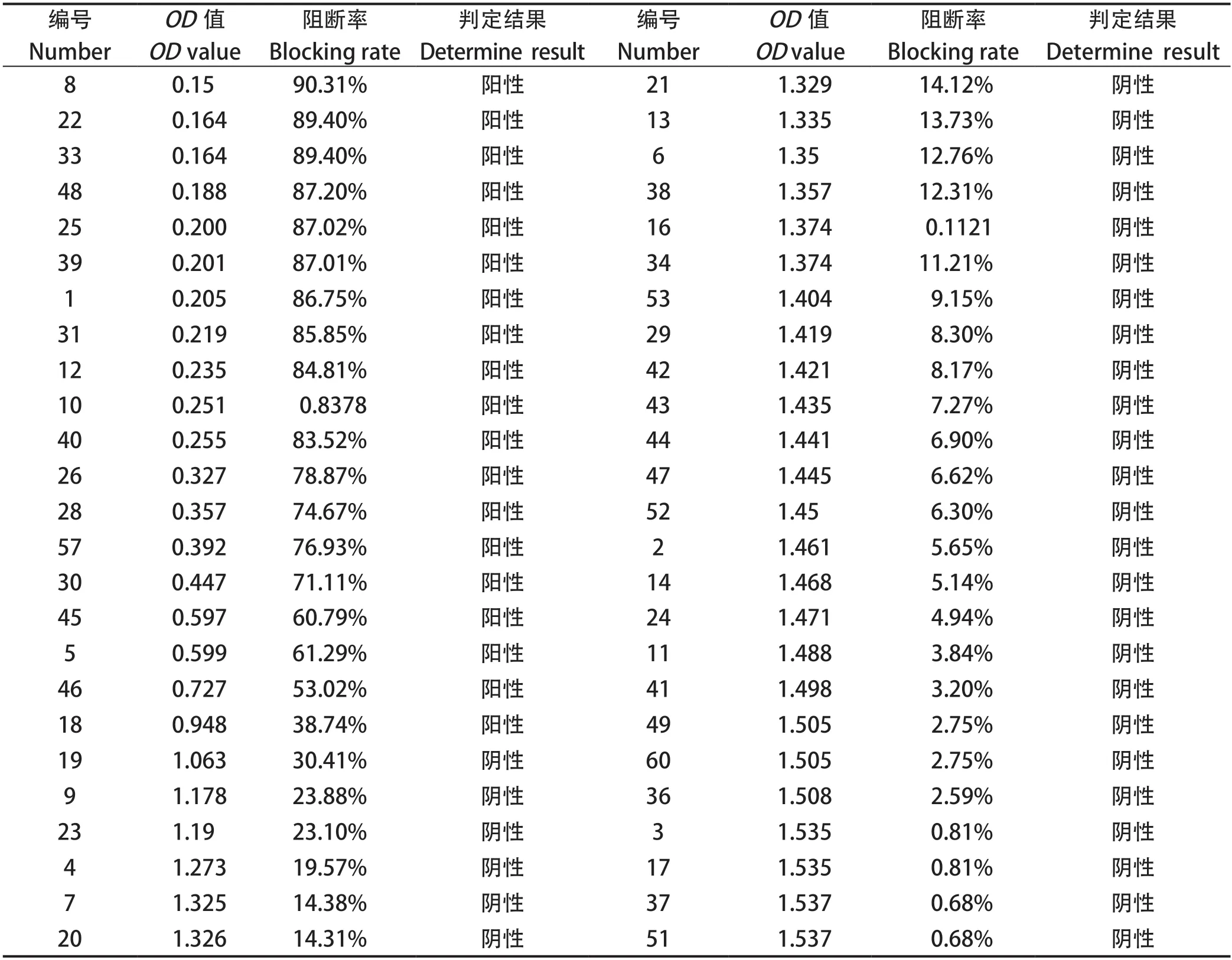
表1 IBRV gB-ELISA检测结果Table 1 IBRV gB-ELISA test results
2.2 VNT检测中和抗体结果 对50份待检血清进行中和抗体检测,结果显示中和抗体>2的有17份,<2的有33份(表2)。

表2 IBRV中和抗体检测结果Table 2 IBRV neutralizing antibody test results
2.3 血清中和抗体效价和gB抗体的相关性 在50份血清中,抗体IN%值大于0.35的有16份血清,平均IN%值为0.7739,相应的血清中和抗体效价倒数平均值为9.17;gB抗体IN%值小于0.35的有34份血清,平均IN%值为0.1371,相应的血清中和抗体效价倒数平均值为2(表3)。通过生物统计学分析发现,gB抗体平均IN%值和中和抗体效价倒数平均值成正相关,相关系数为1.0,具有强相关性。

表3 gB ELISA抗体平均IN%值和中和抗体效价倒数平均值Table 3 The average IN% of gB ELISA antibody and the reciprocal average of neutralizing antibody titer
3 讨论
IBR是一种免疫抑制病,感染牛群出现一系列呼吸道症状,使育肥牛群的生长延缓、奶牛产奶量降低甚至停乳、怀孕母牛流产等,造成严重的经济损失[16-17]。该病被世界动物卫生组织(World Organisation for Animal Health,OIE)列为B类动物传染病,据报道我国牛群IBRV血清阳性率约46%,时有IBRV局部流行,目前对该病的血清学诊断主要依靠实验室的VNT或ELISA检测,尚无自主研发的商品化的IBRV血清抗体检测试剂盒[18]。因此省时省力的IBRV抗体检测方法对该病的防控十分重要。
gB蛋白是IBRV主要的抗原蛋白,且高度保守[19]。gB蛋白主要参与病毒颗粒吸附到细胞表面以及入侵细胞的过程,并且gB 蛋白有2个T细胞识别表位和3个B细胞的识别表位,因此在病毒入侵过程中能够诱发机体产生较强的特异性免疫反应,gB也能产生保护性中和抗体[20]。基于以上特性,gB基因已成为IBRV诊断和治疗研究的热点[21]。本研究对某牛场50份血清进行gB ELISA抗体检测,阳性19份,阴性31份。随后对这50份血清进行中和抗体检测,中和抗体大于2的有17份,中和抗体小于2的有33份。虽然目前IBRV的诊断试剂大多数是针对gB抗原表位,gB也有一定的免疫调节潜力[22],但尚无使用gB ELISA抗体检测IBRV保护效果的研究。ELISA方法由于在实际操作中简便快捷、敏感性高、成本较低等诸多优点,使其得到广泛应用;病毒中和试验耗时较长,工作量较大,敏感性也参差不齐。因此本研究利用gB ELISA抗体评估疫苗的保护效果。
本研究对血清gB ELISA抗体和病毒中和试验两种方法检测结果进行统计学分析,发现血清gB抗体平均阻断率和中和抗体效价平均值具有较强的相关性,相关系数为1.0。本研究发现gB ELISA抗体平均阻断率和中和抗体效价平均值的相关系数为0.5~1.0,具有较强的正相关。IBRV 结构蛋白gB、gC、gD,TK均能刺激机体产生抗体,可以针对IBRV毒力与保护性相关成分,研发更安全和有效的IBRV疫苗[23]。中和抗体效价越高抗体保护的效果越好,使机体免受病毒的感染[24],因此通过检测gB抗体阻断率来衡量牛群对IBRV的抵抗力强弱基本可以评估其保护效价的高低,这为使用gB ELISA抗体水平的方法快速简便评估牛群中IBRV抗体保护效果提供数据支持,更有利于IBR的防控。

