白藜芦醇对ZEN 诱导的猪小肠上皮细胞损伤的作用效果研究
韩婧娥,王欢欢,李鹏程,佘福泽,黎肖昱,秦顺义
(天津农学院 动物科学与动物医学学院 天津市农业动物繁育与健康养殖重点实验室,天津 300392)
玉米赤霉烯酮(Zearalenone,ZEN)是镰刀菌属产生的真菌毒素,广泛存在于各种粮食作物与饲料原料中[1-2]。ZEN 主要表现为生殖毒性,同时也会产生免疫毒性、细胞毒性及氧化损伤等毒性[3-4];ZEN 的细胞毒性可造成细胞的氧化损伤,并抑制细胞增殖[5]。白藜芦醇是从植物中提取的非黄酮类多酚化合物,具有抗菌、抗炎、抗肿瘤、抗氧化、调节能量代谢、调节肠道、调节免疫等作用[6]。文献报道具有抗氧化特性的多种物质均对ZEN 具有拮抗效果[7-9],但未见将白藜芦醇应用于缓解ZEN 对肠道的毒性作用研究。本项目研究白藜芦醇对ZEN 诱导的猪肠上皮细胞损伤的作用效果,旨在为缓解ZEN 危害提供新方法。
1 材料与方法
1.1 材料
1.1.1 细胞
猪小肠上皮细胞(IPEC-J2)细胞系(天津市畜牧兽医研究所馈赠)。
1.1.2 主要试剂与仪器
玉米赤霉烯酮(上海源叶生物科技有限公司),CCK8 检测试剂盒(上海碧云天生物技术有限公司),乳酸脱氢酶(LDH)检测试剂盒(南京凯基生物科技发展有限公司),丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、总抗氧化能力(T-AOC)检测试剂盒(南京建成生物技术研究所),cDNA 试剂盒、SYBR Green qPCR Mix(Genecopoeia 公司)。iMark 酶标仪、CFX96 荧光定量PCR 仪(BIO-RAD 公司)。
1.2 方法
1.2.1 白藜芦醇对ZEN 诱导的IPEC-J2 细胞活力测定
将细胞含量调至105个/mL,以每孔100 µL 接种于96 孔板中,当细胞长至70%时,开始试验。试验分为5 组:C 组(对照组)、Z 组(ZEN 浓度25 µg/mL)、ZR1 组(25 µg/mL ZEN+10 µmol/L 白藜芦醇)、ZR2 组(25 µg/mL ZEN+20 µmol/L 白藜芦醇)、ZR3 组(25 µg/mL ZEN+30 µmol/L 白藜芦醇),每组重复4 次。C 组和Z 组使用普通培养液,ZR1 组、ZR2 组、ZR3 组分别使用含白藜芦醇10µmol/L、20 µmol/L 和30 µmol/L 的培养液,置于细胞培养箱中培养6 h 后,向Z 组、ZR1 组、ZR2组、ZR3 组加入ZEN 使其浓度为25 µg/mL,继续培养24 h 后,各孔均加入CCK8 10 µL,于培养箱中继续孵育1 h 后,用酶标仪在450 nm 处测定各孔吸光度,计算细胞活力:细胞活力(%)=(OD试验-OD空白对照)(/OD阴性对照-OD空白对照)×100%。
1.2.2 白藜芦醇对ZEN 诱导的IPEC-J2 细胞培养液上清中LDH 活性测定
试验分组及处理同1.2.1。细胞培养结束后,收集细胞培养上清液,利用乳酸脱氢酶(LDH)检测试剂盒测定各孔LDH 活性;计算公式为:LDH 活性(U/L)=(OD测定-OD对照)/(OD标准-OD空白)×0.2×1 000。
1.2.3 白藜芦醇对ZEN 诱导的IPEC-J2 细胞抗氧化酶水平测定
将细胞含量调至106个/mL,以每孔2 000 µL接种于6 孔板中,当细胞长至70%时,开始试验。试验分组及处理同1.2.1。细胞培养结束后,转移细胞至EP 管中,加入预先冷却的细胞裂解液,低温超声波破碎细胞后,离心、取上清测定细胞SOD、T-AOC 和MDA 的水平。
1.2.4 白藜芦醇对ZEN 诱导的IPEC-J2 细胞凋亡相关基因mRNA 表达水平测定
依据 GenBank 中猪肠上皮细胞β-actin、Caspase-3、Caspase-9、Bcl-2 和bax 基因的参考序列,采用Primer 3 进行引物设计,引物由上海生工生物工程股份有限公司合成,引物信息见表1。细胞分组及处理同1.2.3,细胞培养结束后,常规提取总RNA,利用First-Strand cDNA Synthesis Kit 试剂盒反转录合成cDNA;然后用荧光定量PCR 仪检测白藜芦醇对ZEN 诱导的IPEC-J2 细胞β-actin、caspase 3、caspase 9、Bcl-2 和bax 基因mRNA 表达水平,通过2-ΔΔCt法计算各基因的相对表达量。反应体系组成如下:cDNA 3.0 μL、S Primer(10 pmol)2.0 μL、A Primer(10 pmol)2.0 μL、qPCR Mix 9.0 μL 补加ddH2O 至20 μL。反应程序如下:95 ℃预变性5 min;95 ℃变性20 s,56 ℃退火25 s,72 ℃延伸15 s,共40个循环。熔解程序:65 ℃,0.05s;95 ℃,0.5 s。

表1 β-actin、caspase 3、caspase 9、Bcl-2 和bax引物序列
1.2.5 数据处理
测定值以平均数±标准差表示,采用SPSS 22.0 统计分析软件对试验数据进行单因素方差分析(one way-ANOVA),若存在差异显著性,再进行多重比较(SNK 法)。P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果
2.1 白藜芦醇对ZEN 诱导的IPEC-J2 细胞活力的影响
由图1 可知,Z 组IPEC-J2 细胞细胞活力极显著低于C组(P<0.01),ZR2 组和ZR3 组IPEC-J2细胞细胞活力极显著高于Z 组(P<0.01);ZR2组和ZR3 组IPEC-J2 细胞细胞活力极显著或显著高于ZR1 组(P<0.01 或P<0.05);ZR1 组IPEC-J2细胞细胞活力与Z 组相比无显著差异(P>0.05)。

图1 白藜芦醇对ZEN 诱导的IPEC-J2 细胞活力(%)的影响
2.2 白藜芦醇对ZEN 诱导的IPEC-J2 细胞LDH活性的影响
由图2 可知,Z 组IPEC-J2 细胞LDH 活性极显著高于C组(P<0.01),ZR2 组和ZR3 组IPEC-J2细胞LDH 活性极显著低于Z 组(P<0.01),ZR1组IPEC-J2细胞LDH活性显著低于Z 组(P<0.05);ZR2 组和ZR3 组IPEC-J2 细胞LDH 活性显著低于ZR1 组(P<0.05);ZR2 组和ZR3 组IPEC-J2 细胞LDH 活性与C 组相比无显著差异(P>0.05)。

图2 白藜芦醇对ZEN诱导的IPEC-J2细胞LDH活性(U/L)的影响
2.3 白藜芦醇对ZEN 诱导的IPEC-J2 细胞抗氧化酶水平的影响
由表2 可知,Z 组IPEC-J2 细胞SOD 活性和T-AOC 水平极显著低于C 组(P<0.01),ZR2 组和ZR3 组IPEC-J2 细胞SOD 活性和T-AOC 水平极显著高于Z 组(P<0.01),ZR2 组和ZR3 组IPEC-J2 细胞SOD 活性和T-AOC 水平极显著或显著高于ZR1 组(P<0.01 或P<0.05),ZR3 组IPEC-J2 细胞SOD活性显著高于ZR2 组(P<0.05),ZR1 组IPEC-J2 细胞SOD 活性和T-AOC 水平与Z组相比无显著差异(P>0.05);Z 组IPEC-J2 细胞MDA 水平极显著高于C 组(P<0.01),ZR2 组和ZR3 组IPEC-J2 细胞MDA 水平极显著低于Z 组(P<0.01),ZR2 组和ZR3 组IPEC-J2 细胞MDA水平极显著低于ZR1组(P<0.01),ZR3组IPEC-J2细胞MDA 极显著低于ZR2 组(P<0.01),ZR1 组IPEC-J2 细胞MDA 水平与Z 组相比无显著差异(P>0.05)。

表2 白藜芦醇对ZEN诱导的IPEC-J2 细胞抗氧化酶水平的影响
2.4 白藜芦醇对ZEN 诱导的IPEC-J2 细胞凋亡相关基因mRNA 表达水平的影响
由图3 可知,Z 组IPEC-J2 细胞Capase-3和Capase-9基因mRNA 表达水平极显著高于C 组(P<0.01),ZR2 组和ZR3 组IPEC-J2 细胞Capase-3和Capase-9基因mRNA 表达水平极显著低于Z 组(P<0.01),ZR2 组和ZR3 组IPEC-J2细胞Capase-3和Capase-9基因mRNA 表达水平极显著低于ZR1 组(P<0.01),ZR3 组IPEC-J2细胞Capase-3和Capase-9基因mRNA 表达水平极显著低于ZR2 组(P<0.01),ZR1 组IPEC-J2细胞Capase-3和Capase-9基因mRNA 表达水平与Z 组相比无显著差异(P>0.05)。

图3 白藜芦醇对ZEN 诱导的IPEC-J2 细胞Capase-3 和Capase-9 基因mRNA 表达水平的影响
由图4 可知,Z组IPEC-J2 细胞Bax基因mRNA表达水平极显著高于C 组(P<0.01),ZR1 组、ZR2 组和ZR3 组IPEC-J2 细胞Bax基因mRNA 表达水平极显著低于Z 组(P<0.01),ZR2 组和ZR3组IPEC-J2 细胞Bax基因mRNA 表达水平极显著低于ZR1 组(P<0.01),ZR3 组IPEC-J2 细胞Bax基因mRNA 表达水平极显著低于ZR2 组(P<0.01);Z 组IPEC-J2 细胞Bcl-2基因mRNA 表达水平极显著低于C组(P<0.01),ZR2 组和ZR3 组IPEC-J2细胞Bcl-2基因mRNA 表达水平极显著高于Z 组(P<0.01),ZR2 组和ZR3 组IPEC-J2 细胞Bcl-2基因mRNA 表达水平极显著或显著高于ZR1 组(P<0.01 或P<0.05),ZR3 组IPEC-J2 细胞Bcl-2基因mRNA 表达水平与ZR2 组无显著差异(P>0.05),ZR1 组IPEC-J2 细胞Bcl-2基因mRNA 表达水平与Z 组相比也无显著差异(P>0.05)。
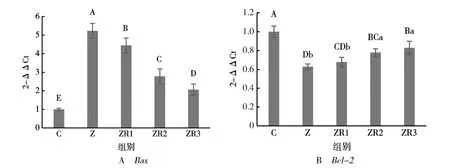
图4 白藜芦醇对ZEN 诱导的IPEC-J2 细胞Bax 和Bcl-2 基因mRNA 表达水平的影响
3 讨论
3.1 白藜芦醇对ZEN 诱导的IPEC-J2 细胞活力和LDH 活性的影响
ZEN 具有细胞毒性能够抑制细胞增殖、降低细胞活性[5,10]。本研究结果表明ZEN 能显著降低IPEC-J2 细胞的细胞活力,说明ZEN 同样能够抑制猪小肠上皮细胞增殖、降低猪小肠上皮细胞的存活率;类似的,许晴雨等研究表明,玉米赤霉烯酮能够显著降低小鼠细胞睾丸间质细胞的细胞活性,且玉米赤霉烯酮会使该细胞的细胞活性呈剂量依赖性降低[11]。现有的研究已证明ZEN 抑制细胞增殖、降低细胞活性与氧化损伤有关,因而从理论上讲,抗氧化物质能够缓解ZEN 对细胞增殖的抑制作用和对细胞活性的降低作用;本研究结果也证实了具有抗氧化作用的白藜芦醇能够缓解ZEN 所致的IPEC-J2 细胞细胞活力降低。
乳酸脱氢酶作为一种存在于细胞质中的酶,常被用作监测细胞损伤的指标,当细胞损伤或凋亡时,乳酸脱氢酶就会被释放到细胞外,监测血液或细胞培养液中乳酸脱氢酶的水平,就能反映细胞的损伤程度。研究表明,玉米赤霉烯酮作用于睾丸支持细胞,乳酸脱氢酶的释放量会随着玉米赤霉烯酮浓度增加而增加,并且加重细胞损伤和细胞凋亡[12];本研究结果也表明,ZEN 能显著增加IPEC-J2 细胞培养液上清中LDH 活性。同时本研究还发现10 µmol/L、20 µmol/L 和30 µmol/L白藜芦醇均能够显著缓解ZEN 所致的IPEC-J2 细胞培养液上清中LDH 水平升高,进一步说明了具有抗氧化作用的白藜芦醇在一定程度上能够缓解ZEN 对IPEC-J2 细胞的毒性作用。类似的,具有抗氧化作用的原青花素也能有效缓解玉米赤霉烯酮所致的体外培养的小鼠肠上皮细胞外乳酸脱氢酶含量升高[13]。
3.2 白藜芦醇对ZEN 诱导的IPEC-J2 细胞抗氧化酶水平的影响
氧化损伤是ZEN 发挥毒性作用的主要途径之一[14-15],ZEN 会引发生物膜中多不饱和脂肪酸的脂质过氧化作用,并形成脂质过氧化物,而脂质过氧化作用最终能导致很多脂类分解产物形成,其中部分引起细胞代谢及功能障碍、甚至死亡;同时,氧自由基也能通过脂氢过氧化物的分解产物引起细胞损伤[14-16]。ZEN 能降低抗氧化酶的活性并促进活性氧产生,导致猪肠上皮细胞氧化应激,进而诱发炎症反应[17]。大量研究表明,抗氧化物能够有效缓解ZEN 对机体和细胞的氧化损伤作用,进而缓解其毒性作用。例如原花青素可减轻ZEN诱导的TM4 和MODEK 细胞的氧化损伤与细胞凋亡[8,13];槲皮素或番红花也可通过降低活性氧水平,抑制内质网应激通路,减轻ZEN 诱导的细胞损伤[9,18]。本研究结果表明,20 µmol/L 和30 µmol/L 的白藜芦醇能够缓解ZEN 诱导的IPEC-J2 细胞的SOD 活性和T-AOC 水平降低,能够缓解ZEN 诱导的IPEC-J2 细胞的MDA 水平升高。说明一定浓度的白藜芦醇能够缓解ZEN 诱导的IPEC-J2 细胞抗氧化功能降低。
3.3 白藜芦醇对ZEN 诱导的IPEC-J2 细胞凋亡相关基因mRNA 表达水平的影响
Caspase 蛋白家族与细胞凋亡密切相关,Caspase-9 是凋亡的诱发剂,它接受信号后激活效应Caspase 蛋白(例如caspase-3),Caspase-3 是凋亡的关键执行者,是凋亡标志蛋白。Bax和Blc-2同样也是凋亡的重要指标,Bcl-2抑制细胞凋亡,而Bax拮抗Bcl-2,促进细胞凋亡[19]。研究表明,给予玉米赤霉烯酮后,猪小肠上皮细胞SIEC02 的Bcl-2表达下降,促凋亡因子Bax表达升高,并且Caspase-3和Caspase-9的mRNA 含量均升高[20]。研究表明,有机硒、原花青素、槲皮素抗氧化物质能够有效缓解ZEN 诱导细胞的凋亡作用,改变Caspase-3、Caspase-9、Bax和Blc-2等凋亡相关基因的表达水平[7-9]。本研究结果表明,20 µmol/L和30 µmol/L 的白藜芦醇能够缓解ZEN 诱导的IPEC-J2 细胞的Capase-3、Capase-9和Bax基因mRNA 表达水平升高,能够缓解ZEN 诱导的IPEC-J2 细胞Bcl-2基因mRNA 表达水平降低。说明一定浓度的白藜芦醇能够缓解ZEN 诱导的IPEC-J2 细胞细胞凋亡发生。
4 结论
白藜芦醇能够缓解ZEN 诱导的IPEC-J2 细胞的细胞活力、LDH 活性、抗氧化功能和凋亡相关基因mRNA 表达水平的改变。

