长链非编码RNA CCAT1靶向调控miR-377对前列腺癌PC3细胞生物学行为的影响
王洪福 贾媛 刘楠 尹凯 齐文千 孙福祥
前列腺癌是全世界男性中最常见的恶性肿瘤之一,据估计2020年全球报告的新病例为64万例,死亡人数为8万多[1]。前列腺癌患者大多接受雄激素剥夺治疗,尽管初始反应率很高,但10%~20%的患者出现去势抵抗性前列腺癌,导致治疗失败[2,3]。因此,探索新的治疗靶点对前列腺癌的治疗意义重大。两种类型的非编码RNA(ncRNA)对表观遗传和翻译后调控都很重要。研究表明,长非编码RNA(IncRNA)在表观遗传调控中发挥作用[4]。长度>200个核苷酸的IncRNA定义为IncRNA,它保持RNA分子常见的经典poly-A尾和5’-帽。IncRNA已在许多组织类型中发现,并在发育过程中的特定时间表达。出于这个原因,IncRNA在人类癌症的发病机制和其他生理过程中可能是必不可少的[5]。与IncRNA类似,microRNA(miRNA)在癌症中得到了很好的表征。与IncRNA相比,miRNA相对较短(定义为长度为19~25个核苷酸)。除了蛋白质编码调控外,这两种类型的ncRNA也与转录后调控有关。LncRNAs和miRNAs被认为是相互影响的,从而产生了一层额外的调控复杂性[6]。例如,GAS5通过与miR-145结合再前列腺癌的进展中发挥重要调控作用[7]。本研究拟探讨长链非编码RNACCAT1靶向调控miR-377对前列腺癌PC3细胞生物学行为的影响,为前列腺癌的治疗提供依据。
1 资料与方法
1.1 一般资料 选取2020年1月至2021年12月本院行手术治疗的前列腺癌78例为病理组,同时获取78例相邻的非恶性组织标本为癌旁组(≥3 cm)。患者年龄53~80岁,平均年龄(77.2±5.3)岁。所有组织标本经病理检查确认。获取样本后冷冻于液氮。该研究经本院医学伦理委员会批准,并获得患者书面知情同意书。
1.2 纳入与排除标准 (1)纳入标准:①病理检查确诊的前列腺癌患者;②病历完整患者。(2)排除标准:①被诊断患有其他疾病的患者;②治疗期间转入其他医院的患者;③随访期间因其他原因死亡的患者。
1.3 主要试剂与仪器 miRNeasy Mini 试剂盒(Qiagen,Inc,USA,批号;65489),TaqMan MicroRNA Reverse Transcription试剂盒(Thermo Fisher Scientific Inc,USA,批号;302158),TRIzol试剂(Invitrogen,批号:MN-20148),MMLV Reverse Transcriptase(中国碧云天生物科技,批号:20158),1st-链 cDNA 合成试剂盒(Lucigen Corporation,USA,批号:520158),SYBR®Green Real-Time PCR Master Mix(Thermo Fisher Scientific,批号:521489),Dulbecco改良Eagle培养基(中国碧云天生物,批号:526985),10%胎牛血清,青霉素、链霉素(美国默克生物科技,批号:51489、41555、96581),CCK-8 试剂盒(Dojindo Molecular Technologies,Japan,批号:521458),Annexin V-FITC、碘化丙啶(PI)(Dojindo,Kumamoto,Japan,批号:201596、30254),BD Biosciences 2 Laser 4 Color FacsCalibur 流式细胞仪(BD Biosciences,Franklin Lakes,NJ,USA),BD Paint-A-GateTMPro软件(BD Biosciences),trawnswell小室、Matrigel凝胶(美国BD Biosciences,批号254896、203658),UI-3265倒置显微镜(日本奥林巴斯),蛋白质提取试剂盒(中国Solarbio,批号:FG-4586.36),二辛可宁酸蛋白质测定试剂盒(中国Beyotime,批号:NM-32589),12%十二烷基硫酸钠-聚丙烯酰胺凝胶(美国sigma,批号:SX-201558),聚偏二氟乙烯膜(美国Pall Corporation,批号:VB-89655),抗RUNX1、GAPDH抗体的特异性一抗(ab96587、20158、3258;英国Abcam,均为1∶1 000稀释),辣根过氧化物酶偶联二抗(ab215;英国Abcam,1∶5 000稀释),化学发光试剂(ECL)试剂盒(中国Beyotime,批号:BO-32569)。
1.4 方法
1.4.1 2组miR-377、InRNA CCAT1水平的测定:为检测miR-377表达水平,使用miRNeasy Mini 试剂盒从每0.1克组织标本和1×105个细胞中提取miRNA,以TaqMan MicroRNA Reverse Transcription 试剂盒制备PCR反应系统。为了检测InRNA CCAT1的表达水平,使用TRIzol试剂从每个样品的0.1 g组织标本和1×105个细胞中提取总RNA,使用MMLV Reverse Transcriptase、1st-链 cDNA合成试剂盒和 SYBR®Green Real-Time PCR Master Mix制备 qPCR反应系统。热循环条件为95℃ 55 s,然后是95℃ 25 s和55.5℃ 30 s的40个循环。miR-377、InRNA CCAT1和内源性对照为U6和β-actin的引物由Sangon Biotech Co(中国上海)设计和合成。引物序列:miR-377正向,5’-TCGGCGCGCTAGTCGATCGATCGTAGCTAGCT-3’和反向,5’-TGGGCTGATCGATCGATCGTAGCTAGC-3’;U6正向,5’-TGGGGCTAGTCGATCGATGCTAGCTAGCA-3’ 和反向,5’-TGGGCGATGCTAGGAGTCGATCGATCAC-3’;InRNA CCAT1正向,5’-TCGGCGGCTAGGAGGATCGTAGCTAGCTAGCCC-3’ 和反向,5’-TGGGCTGACTGATCGATCGTAGCTAGCTACC-3’;β-肌动蛋白正向,5'-TGGGGCTAGTCGATCGATCGATCGACC-3’和反向,5’-TGGGGATCGATCGATGCTAGCTACAC-3’。使用2-ΔΔCt方法将miR-377的表达标准化为U6,并将 IncRNA CCAT1的表达标准化为β-肌动蛋白。
1.4.2 细胞培养及分组设计:本PC3人前列腺癌细胞系,细胞获自美国典型培养物保藏中心 (ATCC; Manassas,USA),并在Dulbecco改良的Eagle培养基中培养(含有10%的胎牛血清,100 U/ml的青霉素和100 mg/ml的链霉素),并在在37℃、5%CO2的湿润气氛中生长。InRNA CCAT1 pcDNA3.1过表达载体(5’-TCGGGCGCTAGTCAGTCGATCGACC-3’),(InRNA CCAT1 mimics)、InRNA CCAT1 pcDNA3.1低表达载体(5’-TGGGGCTGGCGTGCTGCTAGCAC-3’),(InRNA CCAT1 inhibitor)、空载体(InRNA-NC)获自Sigma-Aldrich (Merck KGaA,Darmstadt,Germany)。细胞转染使用Lipofectamine®2000试剂 (Thermo Fisher Scientific,Inc)在37℃下进行,InRNA-NC、InRNA CCAT1 mimics、InRNA CCAT1 inhibitor的剂量分别为40、40和40 nmol/L。将细胞与转染混合物一起孵育6 h。用Lipofectamine®2000 试剂处理InRNA CCAT1 mimics、过表达的成功转染阈值为200%,InRNA CCAT1 inhibitor敲低的阈值为50%。在转染后72 h进行进一步的实验。
1.4.3 PC3细胞活力的检测:使用CCK-8测定法检测细胞增殖。在正常条件(37℃;5% CO2)和15 μl CCK-8 溶液在72 h添加到每个孔中,将细胞与CCK-8溶液一起孵育4 h,使用读板器测量450 nm处的光密度值以确定细胞增殖率。
1.4.4 PC3细胞凋亡水平测定:流式细胞仪测定细胞凋亡。无血清 DMEM 制备细胞悬液(5×104个/ml)。将细胞转移至6孔板(10 ml/孔)培养60 h,用0.25%胰蛋白酶消化细胞。Annexin V-FITC和碘化丙啶(PI)染色在室温下在黑暗中进行30 min,然后使用BD Biosciences 2 Laser 4 Color Facs Calibur流式细胞仪检测凋亡细胞。BD Paint-A-GateTMPro软件分析数据。
1.4.5 PC3细胞侵袭水平测定:通过transwell测定法进行评估侵袭能力,将无血清培养基中的1×105个细胞接种到涂有 Matrigel 的插入物的上室中。将含有10%FBS的培养基添加到下室中。孵育24 h后,用脱脂棉去除上膜上残留的细胞。已侵袭入膜的细胞用甲醇和0.1%结晶紫染色,成像,并使用倒置显微镜计数。实验独立重复3次。
1.4.6 PC3细胞miR-377、InRNA CCAT1 mRNA表达水平测定:首先,将细胞系制备成细胞悬液。然后,添加TRIzol试剂提取细胞总RNA,后续操作同1.4.1。
1.4.7 PC3细胞RUNX1表达水平测定:使用蛋白质提取试剂盒(中国Solarbio,批号:FG-4586.36)对培养结束的细胞进行蛋白质分离,然后用二辛可宁酸蛋白质测定试剂盒(中国Beyotime,批号:NM-36523.63)定量30 μg将蛋白质样品上样到12%十二烷基硫酸钠-聚丙烯酰胺凝胶(美国sigma,批号:SX-41526.36)上,后转至聚偏二氟乙烯膜上(美国Pall Corporation,批号:VB-45213.32)。将膜在脱脂奶中封闭,然后与抗RUNX1、GAPDH抗体的特异性一抗(ab184787、36549、524596; 英国Abcam,均为1∶1 000稀释)在4℃孵育过夜。与辣根过氧化物酶偶联的二抗(ab205718;英国Abcam,1∶5 000稀释)在室温下孵育2 h。使用化学发光试剂(ECL)试剂盒(中国Beyotime,批号:BO-4585.36)对蛋白条带进行可视化和分析。
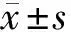
2 结果
2.1 癌旁组、病理组miR-377、InRNA CCAT1水平的比较 病理组miR-377水平低于癌旁组,InRNA CCAT1水平高于癌旁组(P<0.05)。见表1。

表1 癌旁组、病理组miR-377、InRNA CCAT1水平比较 n=78,
2.2 miR-377、InRNA CCAT1与前列腺癌临床病理特征的关系 不同年龄特征组前列腺癌患者miR-377、InRNA CCAT1水平差异无统计学意义(P>0.05);而病理学分级越高、TNM分期越高、有淋巴血管间隙浸润、有淋巴结转移、有复发,miR-377表达水平越低,InRNA CCAT1表达水平越高(P<0.05)。见表2。

表2 miR-377、InRNA CCAT1与前列腺癌临床病理特征的关系
2.3 4组PC3前列腺癌细胞OD值、存活率比较 与PC3前列腺癌细胞组、InRNA-NC组比较,InRNA CCAT1 mimics组OD值、存活率升高(P<0.05),InRNA CCAT1 inhibitor组OD值、存活率降低(P<0.05);与InRNA CCAT1 mimics组比较,InRNA CCAT1 inhibitor组降低(P<0.05)。见表3。

表3 4组PC3前列腺癌细胞OD值、存活率比较
2.4 4组PC3前列腺癌细胞凋亡率比较 与PC3前列腺癌细胞组、InRNA-NC组比较,InRNA CCAT1 mimics组细胞凋亡率降低(P<0.05),InRNA CCAT1 inhibitor组细胞凋亡率升高(P<0.05);与InRNA CCAT1 mimics组比较,InRNA CCAT1 inhibitor组细胞凋亡率升高(P<0.05)。见表4,图1。

图1 4组PC3前列腺癌细胞凋亡率比较;A PC3前列腺癌细胞组;B InRNA-NC组;C InRNA CCAT1 mimics组;D InRNA CCAT1 inhibitor组

表4 4组PC3前列腺癌细胞凋亡率比较
2.5 4组PC3前列腺癌细胞迁移能力比较 与PC3前列腺癌细胞组、InRNA-NC组比较,InRNA CCAT1 mimics组穿膜数升高(P<0.05),InRNA CCAT1 inhibitor组穿膜数降低(P<0.05);与InRNA CCAT1 mimics组比较,InRNA CCAT1 inhibitor组穿膜数降低(P<0.05)。见表5,图2。
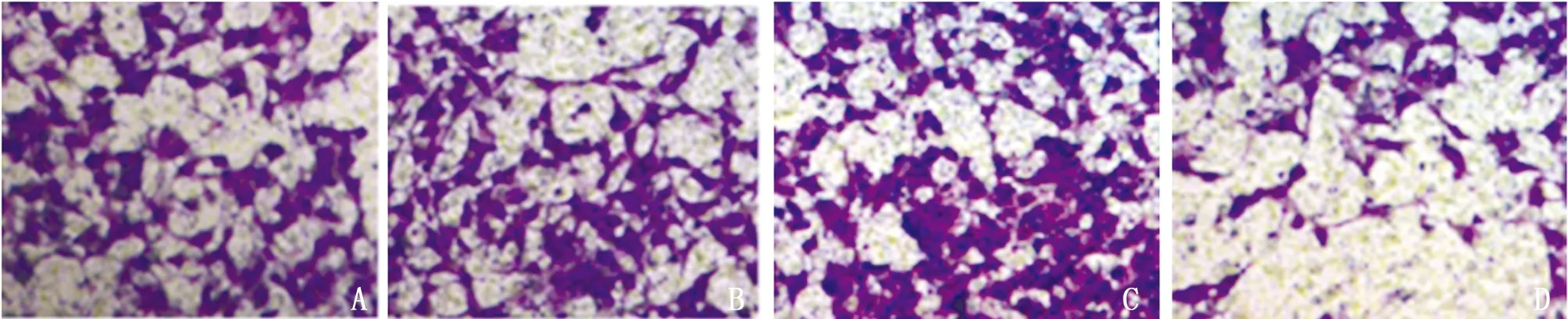
图2 穿膜数目比较(结晶紫染色×200);A PC3前列腺癌细胞组;B InRNA-NC组;C InRNA CCAT1 mimics组;D InRNA CCAT1 inhibitor组

表5 4组PC3前列腺癌细胞穿膜数比较
2.6 InRNA CCAT1对miR-377的靶向调节 生物信息学网站(www.Targetscan.org)检索发现,InRNA CCAT1与miR-377有潜在的结合位点;萤光素酶结果显示,InRNA CCAT1过表达可明显降低miR-377-wt的荧光素酶活性,InRNA CCAT1低表达可明显提升miR-377-wt的荧光素酶活性;表明InRNA CCAT1与miR-377存在靶向调节作用。见表6,图3。

图3 Targetscan预测InRNA CCAT1与miR-377 mRNA的互补配对系列

表6 萤光素酶报告基因实验结果
2.7 4组PC3前列腺癌细胞InRNA CCAT1、miR-377表达水平比较 与PC3前列腺癌细胞组、InRNA-NC组比较,InRNA CCAT1 mimics组细胞InRNA CCAT1升高,miR-377降低(P<0.05),InRNA CCAT1 inhibitor组细胞InRNA CCAT1降低,miR-3771升高(P<0.05);与InRNA CCAT1 mimics组比较,InRNA CCAT1 inhibitor组细胞InRNA CCAT1降低,miR-377升高(P<0.05)。见表7。

表7 4组PC3前列腺癌细胞InRNA CCAT1、miR-377 mRNA表达水平比较
2.8 4组PC3前列腺癌细胞RUNX1蛋白表达水平比较 与PC3前列腺癌细胞组、InRNA-NC组比较,InRNA CCAT1 mimics组细胞RUNX1蛋白降低(P<0.05),InRNA CCAT1 inhibitor组升高(P<0.05);与InRNA CCAT1 mimics组比较,InRNA CCAT1 inhibitor组细胞RUNX1蛋白升高(P<0.05)。见表8,图4。

图4 4组SW1620前列腺癌细胞RUNX1蛋白比较;A PC3前列腺癌细胞组;B InRNA-NC组;C InRNA CCAT1 mimics组;D InRNA CCAT1 inhibitor组

表8 4组PC3前列腺癌细胞RUNX1蛋白表达水平比较
3 讨论
IncRNA在癌症发病机制中具有重要作用,可以为癌症生物学提供新的见解。了解IncRNA功能的精确分子机制可能有助于开发IncRNA指导的癌症诊断和治疗方法。本研究发现,InRNA CCAT1是一种促癌CCAT1,可以下调miR-377的表达,miR-377通过下调RUNX1表现出致癌活性。
CCAT1是一种lncRNA,CCAT1基因也可以称为DD3基因,仅在前列腺上皮细胞中表达,具有很高的肿瘤特异性[8]。因此,CCAT1在前列腺癌的早期诊断和治疗中具有良好的临床应用价值。如前列腺上皮细胞的分泌物和脱落细胞通过导管排入尿道,前列腺按摩后,尿液样本中即可检测到CCAT1的高表达[9,10]。相反,由于尿沉渣包含所有的细胞和细胞碎片,因此,尿沉渣可用于更准确地检测CCAT1的表达。此外,有数据提示在肝癌患者中,与正常对照组相比,外周血中CCAT1基因表达水平增加了约34倍,表明CCAT1在肝癌中具有致癌基因作用[11]。本研究结果发现,病理组InRNA CCAT1水平高于癌旁组;且前列腺癌病理学分级越高、TNM分期越高、有淋巴血管间隙浸润、有淋巴结转移、有复发,InRNA CCAT1表达水平越高。这说明,CCAT1能促进前列腺癌病理进展。
本研究结果显示:与PC3前列腺癌细胞组、InRNA-NC组比较,InRNA CCAT1 mimics组OD值、存活率、穿膜数升高,凋亡率降低,InRNA CCAT1 inhibitor组OD值、存活率、穿膜数降低,凋亡率升高;与InRNA CCAT1 mimics组比较,InRNA CCAT1 inhibitor组OD值、存活率、穿膜数降低,凋亡率升高。这表明CCAT1有效促进前列腺癌细胞增殖、侵袭和迁移,并抑制其凋亡。近期研究发现,将LV3-shRNACCAT1皮下注射到肿瘤异种移植物中,LV3-shRNACCAT1有效促进异种移植物的生长[12]。此外,lncRNACCAT1表达的敲低导致肺癌细胞生长缺陷以及细胞凋亡率增加;CCAT1对MALAT-1的下调促进了胃癌细胞的生长、侵袭和迁移,并在细胞中诱导细胞周期停滞在G0/G1期[13]。
在肝细胞癌的发展过程中,miR-29a通过启动子高甲基化抑制母体表达的lncRNA3表达;miRNA-218-5p受lncRNA结肠癌相关转录物1的负调控以促进胆囊癌发展[14]。本研究结果表明,病理组miR-377水平低于癌旁组;且前列腺癌病理学分级越高、TNM分期越高、有淋巴血管间隙浸润、有淋巴结转移、有复发,miR-377表达水平越低。这说明,miR-377能抑制前列腺癌病理进展。近期研究发现,CCAT1可能间接下调胰腺癌细胞中的miR-377[15]。一项研究中,lncRNA CCAT1通过AKT丝氨酸/苏氨酸激酶/哺乳动物雷帕霉素靶点通路靶向miR-377,从而促肺癌的进展[16]。因此,miR-377也可能在lncRNA CCAT1的下游参与前列腺癌的发生发展。本研究萤光素酶报告基因实验结果表明InRNA CCAT1与miR-377存在靶向调节作用。而RT-PCR结果更加直观表明,InRNA CCAT1能靶向抑制miR-377表达。
Runt相关转录因子1(RUNX1)蛋白与细胞周期相关蛋白(如CyclinD1和p21)的转录调控有关,并且RUNX表达水平在细胞周期中有所不同。RUNX1可以通过调控p21和信号转导和转录激活因子3(STAT3)等癌症相关基因在不同细胞和组织中充当肿瘤抑制基因或癌基因RUNX1抑制p21并促进STAT3的激活,STAT3是一种具有致癌特性的转录因子,通过Jak/Stat通路促进其磷酸化[17]。在角质形成细胞和皮肤癌细胞中,RUNX1通过抑制细胞因子信号抑制因子(SOCS)来维持STAT3处于活跃状态。RUNX1显示在PCa组织中下调,并与PCa细胞增殖、迁移和侵袭有关[18]。本研究结果显示:与PC3前列腺癌细胞组、InRNA-NC组比较,InRNA CCAT1 mimics组细胞RUNX1蛋白降低(P<0.05),InRNA CCAT1 inhibitor组细胞RUNX1蛋白升高(P<0.05);与InRNA CCAT1 mimics组比较,InRNA CCAT1 inhibitor组细胞RUNX1蛋白升高(P<0.05)。结合前述讨论,这说明,InRNA CCAT1能靶向抑制miR-377进而抑制RUNX1的表达,这可能在前列腺癌的进展中发挥重要作用。
综上所述,InRNA CCAT1在前列腺癌组织中高表达,miR-377在前列腺癌组织中低表达,InRNA CCAT1、miR-377与前列腺癌临床病理特征具有一定相关性;InRNA CCAT1靶向抑制miR-377、RUNX1表达进而促进前列腺癌PC3细胞恶性生物学行为。

