FOXD1、FOXD3蛋白在食管鳞状细胞癌中的表达及与临床特征和预后的相关性
吴峥 郭盛虎 李文 张跃华 潘腾 汪治宇
食管癌(ESCA)是对我国居民生命健康存在危害性的一大恶性肿瘤。基于世界卫生组织(WHO)数据可知,我国2020年的ESCA新发患者是32.4万人,死亡患者是30.1万人,近1/2的ESCA发病与死亡病例出现于我国,新发率与病死率相较美国不止10倍,我省更是ESCA高发区域之一[1]。在我国,以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)病理分型最为常见,病理组织活检为其主要诊断标准。ESCC患者早期通常无明显表现,主要采取手术切除疗法,并将放疗、化疗与多学科联合疗法等作为辅助,但晚期ESCC患者进展极为迅速,5年生存率只有20%~30%[2]。所以,深入了解本病的发病机制,挖掘具有高度特异性与敏感性的肿瘤标志物(TM)显得非常关键,对临床领域早期诊断有利,同时可指导治疗以及作为治疗靶点改善预后。叉头框转录因子(FOX)家族的首次发现是在果蝇内,现今已划分出19个亚家族,由FOXA至FOXS,这些亚家族在结构方面的最大表现为存在由100多个保守氨基酸(AA)序列构成的DNA结合域。诸多报道显示,FOX家族对多种生物学功能具介导作用,包括细胞周期、胚胎发育、DNA损伤修复,还和肿瘤形成进行等若干复杂进程相关[3]。FOXD1、FOXD3均属于FOXD亚族蛋白,FOXD1在早期胚胎发育和器官发生中具有公认的作用,并且其表达紊乱,与不同类型癌症的生物学行为相关。类似地,FOXD3最早在胚胎干细胞中发现,维持胚胎干细胞的多能性,调节神经嵴的形成、分化和迁移。研究表明,FOXD3在细胞癌变过程中也发挥着重要作用,其异常表达可调控肿瘤的增殖、侵袭、转移和血管生成等生物学功能[4]。本研究拟分析FOXD1、FOXD3在食管鳞癌患者中的表达情况,并探究两者与患者预后的相关性。
1 资料与方法
1.1 一般资料 选取2011年1月至2013年12月河北医科大学第四医院收治的符合纳入及排除标准接受手术治疗的食管鳞癌患者105例作为研究对象。
1.2 纳入与排除标准
1.2.1 纳入标准:①初次就诊,无外院诊治史;②入组前未行放化疗及免疫治疗者;③经病理检查明确诊断为食管鳞癌;④无食管狭窄和反流性食管炎等食管良性疾病;⑤患者和(或)其家属对本研究知情同意并签署相关知情同意书。
1.2.2 排除标准:①合并胃肠炎和肠结核等急性感染性疾病患者;②伴心肺功能衰竭患者;③伴免疫缺陷性疾病和精神障碍等患者。组织标本的切取和使用经过本院伦理委员会批准,患者已签署知情同意书。
1.3 总RNA提取以及qRT-PCR检测组织中FOXD1和FOXD3 mRNA表达 将食管鳞癌组织和癌旁组织(距离癌组织边缘>2 cm)研碎后加入Trizol试剂(美国Invitrogen公司),应用Trizol法提取组织中RNA。应用逆转录试剂盒(日本TaKaRa公司)将RNA逆转录为cDNA,并采用荧光定量PCR技术检测FOXD1、FOXD3 mRNA的相对表达量,反应体系共10 μl,引物由上海捷瑞有限公司设计,FOXD1上游引物序列为5’-TGAGCACTGAGATGTCCGATG-3’,下游引物序列为5’-CACCACGTCGATGTCTGTTTC-3’;FOXD3上游引物序列为5’CGCTGCCCAATCCTGGACTCTG-3’,下游引物序列为5’CCCATCCCCACGGTACTAAGAGC-3’。反应条件为50℃/2 min,95℃/3 min,95℃/30 s,60℃/1 min,共循环40次。以GAPDH为内部参照,采用2-ΔΔCT法计算FOXD1、FOXD3 mRNA的相对表达量。该实验独立重复3次。
1.4 免疫组织化学法检测FOXD1与FOXD3蛋白表达情况
1.4.1 免疫组化实验主要试剂:手工染色检测食管鳞癌组织和癌旁组织中FOXD1、FOXD3蛋白表达。依次实施石蜡切片处理、脱蜡水化处理、抗原修复、加入阻断PO(内源性过氧化物酶)阻断剂、室温下一抗FOXD1与FOXD3(1∶100)反应1 h、复温、室温下二抗山羊抗兔IgG反应20 min,接着DAB显色、苏木素(Hematoxylin)复染、脱水封片与显微镜观察。FOXD1的一抗购自Santa Cruz Biotechnology,FOXD3的一抗购自Abcam公司。
1.4.2 染色结果评估:根据染色强度和阳性细胞百分率对切片进行评分分级:①染色强度:未着色、浅着色、中等着色、强着色对应的分值依次为0分、1分、2分、3分;②阳性细胞占比:0~25%、26%~50%、51%~75%、76%~100%对应的分值依次是1分、2分、3分、4分;③双方乘积:0~1分、2~4分、5~8分、9~12分依次对应阴性、弱阳性、中等阳性、强阳性,除了阴性,另3类皆属于阳性[5]。
1.5 观察指标 比较食管鳞癌组织和癌旁组织中FOXD1及FOXD3 mRNA和蛋白的表达水平,并分析食管鳞癌组织FOXD1和FOXD3表达与食管鳞癌患者临床病理特征关系,以及影响食管鳞癌患者预后生存的危险因素。
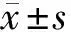
2 结果
2.1 食管鳞癌组织和癌旁组织中FOXD1及FOXD3 mRNA表达水平 食管鳞癌组织和癌旁组织中FOXD1 mRNA的相对表达量分别为1.085±0.432和 0.412±0.117,FOXD3 mRNA的相对表达量分别为0.397±0.120和1.143±0.335。在食管鳞癌组织中FOXD1相对表达量高于癌旁组织,FOXD3相对表达量低于癌旁组织,差异均有统计学意义(P<0.05)。见图1。
图1 食管鳞癌组织和癌旁组织中FOXD1及FOXD3 mRNA相对表达水平;A FOXD1 mRNA相对表达水平;B FOXD3 mRNA相对表达水平;与癌旁组织同一指标比较,*P<0.05
2.2 食管鳞癌组织和癌旁组织中FOXD1及FOXD3蛋白表达水平 食管鳞癌组织FOXD1阳性表达率明显高于癌旁正常组织,而食管鳞癌组织FOXD3阳性表达率明显低于癌旁正常组织,差异均有统计学意义(P<0.01)。见图2,表1。

表1 食管鳞癌组织和癌旁正常组织2组FOXD1、FOXD3表达情况 n=105,例(%)

图2 食管鳞癌组织和癌旁组织中FOXD1及FOXD3蛋白表达;A FOXD1免疫组化染色图;B FOXD3免疫组化染色图
2.3 食管鳞癌组织中FOXD1、FOXD3表达水平与临床病理特征之间的关系 食管鳞癌组织中FOXD1表达水平与患者有无淋巴结转移(χ2=5.512,P=0.019)、肿瘤浸润深度(χ2=4.317,P=0.038)和肿瘤TNM分期(χ2=6.998,P=0.008)相关,与患者年龄、性别及病理分化程度均无关(P=0.712、0.820)。FOXD3表达水平与患者性别(χ2=4.162,P=0.041)、有无淋巴结转移(χ2=7.581,P=0.006)、肿瘤浸润深度(χ2=5.318,P=0.021)和肿瘤TNM分期(χ2=5.709,P=0.017)相关,与患者年龄及病理分化程度均无关(P>0.05)。见表2、3。

表2 FOXD1在ESCC组织中的表达与患者临床病理特征的关系 例(%)
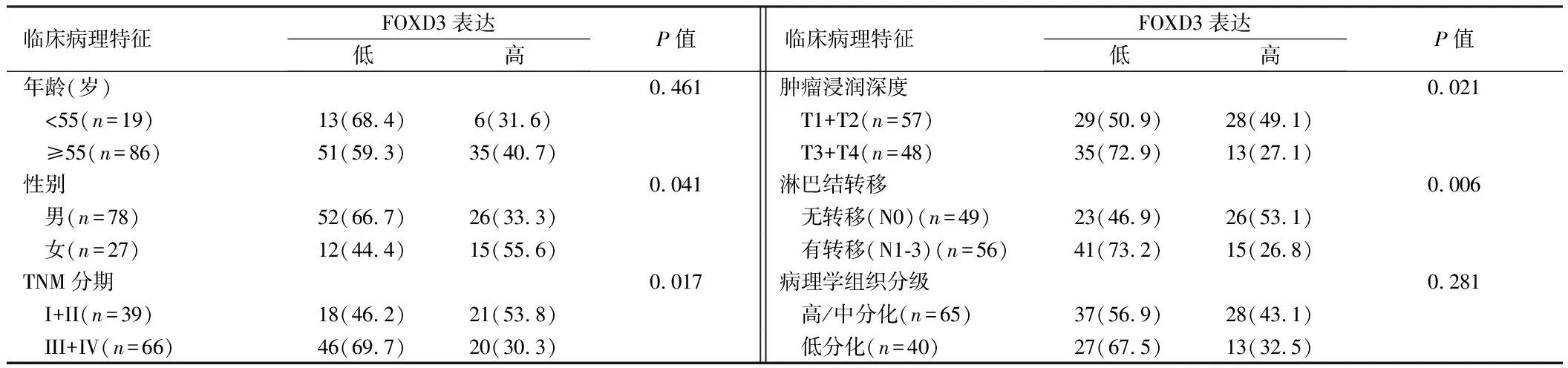
表3 FOXD3在ESCC组织中的表达与患者临床病理特征的关系 例(%)
2.4 影响食管鳞癌患者预后生存的多因素分析 将所有可能影响病人预后的因素带入COX回归模型,结果显示肿瘤TNM分期为Ⅲ/Ⅳ的ESCC患者死亡风险是肿瘤TNM分期为Ⅰ/Ⅱ期患者的2.884倍(95% CI:1.846~4.508,P<0.05);淋巴结有转移的ESCC患者的死亡风险是无淋巴结转移患者的2.103倍(95% CI:1.091~4.159,P<0.05);FOXD3高表达的ESCC患者死亡风险是FOXD3低表达者的0.514倍(95% CI:0.314~0.843,P<0.05);FOXD1高表达的ESCC患者死亡风险是FOXD1低表达者的3.585倍(95% CI:1.843~5.841,P<0.05)。综合以上结果,TNM分期、淋巴结转移、FOXD1表达阳性及FOXD3表达阴性均是影响食管鳞癌患者总生存率的独立危险因素(P<0.05)。见表4。
3 讨论
ESCA发病隐匿,具强侵袭性,较易病死,为一大消化道恶性肿瘤,临床表现主要为进行性吞咽障碍、癌痛与乏力等,如果未及时诊治,一定会对病人的身心健康与生命安全产生影响[6]。研究发现,分子标志物在食管癌患者的诊断,治疗以及预后评估中可发挥关键作用。
FOXD1也称为BF2和FREAC-4,是FOX转录因子家族中的一员,本质为蛋白质。在染色体水平上,FOXD1是一种常染色体单外显子基因,位于人类的5q12-q13。FOXD1含有鸟嘌呤-胞嘧啶(GC)富集区域,这些DNA区域容易形成发夹DNA结构和遭受聚合酶滑移,从而妨碍编码区的克隆和测序。FOXD1首次在前脑神经上皮内被识别和描述,它被认为是视网膜发育过程中的一个重要因素[7]。目前,FOXD1已被确认为癌症相关基因,它的异常表达在宫颈癌、肾透明细胞肉瘤、口腔鳞状细胞癌、胶质瘤、肺癌、乳腺癌、鼻咽癌和结直肠癌中被观察到,并参与了许多生物学过程[8-15]。Chen等[16]发现,FOXD1通过上调口腔鳞状细胞癌中的lncRNA CYTOR来促进EMT和药物的耐药性;还有研究表明,FOXD1通过激活ERK1/2信号通路促进结直肠癌发生和进展,并预示着FOXD1可能为一种潜在的肿瘤治疗靶点[17]。FOXD3同样作为FOX家族的成员之一,也是目前研究较为广泛,具有重要功能的转录因子之一。FOXD3位于人类染色体1p31.3上,FOXD3以共有序列5'A[AT]T[AG]TTTGTTT-3'与DNA结合。FOXD3作用于肿瘤的机制是多样的,Xie等[18]发现FOXD3会抑制鼻咽癌细胞的迁移和侵袭,PI3K/Akt信号通路对FOXD3抑制鼻咽癌细胞侵袭转移有重要影响。其他研究表明FOXD3在非小细胞肺癌进展中同样起着潜在的肿瘤抑制作用[19]。FOXD3可抑制多种癌细胞的迁移和侵袭,本研究结果进一步证实了FOXD3作为抑癌基因可通过抑制瘤细胞生长与侵袭在食管癌发生与进展中起关键作用。
本研究结果显示,食管鳞癌组织中FOXD1 mRNA及蛋白表达量高于癌旁组织,而FOXD3 mRNA及蛋白表达量低于癌旁组织。同时发现,上述分子表达在不同浸润深度、肿瘤TNM分期和淋巴结转移患者中存在显著差异,表明FOXD1和FOXD3表达可能与食管鳞癌恶性生物学行为有关。进一步建立多因素COX比例风险模型分析可知,TNM分期、淋巴结转移、以及FOXD1与FOXD3的表达是影响ESCC患者总生存率的独立危险因素,推测其主要通过影响肿瘤侵袭转移能力及细胞敏感性[20],进而影响患者预后。由此可见FOXD1、FOXD3表达的高低与食管鳞癌患者预后有着密切的联系。
综上,FOXD1、FOXD3的异常表达是食管鳞癌患者预后的独立危险因素,二者有望成为临床评估食管鳞癌患者预后的潜在分子标志物。

