内镜全层切除术治疗胃底异位脾1例
韩晓静 李妍霞 秦 浩
异位脾组织植入多为外伤或医源性脾损伤等后天因素导致脾脏细胞脱落引起自体移植,可发生于盆腔、胸腔和腹腔等部位。本文介绍经胃镜发现胃底黏膜下肿物两月余,行内镜全层切除术治疗后诊断为胃底异位脾组织患者1例的诊治情况。
1 病历摘要
患者,男,61岁,既往两月余前曾于我科行胃角高级别上皮内瘤变内镜黏膜下剥离术(ESD),当时行胃镜检查发现胃底黏膜下肿物,2022年3月2日行胃十二指肠增强CT示“胃底小弯侧近脊柱旁见一软组织密度结节影,与胃壁分界不清,直径约1.7 cm,增强扫描可见明显强化(图1)。”3月3日超声胃镜示“依CT定位于该处,以12 MHz小探头超声探查见一固有肌层来源均质低回声肿物,边界清晰,主要凸向腔外生长,最大截面1.99 cm×1.62 cm,胃壁各层结构清晰(图2、3)。”超声印象:胃底穹隆部后壁固有肌层均质低回声肿物,考虑间质瘤可能性大。为进一步行内镜下治疗,患者再次入住我科。患者约36年前因“车祸”致“脾破裂”,于当地医院行“脾切除术”。

图1 CT检查

图2 超声检查
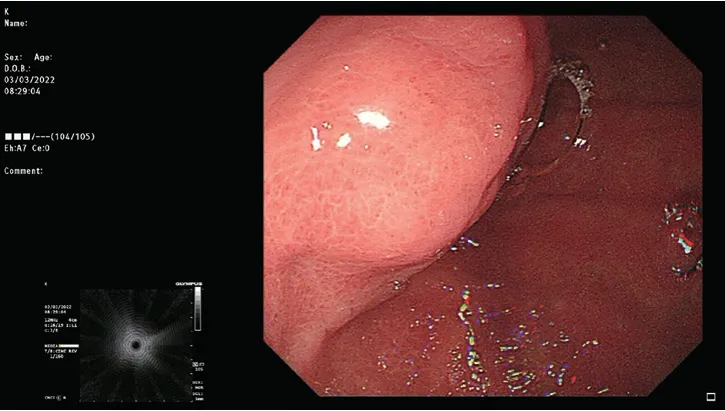
图3 超声探查
入院查体:睑结膜无苍白,巩膜无黄染;腹部平坦,脐左侧可见一长约15 cm陈旧性手术瘢痕;触软,无压痛、反跳痛,腹部无包块,肝脏未触及,脾脏未触及,肝肾区无叩痛;肠鸣音正常。入院后查三大常规、癌胚抗原、感染性疾病筛查均未见异常。5月24日行内镜下治疗:胃底后壁可见粗大皱襞,充气可见坡状隆起;胃角胃窦黏膜萎缩背景,胃角后壁原手术部位愈合良好,可见肉芽及再生上皮覆盖。因行超声内镜及强化CT已定位,故于隆起处予以亚甲蓝生理盐水行黏膜下注射,以啄木鸟刀(安瑞医疗)切开黏膜层,于黏膜下层剥离,见瘤体与黏膜下层粘连较重,以电刀将病变基本暴露后,见肿物基底位于固有肌层,仔细剥离发现肿瘤被膜与浆膜面融为一体,镜下难以继续剥离,遂拟予圈套器全层切除。圈套器套取发现肿瘤难以拉入胃腔内,考虑基底浆膜面外亦有粘连,遂将肿瘤送快速病理,20分钟后结果示“送检组织明显出血,急慢性炎细胞浸润,个别区域淋巴结形成,”术中请胃肠外科会诊,考虑粘连为脾切除术后所致,故将胃壁主动穿孔,完整切除病变(图4)。创面缺损外为膈肌,观察无出血及其他异常后,将创面以尼龙圈金属夹荷包缝合(图5),气腹针行右下腹穿刺排出腹腔内残气后,胃腔内充气试验无漏气,镜下留置胃管引流,术毕。镜下诊断:胃底黏膜下隆起;胃ESD术后所见;慢性胃炎;内镜全层切除术+胃镜下置管术。术后予抑酸、抗感染、补液等治疗。术后病理:(胃底)送检组织淋巴组织增生,富含血窦,散在少许淋巴滤泡,较符合异位脾组织(图6)。

图4 内镜手术
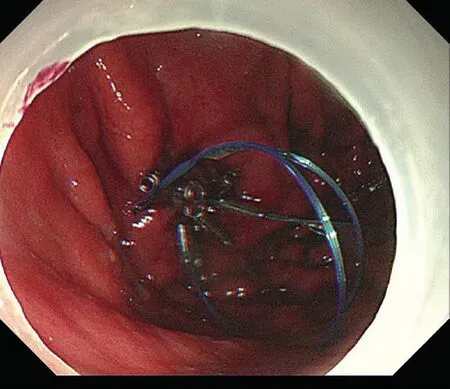
图5 创面缝合

图6 病理组织检查
2 讨论
脾脏的正常生理位置在左侧季肋部,位于胃底与膈肌之间,由胃脾韧带、脾肾韧带和膈结肠韧带支持固定。正常解剖结构外的脾组织统称为异位脾,临床常见的异位脾为副脾与脾组织植入。前者为先天发育异常所致,多存在于脾门周围、胰尾部等邻近脾脏的部位;后者多为外伤或医源性脾损伤等后天因素导致脾脏细胞脱落引起自体移植,经周围组织结构提供血供形成[1]。自体移植途径可能为破裂处潜在的腔隙、脾髓血行播散、脾静脉栓子等。由于缺乏独立的血供,异位脾组织的体积一般不大[2]。胃间质瘤是胃黏膜下常见的间叶源性肿瘤,大小不一,生物学行为可表现为多向分化,并具有恶变潜能。
超声胃镜能直接观察病灶表面形态,并可通过超声探头对胃壁各层结构进行区分,判断胃黏膜下肿物的浸润深度。超声内镜诊断胃间质瘤的灵敏度为88.27%,特异度为65.38%,准确率为85.11%[3]。胃底异位脾与胃间质瘤的胃镜下表现均可为胃黏膜下隆起,超声胃镜下均可表现为低回声改变,故二者不易区分。异位脾组织的CT表现多为密度均匀的结节或肿块,边界清楚,增强扫描小于3 cm的病灶由于红白髓含量少,血流行程短,血流差异不明显,动脉期多表现为均匀强化,与间质瘤无明显差别[4]。此外,通过肿物细针穿刺进行鉴别,操作安全方便,但可能由于吸取物小造成假阴性[5]。
本例患者依靠胃镜、超声胃镜、增强CT等现有条件,术前考虑胃间质瘤可能性大,但最终病理结果确诊异位脾组织,结合患者既往脾外伤手术病史,考虑胃内异位脾组织为脾外伤或脾切除术引起的自体种植。近年来,国内关于异位脾种植的报道逐渐增多,临床医师应加强认识,对于既往有脾外伤、手术等病史的患者一旦出现黏膜下肿物,应提高警惕。

