真空封闭引流治疗肾移植术后复杂性切口感染1 例并文献复习
赵艳霞,石韶华,武小桐(山西省第二人民医院肾移植透析中心,山西 太原 030000)
手术部位感染(surgical site infection ,SSI)是肾移植术后一种严重且潜在的致命并发症[1-2]。切口感染的处理原则为早期诊断、有效引流、合理使用包括抗菌药物在内的各种药物。然而,由于持续地使用激素和免疫抑制剂,效果似乎不令人满意[5-7]。参照其他外科经验,本中心首次采用真空密封引流(vacuum sealing drainage,VSD)治疗了1 例肾移植术后复杂性切口感染患者,取得了显著效果,现将该患者的诊疗经过进行总结并行相关文献复习。
1 病例资料
1.1 患者一般资料及肾移植手术情况:患者,男性,31 岁,身高为178 cm,体重为58.7 kg,体重指数为18.53 kg/m2。患者因慢性肾脏病5 期,于2022 年2 月11 日于本院行同种异体肾移植手术治疗。原发病为系膜增生性肾小球肾炎,既往有高血压病史,无传染病病史。入院查:肌酐为606.00 μmol/L,尿素为12.50 mmol/L,血清白蛋白为54.60 g/L,血清前白蛋白为0.48 g/L,葡萄糖为4.33 mmo/L。供者为男性,68 岁,脑死亡捐献。移植手术使用Gibson 切口经腹膜外入路将肾脏放置在髂窝[6],肾血管与髂外系统的端-侧吻合。采用Lich-Gregoir 输尿管膀胱吻合术常规双J 膀胱植入,肌肉筋膜层和皮下脂肪层用间断单丝线缝合,皮肤边缘用皮肤吻合器吻合。术前给予抗人T 细胞兔免疫球蛋白(anti-human T lymphocyte rabbit immunoglobulin,ATG-F)25 mg,甲强龙0.75 g 免疫诱导,ATG-F 术后连续使用3 d,同时给予他克莫司+吗替麦考酚酯+甲泼尼龙片三联免疫抑制抗排斥反应治疗,围术期给予美罗培南(0.5 g,Q 12 h,5 d)及卡泊芬净(50 mg,Qd,10 d)预防性抗感染治疗。
患者术后第1 天尿量由3 400 ml 减少至425 ml,血流明显减少,遂行移植肾探查术并行移植肾穿刺活检显示:移植肾轻度急性肾小管坏死,移植肾肾小球足细胞弥漫融合,移植肾显著血管病变伴缺血硬化(图1)。行持续性床旁血液透析滤过治疗,并行DFPP 5 次(术后16 d 结束),每天7.5 g 静注人免疫球蛋白连续10 d。
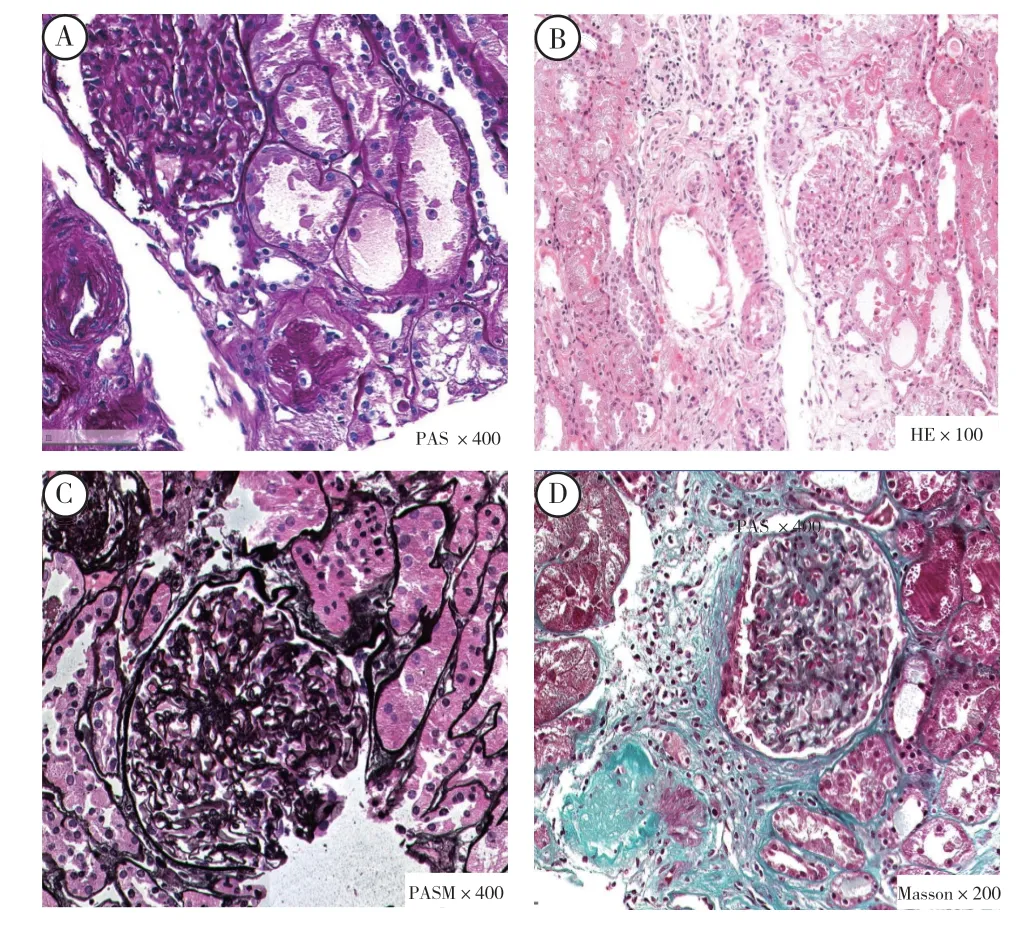
图1 肾脏穿刺病理结果
1.2 患者切口感染及诊疗过程:术后19 d 患者自觉移植肾区切口肿胀及下坠感,腹部CT 显示为切口腹直肌处血肿,约4.5 cm×3.7 cm×11 cm,术后23 d,行清除血肿(图2),每日浓钠清洗,并补充白蛋白治疗。术后29 d,连续3 次肾周分泌物培养显示为多重耐药鲍曼不动杆菌,给予口服米诺环素片+替加环素(50 mg,Q 12 h,7 d)治疗。
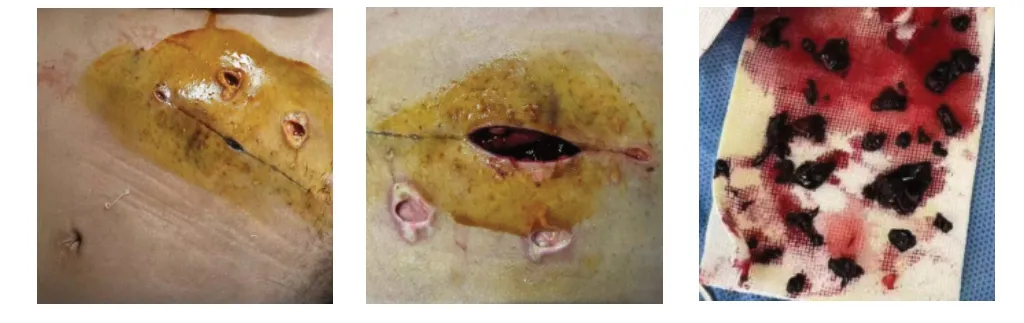
图2 切口局部血肿及清除
1.3 VSD 引流:术后32 d,普通外科处理切口效果不佳,参考烧伤美容科经验,首次在肾移植切口引入一次性VSD 负压引流装置(图3)。VSD 装置(SAC-A8-D2 萨科医疗科技有限公司)由中央负压系统、硅胶吸导管(F16,480 mm)、医疗透明膜(中国威森,广东)和黑色自黏无菌孔泡沫(Wayson)组成。创面预处理后予以VSD 负压吸引装置封闭创面,用医用高分子材料膜与紧密贴合皮肤创面,将所有创面覆盖完整最佳,将引流管接至医院负压中心并调整负压值设置为-80 ~-60 mmHg (1 mmHg=0.133 kPa)行持续负压吸引,将0.9%生理盐水500 ml 加入胰岛素8 U 通过使用一次性静脉输液器连接至负压吸引装置的冲洗管道,并将滴速调整至20 滴/分,灌洗频率为2 次/d。VSD 负压高分子材料膜表面肉眼可见管型并未闻及漏气声,说明密闭性良好,为有效的负压吸引。开放的伤口随后变成了一个封闭的、受控制的系统。VSD 装置每5 d 更新一次。
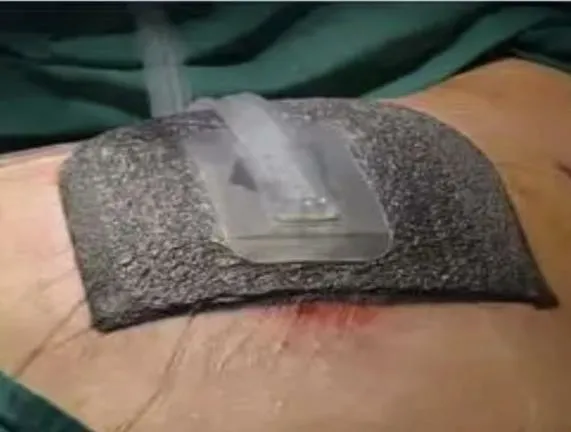
图3 切口VSD 引流
1.4 术后51 d,连续3 次肾周分泌物培养阴性,术后55 d 切口清创缝合,术后69 d 切口拆线 (图4)。长期随访,患者血肌酐波动于159 μmol/L 左右,尿素氮波动于11.34 mmol/L 左右。
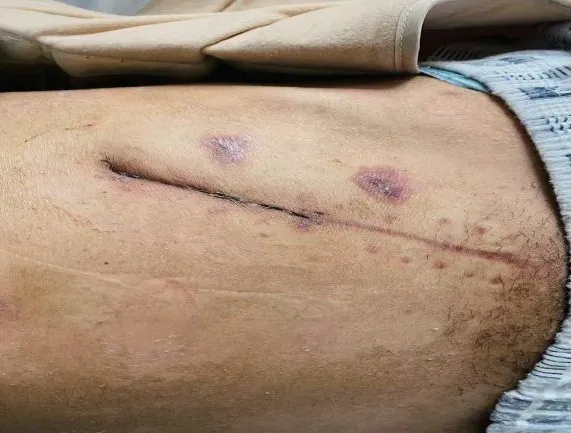
图4 切口拆线情况
3 讨 论
SSI 是肾移植术(renal transplantation,RT)后一种严重且潜在的致命并发症[1-2]。它发生在3.8%~18.5%的肾移植受者中,而在肥胖患者中发病率较高[8]。SSI 显著延长了住院时间,增加了医疗费用[1]。更重要的是,它可能威胁移植肾和肾移植受者的生存。到目前为止,肾移植受者的SSI 一直优先采用经典治疗手段,包括抗菌药物、清创、引流和二次闭合。然而,这通常需要很长时间,而且由于持续的免疫抑制,效果不佳[3-5]。
真空密封引流(vaccum sealing drainage,VSD)治疗是一种相对较新的技术,最初是在20 世纪90 年代末为需要整形和重建手术而开发的。在过去的20 年里,这项技术被广泛应用于烧伤、溃疡、开放性伤口和复杂的腹壁重建等领域。VSD 具有真空、密封、引流等特点,采用可控负压、封闭空间和连续引流进行工作。近年来,新兴的负压吸引技术已经逐渐代替了传统的反复清创换药,通过持续负压引流冲洗能彻底清除异物,减少渗液对伤口的污染,创造湿性环境,抑制细菌繁殖,扩张微血管,加快创面血液循环速度,从而刺激肉芽组织的形成,为组织可塑性创造条件,最终促进伤口愈合[9]。理论上,持续负压吸能有效去除过多的间质水肿液和毒性介质,减少细菌负荷,增加血液灌注,增强肉芽组织形成,并促进伤口愈合。黑色的泡沫可以消除组织层之间的死空间。生物膜模拟皮肤屏障的作用,保护伤口免受继发性感染。总的来说,VSD治疗的目标是创造一个干燥和无菌的伤口愈合环境,有利于伤口愈合。目前对VSD 膜负压引流的临床机制尚不完全清楚,其可能的作用原理为:① 对创口进行负压封闭引流,可使引流创面与外界隔离良好,可有效预防伤口因与外界环境接触而发生感染的现象发生。② 利用封闭负压引流技术,可将患处的坏死组织及渗出液和异物等持续排出体外,保证了患者创面的清洁。③ 负压持续引流,改善了创面的微循环,使得血液供应更充足,改善淋巴循环,促进肉芽组织生长。④ 及时持续的将渗出液排出体外,减轻了液体对周围组织的损伤,减轻周围组织水肿,有效降低血管通透性[10]。
移植物功能延迟恢复(delayed graft function,DGF)和边缘供肾已被证明是肾移植术后后伤口愈合不良的危险因素[1]。尿毒症患者通常会有长期贫血、低白蛋白血症和间质性水肿。DGF 进一步延迟了上述条件的持续时间,从而导致伤口愈合能力较差。所有这些情况使放疗受者伤口感染的管理复杂化。通过持续的负压抽吸,重组后的VSD 系统可以通过清除渗出物和炎症因子,有效根除病原体的定植,保持清晰的环境。本例患者引入VSD治疗后,渗出物量迅速减少,伤口逐渐愈合,提示VSD 治疗提供了有效的渗出物引流,防止了感染扩散。虽然VSD 通常被认为是一种安全可靠的伤口护理工具,但仍需要注意持续高负压对异体移植肾、输尿管和血管的损害[11]。Franchin 等[12]认为,当腹部器官或血管暴露时,是VSD 治疗的禁忌。Loaec 等[13]认为,VSD 对于伤口感染失控和存在坏死组织需要清创的患者是治疗禁忌。根据国际共识指南,在-80 mmHg 和-60 mmHg 之间较合适,本中心使用该范围内负压引流,效果良好,无临床异常及患者不适。

