金黄汤剂对大肠杆菌致小鼠发病治疗作用研究
李 斌,张 慧,于 鹏,邹 明,梁 晓,张启迪*
(1.青岛大沽河流域国家农业科技园发展服务中心,山东青岛 266225;2.山东畜牧兽医职业学院,山东潍坊 261061;3.青岛农业大学动物医学院,山东青岛 266109)
大肠杆菌是畜禽机体肠道内最为常见的细菌,只有10%~15%大肠杆菌存在致病性。大肠杆菌抗原结构复杂,其鞭毛、荚膜、菌毛等都是菌体的主要抗原结构,也构成了大肠杆菌多种血清型。目前已确定的菌体抗原对猪、家禽能产生致病作用的大肠杆菌血清型以O1、O2、O35和O78最为常见[1]。近年来随着畜禽集约化养殖模式的飞速发展,猪、家禽大肠杆菌病的发病率也呈一定的上升趋势,且该病发病率多为11%~69%,死亡率为3.8%~72.9%,致死率为40.2%~90.3%[2]。另外,无公害和健康养殖的发展趋势又使养殖企业(户)无法大规模使用抗生素,无疑对大肠杆菌病的防治提出了更高的要求。
中药以其毒副作用小,安全性高和不易产生耐药性等特点,近年来在畜禽减抗、替抗的道路上愈发受到重视。本试验所采用的金黄汤剂,是针对猪、家禽大肠杆菌病的临床特性,以黄连为主药,添以金银花、甘草等7 种中草药按照一定的比例研制而出。为探明此药的临床治疗效果,本文通过建立大肠杆菌病小鼠模型进行金黄汤剂不同剂量的给药治疗,观察小鼠治疗前后的采食量、治愈率和死亡率,为后期畜禽健康养殖中临床用药提供理论支撑。
1 材料
1.1 试验菌株、培养基、动物及试验药品
大肠杆菌O78在-20℃环境下保存。
营养琼脂(202028)、麦康凯琼脂(批号:201929)、LB 肉汤培养基(202012)均购自北京陆桥技术有限公司。
昆明系小鼠(180 只,体重18~22g,雌雄各半)购自辽宁长生生物技术股份有限公司,实验动物生产许可证号:SCXK(辽)2020-0001。
黄连(202111)、苦参(202201)、黄柏(202201)、甘草(202203)均购自安徽广印堂制药有限公司。金银花(202112)购自亳州仁益中药材销售有限公司。
1.2 试验仪器
本试验使用的实验仪器如表1 所示。

表1 本试验使用的试验仪器及其生产商
2 方法
2.1 金黄汤剂的制备
称取金银花和黄连等中药共100g,加入10倍量蒸馏水,浸泡30min 后,水煮1h,用4 层纱布过滤药液后再加入10 倍量蒸馏水,浸泡45min,水煮时间为45min,煎煮3 次。合并三次所得药液,温火浓缩至1g/mL。将所得药液放于4℃冰箱中过夜后,在6000r/min 下离心10min,取上清液,灭菌密封备用。
2.2 试验前准备
2.2.1 试验动物饲养
小鼠购进后,饲养于小鼠专用实验房内,室温22~24℃,湿度为50%~70%,照明/黑暗12h 交替进行,正常饲养3~5d。饲养笼具使用前用新吉尔灭浸泡消毒。雌雄小鼠分笼饲养,每个笼具配有水壶和不锈钢网罩,自由采食、饮水。饲喂小鼠全价固体饲料,饲料中不添加任何抗生素或抗菌药物。
2.2.2 大肠杆菌菌悬液的制备
将于-20℃保存下的大肠杆菌O78复苏后在LB 肉汤中增殖。采用十倍稀释法,用1mL 无菌吸管吸取3.6mL LB 肉汤于各试管中,吸取0.4mL 菌液于第一支试管中吹打混匀,后吸取0.4mL 于第二支试管中,依次稀释至第12 支试管。分别吸取1mL 10-5、10-6、10-7、10-8、10-9、10-10、10-11和10-12共8 个稀释度菌液与30~40℃的营养琼脂混合加入培养皿中(每组设置3 个重复),待营养琼脂凝固后放入37℃环境中培养12~14h 至长出菌落。根据《中华人民共和国食品安全国家标准》(GB4789.3-2010)中规定[3],选取菌落数在30~300 个的平板,进行菌落计数,根据计数结果除以涂布体积后乘以稀释倍数为该菌液的浓度。
2.2.3 小鼠大肠杆菌病模型的建立
取60 只小鼠均等分成6 组,每组小鼠雌雄各半,分别腹腔注射0.1、0.2、0.3、0.4 和0.5mL大肠杆菌菌液和0.5mL 灭菌生理盐水。观察小鼠精神状态、反应能力和采食引水等状态。记录各组小鼠发病时间,临床症状、死亡情况和器官病理变化等。将死亡的小鼠剖检,进行大肠杆菌分离鉴定,确定是因大肠杆菌所引起的发病死亡,同时确定正式攻毒剂量。
2.3 金黄汤剂小鼠药效学试验
试验于2022 年5 月在山东畜牧兽医职业学院药理实验室内进行。取小鼠120 只,体重(20±1)g,随机分成6 组,每组雌雄各半,即金黄汤剂高、中、低剂量组、20%氟苯尼考组、攻毒组和空白组。除空白组外,每组小鼠均腹腔注射0.2mL 大肠杆菌菌液。待小鼠出现精神萎靡,不愿采食等临床现象后,各试验组按照表2 所示进行分组给药,24h 内给药2 次,每次间隔12h,连用7d,用药期间记录各组小鼠采食量,死亡数等,同时计算各组动物的治愈率、有效率和死亡率,并计算总有效率。
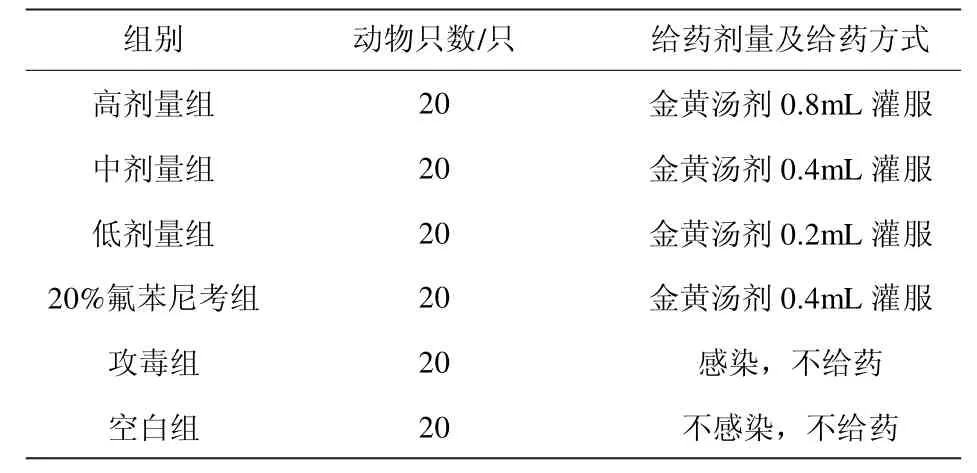
表2 金黄汤剂剂量分组
2.4 试验观察指标
参考《兽用化药中药研究技术指导原则汇编(2022 年)》上所示要求,从中选取以下几项作为试验观察记录指标:
治愈率:药效学试验过程中,经用药后被毛散乱、眼睑分泌物、趴卧不动等临床症状消失,采食和精神状态恢复正常的动物只数与发病动物数比值。
有效率:药效学试验过程中,经用药后上述临床症状有所减轻,采食和精神状态有所改善的动物只数与发病动物数比值。
总有效率:药效学试验结束后,试验动物治愈数和有效数总和占动物治疗数的百分比。
3 结果
3.1 攻毒剂量的确定
各组小鼠在注射大肠杆菌菌液4h 后与生理盐水组相比,出现精神沉郁、食欲下降等临床症状,6h 后出现眼睑分泌物增多,被毛粗乱,由图1 可知,0.4mL 和0.5mL 组在攻毒6h 后小鼠开始有死亡,12h 后各剂量组小鼠均出现死亡现象。12~48h 为小鼠死亡高峰期,72h 后已没有小鼠在出现死亡现象。综合图1、表3,0.4mL 和0.5mL 组小鼠死亡率为100%,且死亡高峰期在攻毒后6~12h,发病急,致死率高,不适合做药效学试验。0.3mL 组小鼠与0.4mL 和0.5mL 组相比,虽然死亡时间延长,但死亡率仍偏高。而0.1mL 组发病率和死亡率低。根据药效试验评价的需要,即攻毒剂量对应的死亡率在60%~90%范围内的作为动物模型的最佳攻毒剂量[4]。故本试验选取0.2mL 2.16×108CFU/mL 菌液作为正式试验的攻毒剂量。

图1 各组小鼠死亡时间及只数
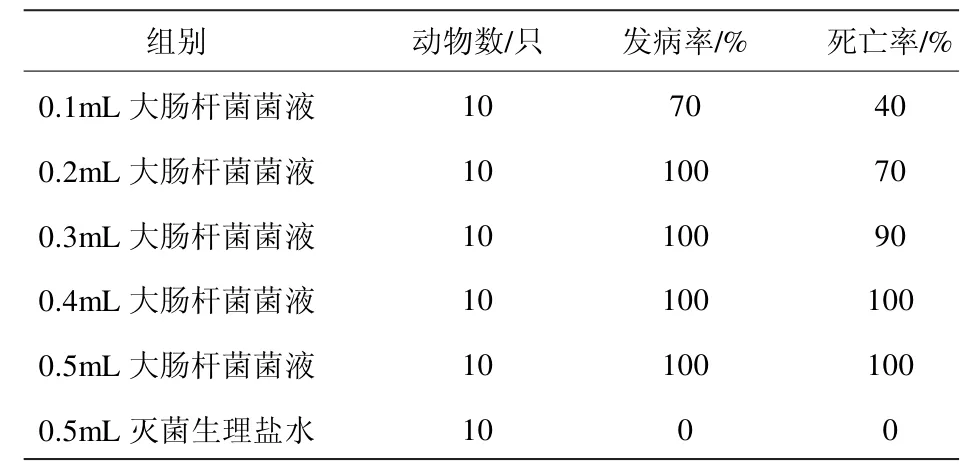
表3 各组小鼠发病率和死亡率
3.2 细菌鉴定
将死亡的小鼠进行剖检检查,发现肝脏、心脏和胃粘膜表面有许多出血点,肝脏肿大,肠系膜有多个出血点。
取病变组织涂片,革兰氏染色,镜检为革兰氏阴性杆菌(图3)。细菌在营养琼脂培养基生长良好,菌落表面光滑,边缘整齐。在麦康凯中培养呈现红色菌落(图2),可以确定是大肠杆菌感染所致。

图2 麦康凯培养结果
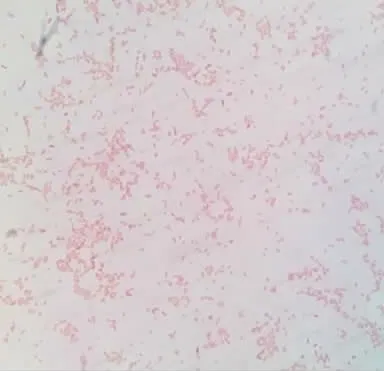
图3 革兰氏染色结果(放大倍数:物镜40×目镜10)
3.3 金黄汤剂小鼠药效学试验结果
从图4 和表4 数据中可以看出,攻毒4h 后灌服药物,与攻毒组相比,高剂量组和20%氟苯尼考组能够起到明显的治疗作用,死亡数有明显的降低;高、中剂量组死亡只数与20%氟苯尼考组相比差距较小,而低剂量组与20%氟苯尼考组相比差距较大;金黄汤剂各剂量组以及20%氟苯尼考组的治愈数均高于攻毒组;低剂量组与高、中剂量组和20%氟苯尼考组相比存在显著性差异(P<0.05),高、中剂量组与20%氟苯尼考组相比差异性不显著(P>0.05)。所以,金黄汤剂对大肠杆菌有一定的治疗作用。
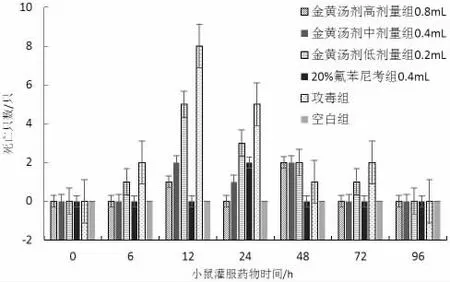
图4 各组小鼠用药后死亡情况

表4 各组治疗情况统计
3.4 感染大肠杆菌对小鼠采食量影响
金黄汤剂对感染大肠杆菌的小鼠采食量影响,结果如图5 所示。第3 天攻毒后除空白组外,其余5 组采食量均出现明显的降低,第8 天时,20%氟苯尼考组、高、中剂量组的采食量有较为明显的上升,到第10 天时采食量已经接近空白组,低剂量组采食量增长缓慢,而攻毒组的采食量在攻毒下降后没有增长的趋势。
4 讨论
4.1 小鼠大肠杆菌病病理模型的建立
建立细菌性疾病病理模型是研究抗菌药物抗菌活性最常用的方法之一,从而为临床应用提供剂量参考。赵荣山[5]曾报道称腹腔注射2.7×108CFU/mL 大肠杆菌菌液成功构建小鼠大肠杆菌病模型;李春花[6]则用1.4×1011CFU/mL 大肠杆菌菌液构建了小鼠大肠杆菌病模型。综合他人的研究经验和结果,本试验在构建大肠杆菌病病理模型时,按照10 的倍数稀释菌液,经试验最终确定攻毒剂量为0.2mL 2.16×108CFU/mL,能够满足临床药效试验评价要求并成功构建小鼠大肠杆菌病的病理模型。本试验最终确定的菌液浓度与已有报道的菌液浓度不同,可能是不同血清型的大肠杆菌致病力不同,或者是同种动物不同个体对同一病原体有不同的抵抗力。所以,在构建动物病理模型时还需考虑试验动物的品种、大小和病原微生物的种类等相关因素。
4.2 影响中药治疗效果的因素
临床药效试验结果证明金黄汤剂对大肠杆菌有较好的治疗作用,但与抗生素比较相对较弱,这可能与中药有效成分提取方法和抗菌机制有关。孙春华[7]和张洪利[8]发现对同种中草药,若采用不同的提取方法,金黄色葡萄球菌的体外抑菌效果就会不同。在抗菌和治疗机制上,中药多是通过增强动物机体免疫力来起到治疗作用[9],在细菌毒素清除效果上不及抗生素,故其治疗效果会产生差异。本试验中金黄汤剂的总有效率虽与20%氟苯尼考没有显著性差异,但是总有效率不及抗生素,可能是该复方中药的抑菌机制和氟苯尼考不同所致,故在日后生产临床治疗中,需要考虑上述问题。
4.3 金黄汤剂对小鼠治疗情况
从最终的试验结果分析,金黄汤剂高剂量组能够减少小鼠的死亡数,其治疗效果与氟苯尼考对照无明显差异,中剂量组效果次之,而低剂量组的死亡数较高,对大肠杆菌的治疗效果较差;各组总有效率经卡方检验后,高、中剂量组与20%氟苯尼考组间差异不显著,说明金黄汤剂对大肠杆菌病有较好的治疗效果,在生产以及临床用药上有一定的应用前景。
但在试验中,高、中剂量组在治疗剂量上相差一倍,治疗效果却差异不显著,且各组小鼠在第7 天(治疗第4 天)后很少在发生死亡现象,第8 天(治疗第5 天)后已接近正常采食量。因此,综上因素推荐中剂量0.4mL 作为小鼠用药的治疗剂量。
5 结论
通过大肠杆菌建立小鼠发病动物模型,在小鼠体重20g 条件下,按照0.4mL 连用7d 的剂量对小鼠进行灌服,治疗5d 后小鼠发病症状有明显好转。

