TKH-03在体内外逆转A2780T细胞对紫杉醇的耐药性研究*
何 丽,龚照林,黄 璐,廖晓燕,林永红
(电子科技大学医学院附属妇女儿童医院·成都市妇女儿童中心医院,成都 610000)
卵巢癌是女性最常见的恶性肿瘤之一,紫杉醇是卵巢癌临床常用化疗药物之一,但其耐药现象严重制约了其临床疗效,导致耐药的主要机制之一是癌细胞中ABCB1过度表达。酪氨酸激酶抑制剂作为ABC转运蛋白的底物,能被一种或多种ABC转运蛋白泵出细胞外,造成肿瘤细胞产生耐药[1-3]。近年研究发现,许多酪氨酸激酶抑制剂通过抑制ABCB1的药物外排功能,增敏化疗药物的化疗效果,从而达到逆转多药耐药的作用。TKH-03是一种吉非替尼类似物,是具有表皮生长因子受体酪氨酸激酶抑制活性的化合物,目前正在进行Ⅰ期临床试验。TKH-03与吉非替尼相比,具有更高的抗肿瘤活性和更低的药物不良反应发生率[4]。目前国内外尚无关于TKH-03对逆转肿瘤耐药细胞对药物的耐药性,本文拟研究TKH-03在体内外对ABCB1介导的卵巢癌耐药的影响及作用机制,探讨TKH-03能否作为耐药逆转剂,并预测药物的不良反应、初步进行安全性评价,以期为TKH-03联合化疗药物治疗肿瘤耐药提供参考依据。
1 材料与方法
1.1 试药、仪器与动物 TKH-03由武汉恒信源公司提供(含量99.7%);紫杉醇购自西安旭全公司(含量99.5%);盐酸维拉帕米购自上海阿拉丁(含量99.0%)。人卵巢癌细胞A2780、紫杉醇诱导的多药耐药细胞A2780T由四川大学生物治疗国家重点实验室药剂学课题组惠赠。RPMI 1640培养基购自美国Gibco公司。南美胎牛血清、青链霉素混合液购自Hyclone公司。Ki-67抗体购自美国CST公司。ALT、AST、BUN、CRE试剂盒购自瑞士Roche公司。Kolliphor Rh40聚氧乙烯40氢化蓖麻油由德国巴斯夫公司惠赠。Roche Cobas c 311全自动生化分析仪(瑞士Roche公司)。RO/DI digital实验室纯化水系统(上海和泰仪器)。雌性BALB/c-nu裸鼠,4~5周龄,体重(20±2)g,购自成都达硕公司,动物生产许可证号:SCXK(川)2020-030。
1.2 细胞培养 A2780和A2780T细胞用含10%胎牛血清、1%青霉素-链霉素的RPMI 1640培养基培养。A2780T细胞的培养液含1000ng/mL紫杉醇以维持细胞的耐药性,实验前1周A2780T细胞培养于无紫杉醇的培养基中。细胞在37℃、含5% CO2孵箱中培养。A2780按1∶5比例传代,A2780T按1∶3比例传代,每3天传代一次。取处于对数生长期的A2780、A2780T细胞用于后续实验。
1.3 实验方法
1.3.1 CCK-8法检测A2780T细胞的耐药倍数 将A2780、A2780T细胞按4×103细胞/孔接种于96孔板,培养24h待细胞贴壁,弃旧培养基,每孔加200μL含紫杉醇的培养基。A2780细胞中紫杉醇浓度分别为0.0125、0.025、0.05、0.1、0.4、1.6μmol/L;A2780T细胞中紫杉醇浓度分别为0.25、0.5、1、5、10、20μmol/L。设置调零孔(只含完全培养基)和空白孔(含细胞、完全培养基)。药物干预48h,每孔避光加10μL CCK-8溶液,培养箱内孵育4h,酶标仪检测450nm处各孔吸光度(OD)值。Bliss法计算各组药物对细胞的半数抑制浓度(half maximal inhibitory concentration,IC50),并计算耐药倍数。每组设6个复孔,实验重复3次。
1.3.2 细胞毒性实验筛选TKH-03的无毒浓度 将A2780、A2780T细胞按4×103细胞/孔接种于96孔板,培养24h待细胞贴壁,弃旧培养基,每孔加200μL含TKH-03培养基。A2780细胞中TKH-03浓度分别为0.02、0.04、0.08、0.16、0.32、0.64μmol/L;A2780T细胞中TKH-03浓度分别为0.1、0.2、1、2.5、10、20μmol/L。设置调零孔(只含完全培养基)和空白孔(含细胞、完全培养基)。药物干预48h,每孔避光加10μL CCK-8溶液,培养箱内孵育4h,酶标仪检测450nm处各孔的OD值,计算各组药物对细胞的增殖抑制率。每组设6个复孔,实验重复3次。
1.3.3 CCK-8法检测逆转耐药倍数 将A2780、A2780T细胞按4×103细胞/孔接种于96孔板。将A2780细胞分为紫杉醇单用组(0.0125、0.025、0.05、0.1、0.4、1.6μmol/L紫杉醇),维拉帕米联用组(1μmol/L维拉帕米+浓度梯度紫杉醇),TKH-03低剂量联用组(0.005μmol/L TKH-03+浓度梯度紫杉醇),TKH-03中剂量联用组(0.01μmol/L TKH-03+浓度梯度紫杉醇),TKH-03高剂量联用组(0.02μmol/L TKH-03+浓度梯度紫杉醇)。将A2780T细胞分为紫杉醇单用组(0.25、0.5、1、5、10、20μmol/L紫杉醇),维拉帕米联用组(10μmol/L 维拉帕米+浓度梯度紫杉醇),TKH-03低剂量联用组(0.05μmol/L TKH-03+浓度梯度紫杉醇),TKH-03中剂量联用组(0.1μmol/L TKH-03+浓度梯度紫杉醇),TKH-03高剂量联用组(0.2μmol/L TKH-03+浓度梯度紫杉醇)。药物干预48h,每孔避光加10μL CCK-8溶液,培养箱内孵育4h,酶标仪检测450nm处各孔OD值。按公式计算各组耐药逆转倍数。每组设6个复孔,实验重复3次。耐药逆转倍数=紫杉醇组IC50/联合用药组IC50。基于上述细胞毒性实验结果,选取细胞存活率大于90%,即无毒浓度的TKH-03进行逆转耐药实验。在无毒浓度的TKH-03作用下,检测紫杉醇对A2780和A2780T细胞的IC50。维拉帕米为ABCB1转运体的底物性药物,作为阳性对照化合物。
1.3.4 Annexin V-FITC/PI双染法检测细胞凋亡 将A2780T细胞按4×105细胞/孔接种于6孔板。对照组(2mL完全培养基),TKH-03组(0.2μmol/L TKH-03),紫杉醇组(1μmol/L 紫杉醇),联合用药低剂量组(0.05μmol/L TKH-03+1μmol/L紫杉醇),联合用药中剂量组(0.1μmol/L TKH-03+1μmol/L紫杉醇),联合用药高剂量组(0.2μmol/L TKH-03+1μmol/L紫杉醇);培养24h,待细胞贴壁,弃旧培养基。药物作用48h后,吸取上清液至15mL离心管,用不含EDTA的胰酶消化细胞,合并上清和消化好的细胞悬液,1500r/min,4℃离心5min。弃上清,用预冷PBS洗涤细胞2次。弃PBS,加100μL 1×Binding Buffer重悬细胞,加5μL Annexin V-FITC和10μL PI Staining Solution,轻轻混匀。避光,室温反应15min。加400μL 1×Binding Buffer,混匀置于冰上,用流式细胞仪进行检测。用FlowJo V10软件进行结果分析。每组设单孔,实验重复3次。
1.3.5 TKH-03联合紫杉醇对A2780T细胞周期分布的影响 细胞分组按1.3.4,收集细胞上清液至离心管,用胰酶消化细胞,将细胞悬液加入离心管,1500r/min离心5min,弃上清,用1mL预冷的PBS洗涤细胞1次,离心收集细胞沉淀;1mL预冷的70%乙醇固定细胞,4℃过夜。1500r/min离心5min,弃上清,用预冷PBS洗涤细胞1次,离心收集细胞沉淀;0.5mL染色缓冲液中加10μL PI和10μL RNaseA溶液,混匀待用。每个细胞样品加0.5mL配置好的PI染色液,轻轻混匀重悬细胞。37℃避光孵育30min,用流式细胞仪在488nm处检测。用ModFit软件进行结果分析。每组设单孔,实验重复3次。
1.3.6 细胞克隆实验 将A2780T细胞按1×103细胞/孔接种于6孔板,实验分组按1.3.4,将6孔板置于孵育箱,2~3天换一次培养基。每天观察细胞克隆形成情况,当孔板内出现明显细胞集落时,终止培养。弃上清,PBS洗涤细胞2次,每孔加2mL 4%多聚甲醛固定15min。弃固定液,加结晶紫染色30min,用流水缓慢洗去染色液,空气干燥。计数克隆形成数,按公式计算克隆形成率。每组设单孔,实验重复3次。克隆形成率(%)=克隆数/接种细胞数×100%。
1.3.7 Western blot检测ABCB1蛋白的表达 提取细胞总蛋白。根据说明书操作流程,使用BCA蛋白测定试剂盒,测定蛋白浓度。电泳后,将蛋白质转移至PVDF膜。用1×TBST洗膜3次,每次5min。将PVDF膜放入5%脱脂奶粉,室温封闭2h。封闭结束后,PVDF膜用1×TBST洗涤3次,每次5min。按1∶1000比例用一抗稀释液配制抗体,4℃孵育过夜。取出PVDF膜,用1×TBST洗涤3次,每次5min。按1∶4000比例用5%脱脂奶粉配制二抗,摇床上室温孵育1h。取出PVDF膜,用1×TBST洗涤3次,每次5min。按1∶1的比例将ECL发光液中的A液和B液加入EP管,混匀。每条膜上滴加20μL显影液,避光显影。
1.3.8 体内抗肿瘤研究及初步安全性评价 每只裸鼠建A2780T卵巢癌耐药肿瘤模型。待肿瘤长至100mm3左右,将荷瘤鼠随机分为TKH-03组(20mg/kg TKH-03)、紫杉醇组(20mg/kg紫杉醇)、联用组(20mg/kg TKH-03+20mg/kg紫杉醇)、对照组(等体积生理盐水)。分别于第1、4、7、10、13、16、19d各给药1次。在最后一次药物使用3d后,摘眼球取血,脱颈处死裸鼠,取出肿瘤测量并称重,Ki-67染色。眼球取血于37℃静置30min,4℃ 5000r/min离心10min,取上清,Roche Cobas c 311全自动生化分析仪检测ALT(谷丙转氨酶)、AST(谷草转氨酶)、BUN(尿素氮)和CRE(肌酐)。
1.3.9 分子对接机制探讨 准备分子对接所需的配体和蛋白质,对目标蛋白及其晶体结构进行预处理,去除水分子、加氢、修饰氨基酸、优化能量和调整力场参数,利用AutoDock软件进行分子对接。采用AutoDock对两者进行对接模拟分析。
2 结 果
2.1 CCK-8法检测紫杉醇对细胞增殖能力的影响及耐药倍数 紫杉醇对A2780和A2780T细胞的IC50分别为(0.0463±0.0057)μmol/L和(9.1027±0.7244)μmol/L,差异有统计学意义(P<0.05)。与A2780敏感细胞相比,A2780T耐药细胞对紫杉醇显著耐药,耐药倍数为197。
2.2 细胞毒性实验筛选TKH-03无毒浓度 TKH-03在0.02~0.64μmol/L浓度范围内可抑制A2780细胞的体外增殖,增殖抑制率随着TKH-03浓度增加上升(图1)。0.02μmol/L TKH-03对A2780细胞无明显细胞毒作用,其增殖抑制率为(5.28±1.14)%,故选择0.005、0.01、0.02μmol/L TKH-03作为后续用药浓度。TKH-03在0.1~20μmol/L浓度范围内呈浓度依耐性抑制A2780T细胞的体外增殖,0.2μmol/L TKH-03对A2780T细胞的增殖抑制率为(7.97±1.36)%,该浓度作用下的细胞增殖抑制率低于10%。故选择0.05、0.1、0.2μmol/L的TKH-03作为后续联合用药的浓度。

图1 TKH-03作用后A2780和A2780T细胞的增殖抑制曲线
2.3 逆转耐药倍数 TKH-03可浓度依赖性地降低紫杉醇对卵巢癌耐药细胞A2780T的IC50,对卵巢癌亲本细胞A2780的IC50无明显影响。紫杉醇与无毒浓度TKH-03及维拉帕米联用时,紫杉醇对A2780细胞的IC50较未联用TKH-03组分别下降了1.01倍、1.06倍、1.13倍和1.05倍,差异无统计学意义(P>0.05)。紫杉醇与0.05、0.1、0.2μmol/L TKH-03联用时,紫杉醇对A2780T细胞的耐药逆转倍数分别为2.84倍、4.33倍和10.16倍,差异有统计学意义(P<0.05)。0.2μmol/L TKH-03的逆转耐药作用强于耐药逆转剂维拉帕米。表明TKH-03可逆转紫杉醇对耐药细胞A2780T产生的耐药性,但不影响敏感细胞A2780的IC50。见表1。
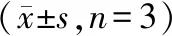
表1 TKH-03逆转A2780T细胞对紫杉醇的耐药作用
2.4 TKH-03联合紫杉醇对A2780T细胞凋亡、周期分布、细胞克隆形成的影响 平板克隆实验结果显示,A2780T细胞接种14d时可见明显细胞集落。联合用药低剂量组与单用1μmol/L 紫杉醇相比,A2780T细胞的凋亡率上升,细胞克隆形成率下降,差异有统计学意义(P<0.05);联合用药中剂量和高剂量组与单用1μmol/L紫杉醇相比,A2780T细胞的凋亡率显著上升,细胞的克隆形成率显著降低,差异有显著统计学意义(P<0.01)。表明TKH-03与紫杉醇联用细胞凋亡率显著增高,体外增殖能力降低。与紫杉醇组相比,联合用药低、中、高剂量组G2/M期占比显著升高,差异有统计学意义(P<0.05)。表明TKH-03可增强A2780T细胞中紫杉醇诱导的G2/M期阻滞。见表2。
表2 不同药物处理后A2780T细胞的凋亡率、周期分布、细胞克隆形成情况
2.5 A2780和A2780T中ABCB1蛋白表达 Western blot结果显示,A2780T中ABCB1蛋白表达量约是A2780细胞的10倍,差异有统计学意义(P<0.05)。见图2。
图2 A2780和A2780T中ABCB1蛋白表达
2.6 体内抗肿瘤研究及初步安全性评价 联合用药组的肿瘤质量明显低于其他3组,差异有统计学意义(P<0.05)。与紫杉醇单药治疗组相比,TKH-03联合紫杉醇治疗明显抑制了肿瘤组织的生长,紫杉醇对肿瘤组织的抑瘤率从16.25%提高到46.52%(P<0.05)。见表3。TKH-03和紫杉醇联用组肿瘤体积在给药后第5d开始增长缓慢,增长速度明显低于对照组、TKH-03组和紫杉醇组,差异有统计学意义(P<0.05)。见图3。

表3 TKH-03联合紫杉醇对裸鼠肿瘤生长的影响
2.7 肿瘤组织细胞凋亡情况 对照组、TKH-03组和PTX组中Ki-67阳性率依次递减。与对照组和单独给药组相比,TKH-03联合紫杉醇用药后,肿瘤组织Ki-67阳性细胞数量明显减少。提示TKH-03能显著增强紫杉醇介导的肿瘤组织细胞凋亡。见图4。

图4 肿瘤组织细胞凋亡情况(200×)
2.8 TKH-03与紫杉醇及联合用药对荷瘤鼠肝、肾功能的影响 各组荷瘤鼠肝、肾功能相关生化指标值均在正常范围内,联合用药组与对照组及单独用药组相比,差异无统计学意义(P>0.05)。见图5。

图5 TKH-03与紫杉醇及联合用药对荷瘤鼠肝、肾功能的影响
2.9 分子对接机制 TKH-03与ABCB1通过氢键和疏水作用紧密结合。TKH-03的烃基与ABCB1的Tyr1044形成氢键,TKH-03的喹啉基与ABCB1的Gln1118形成氢键。这两个氢键为TKH-03与ABCB1的结合提供了基本的作用力。疏水作用在促进TKH-03与ABCB1结合方面也发挥了重要作用。维拉帕米的醚基与ABCB1的Thr1078、Tyr1044形成氢键。此外,维拉帕米还能与ABCB1的其他残基相互作用。TKH-03与ABCB1蛋白的对接分数为-10.7kcal/mol,维拉帕米与ABCB1蛋白的对接分数为-7.2kcal/mol。与ABCB1底物维拉帕米相比,TKH-03与ABCB1的对接分数更低,表明TKH-03与ABCB1结合更稳定。见图6。
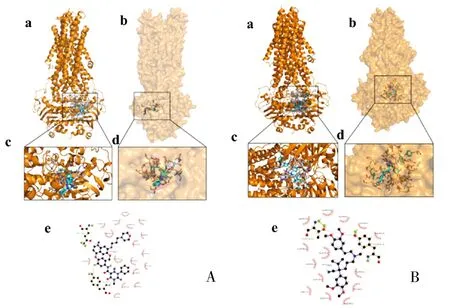
图6 TKH-03、维拉帕米与ABCB1的相互作用
3 讨 论
临床治疗中,化疗药物耐药是化疗失败和肿瘤复发的主要原因之一[4-5]。许多酪氨酸激酶抑制剂对ABCB1转运蛋白的活性表现出抑制作用,从而有望逆转多药耐药。这些抑制剂,如达沙替尼、尼洛替尼、伊马替尼、拉帕替尼和波齐替尼等,要么得到临床批准,要么正在进行临床试验[6-7]。因此,发现新型ABCB1抑制剂对逆转肿瘤细胞多药耐药具有重要意义。TKH-03是一种具有EGFR酪氨酸激酶抑制活性的化合物。本研究结果显示,TKH-03增强了紫杉醇对A2780T克隆形成的抑制作用,TKH-03与紫杉醇联合可协同增加A2780T的凋亡细胞百分比,增强了A2780T细胞对紫杉醇的敏感性,抑制了A2780T细胞增殖,表明TKH-03联合紫杉醇能明显的抑制肿瘤的生长。与对照组和单独给药组相比,TKH-03联合紫杉醇用药后,肿瘤组织Ki-67阳性细胞数量明显减少,表明细胞大量凋亡,进一步证实TKH-03能增强紫杉醇介导的肿瘤组织细胞凋亡,并存在病理学上的显著差异。分子对接结果显示,TKH-03与ABCB1通过氢键和疏水作用紧密结合。与ABCB1底物维拉帕米相比,TKH-03与ABCB1的结合更加稳定。TKH-03是一种新合成酪氨酸激酶抑制剂,本身具有抗肿瘤活性。本研究只探讨了TKH-03在无毒浓度下,作为一种ABCB1抑制剂发挥其逆转耐药的功效,可进一步探讨TKH-03在细胞毒性浓度下对耐药肿瘤细胞的影响,为TKH-03的临床应用提供理论依据。
综上所述,TKH-03在体内外均能逆转耐药细胞对化疗药物的耐药性。推测TKH-03可通过与ABCB1结合从而逆转A2780T细胞的紫杉醇耐药性,为进一步研究其机制提供了方向与思路,也为临床上逆转耐药剂的发展提供了新的研究方向。

