海南农田不同质地砖红壤及其细菌群落与番茄青枯病发生的关联分析
李海鹏,黄月华,孙晓东,曹启民,符芳兴,孙楚涵
1. 海南省农业科学院农业环境与土壤研究所,海南 海口 571100;2. 临湘市农业农村局生态能源服务中心,湖南 岳阳 414300;3. 海南大学生态与环境学院,海南 海口 570228;4. 海南省农林环境过程与生态调控重点实验室,海南 海口 570228;5. 海南省农业科学院蔬菜研究所,海南 海口 571100
由青枯菌(Ralstonia solanacearum)造成的青枯病(Bacterial wilt)对全球超过50 科、200 种植物造成非常严重的危害(Mamphogoro et al.,2020)。2020 年,中国大陆地区番茄(Solanum lycopersicum)总产值超过360 亿美元(FAOSTAT,2020),南方省份是番茄青枯病的高发地区(Chen et al.,2020)。青枯病破坏土壤生态环境,酸碱度(Fan et al.,2021)、营养元素(Nakahara et al.,2021)与微生物多样性(Gao et al.,2019)等在内的土壤化学生物因子均与青枯菌关联紧密。土壤中碳氮比(C/N)与青枯病发病植株的病情指数呈负相关关系(范围:C/N<22)(Cao et al.,2022),而土壤中可利用碳和氮的增加能促进磷酸酶活性提高,土壤有效磷含量因此得以提升(Mndzebele et al.,2020)。微生物在土壤生态系统也起到“举重若轻”的作用,例如多噬伯克霍尔德氏菌(Burkholderia multivorans)能将土壤磷酸盐转化为有效磷(Liu et al.,2020),土壤pH 升高时,青枯病发病率下降的同时,地杆菌属(Terrabacter)降解土壤有机物效率升高(Chen et al.,2022),芽孢杆菌属(Bacillus)和Candidatus_Solibacter属等土壤有益微生物相对丰度显著提升(Chen et al.,2020;Conradie et al.,2020),间接抑制了土壤中青枯菌在植物中的定殖,巩固了土壤养分循环过程。目前科研工作者已经从多维度去研究了番茄青枯病发生与土壤环境的关系,并提出青枯病防治措施(Xue et al.,2020),但青枯病仍对当今农业生产构成持续性困扰(Zheng et al.,2019)。海南处于青枯病频发的热带地区,砖红壤是海南省占地面积最大的土壤类型(梁捷,2020),海南青枯病发生对不同质地土壤理化性质和细菌群落的影响还鲜有研究。本研究通过对比分析番茄植株遭受青枯菌侵染后其土壤理化性质、细菌群落(属水平)的差异,揭示土壤中与青枯病发生密切相关的生物及非生物因子,以期为治理掣肘现代农业发展的土传病害难题提供理论依据。
1 材料与方法
1.1 研究地区概况
本研究土壤类型均为砖红壤,分别是位于海南省文昌市文城镇的砂土试验地、儋州市大成镇壤土试验地与澄迈县永发镇黏土试验地,3 处试验地纬度相近,在种植番茄前均无前作,选定的种植区域无其它植被覆盖。试验期间,平均气温、降水量等背景值见表1。
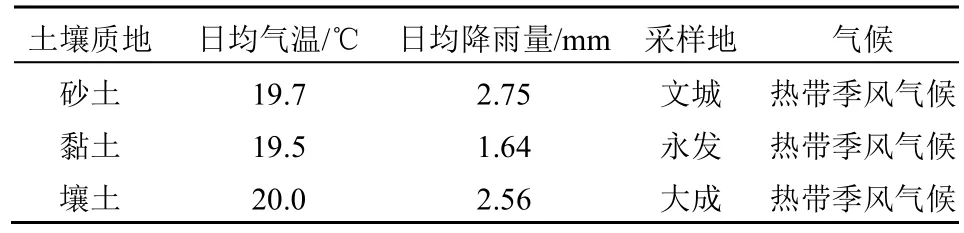
表1 试验期间田地环境概况Table1 The survey results of field environment during the experiment
1.2 试验设计和采样
用长至4-5 片真叶的番茄苗(品种:AilsaCraig LA2838A)进行移栽(10 月下旬),行株距100cm×50 cm,60d 后,经观察,各质地土壤番茄植株均为健康生长状态(12 月下旬),分别将3 种质地土壤的番茄种植区域各划分为6 个小区,空白对照组(CK)与接种青枯菌处理组各3 个小区,对照组与处理组试验区分隔道路两旁(相距50 m)以防止对照组区域病原菌侵染。用伤根接种法(曾文青,2021)将含1.00×106CFU·mL−1青枯菌的LB 培养液以每株100 mL 施加量接种至处理组区域番茄植株土壤根系的3 个小区,同时将另外3 个小区用相同方法接种等量无菌LB 培养液作为对照。30 d 后,在各质地土壤处理组区域植株出现不同程度枯萎症状(1月下旬),进行采样工作并统计发病率、计算病情指数(表2)。从番茄植株移栽至采样期间,施用普通固体复合肥(N:P:K=1:1:1),各处理浇水量和次数相同,试验期间不进行细菌病害处理。
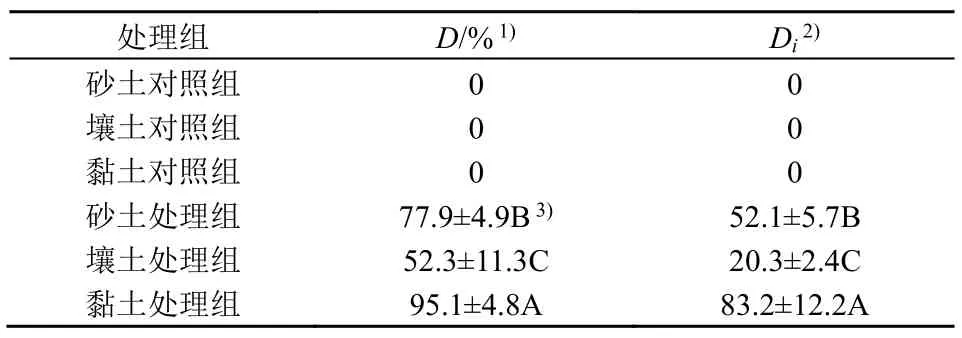
表2 各质地土壤番茄植株发病率及病情指数Table 2 Disease incidence and disease severity index of three different textural soil
采用五点采样法采样,每个点位选取生长状态相同的植株(3 株)进行采样,除去土壤表面杂质,采用环刀取测定土壤孔隙度的样品,其余指标所需土样灭菌用抖根法(Zhang et al.,2017)采集,采样工具均经过灭菌处理。然后将5 个点位的样品混匀为1 个样品。测定理化性质的样品在室温下风干后过20 目筛(孔径0.85 mm)待测,测定土壤微生物多样性指标的样品放于−80℃超低温冰箱冻存。
1.3 土壤样品处理
根据《LY/T1215—1999 森林土壤水分-物理性质的测定》标准测定土壤孔隙度(Soil porosity,SP),参照《土壤农化分析》测定土壤样品理化性质,包括pH、有效氮(availablenitrogen,AN)、有效钾(availablepotassium,AK)、有效磷(available phosphorus,AP)与有机质(organicmatter,OM);土壤微生物多样性样品经NucleoSpin96Soil 试剂盒提取DNA后,用细菌DNA引物338F/806R(Wang et al.,2017)对相关目标序列进行PCR 扩增,然后采用纯化且均一化后的产物构建测序文库,经过FLASH、UCHIME 等软件(Edgar et al.,2011;Bolger et al.,2014)预处理,质检合格的文库通过Illumina Nova PE 250 平台进行测序(具体测序以及序列比对工作由北京百迈客生物科技有限公司承接)。
1.4 数据处理与分析
本试验番茄植株青枯病病情共分为4 级(级别越高,病情越重),统计分级采用Roberts et al.(1988)的病情分级标准,番茄植株发病率与病情指数计算公式如下:
式中:
D——发病率(%);
n——发病番茄植株数;
N——统计番茄总株数;
Di——病情指数;
Xi——病情等级;
Ni——该病情等级发病植株数;
Xmax——试验地最高病情等级。
文中各指标测定结果数据的比较采用SPSS 26.0 软件进行单因素方差分析(one-way ANOVA)和“独立样本t检验”分析(ttests),所有测定数据均采用“平均值±标准差”表示,分别采用Spearman 相关性分析与主坐标分析(Principal coordinate analysis,PCoA)探究各环境因子与番茄青枯病发病率、土壤微生物多样性的关系,图像使用GraphpadPrism9.0 软件与“https://www.chiplot.online/”网址绘制、配色。
2 结果与分析
2.1 发病情况统计
调查结果显示,对照组的砂土、壤土、黏土的番茄植株D、Di都为0,处理组的壤土、砂土、黏土番茄植株D分别为52.3%、77.9%和95.1%,Di分别为20.3、52.1 和83.2,且三者差异显著(P<0.01)。
2.2 土壤理化性质分析
表3 显示,结果显示,对照组中,黏土的pH值、OM、AK 含量和SP 高于砂土和壤土;砂土的AP 含量高于壤土和黏土,OM、AN、AK 含量与SP 则低于壤土和黏土,壤土和黏土的AP、OM、AN 和SP 砂土的相同指标差异显著(P<0.01),AK 含量在3 种植地土壤间差异显著(P<0.01),壤土的pH 值最低,AN 含量最高,3 种质地土壤pH 值差异显著(P<0.01)。接种青枯菌的处理组中,黏土的AP 含量低于砂土和壤土;砂土的OM、AN、AK 含量与SP 低于黏土和壤土,砂土的AP、OM 含量分别与壤土和黏土差异显著(P<0.01);砂土和黏土的AN 含量差异显著(P<0.05),壤土的pH 值低于黏土和砂土,黏土的OM、AN、AK含量和SP 比砂土和壤土高;3 种质地土壤pH 值和AK 含量差异显著(P<0.01),而SP 在3 种质地土壤中互相差异不显著(P>0.05)。各质地土壤处理组的OM、AP 含量与SP 均低于对照组;壤土和黏土处理组的AK 含量分别高于各自对照组,砂土和黏土AN 含量均高于各自对照组。砂土、壤土对照组与处理组间pH 值差异显著(P<0.01);对照组黏土的AK 含量及SP 与处理组差异显著(P<0.05)。

表3 3 种质地土壤理化性质比较Table 3 Comparison of physicochemical properties among three different textural soil
2.3 土壤细菌多样性分析
3 种质地土壤处理组细菌的Shannon 和Chao1指数均低于相应对照组(表4),其中砂土与壤土处理组细菌Shannon 和Chao1 指数分别与对照组差异显著(砂土:P<0.01,壤土:P<0.05),黏土细菌Shannon 指数在对照组与处理组无显著差异(P>0.05);对照组中,黏土细菌Shannon 指数高于砂土与壤土,且与壤土Shannon 指数差异显著(P<0.01)。处理组中,黏土细菌Shannon 与Chao1指数均显著高于砂土(P<0.01)。
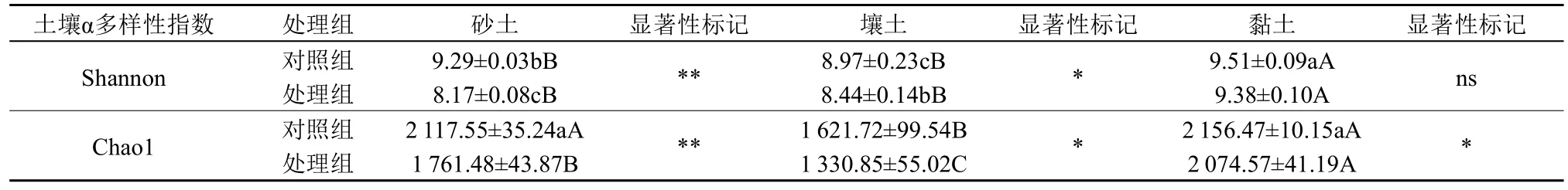
表4 3 种质地土壤细菌α多样性指数比较Table 4 Comparison of the α microbial diversity among three different textural soil
图1 结果表明,3 种质地土壤对照组中,壤土苔藓杆菌属(Bryobacter)、中华单胞菌属(Sinomonas)相对丰度分别为3.24%和3.80%,均高于砂土与黏土,unclassified_Micrococcaceae属相对丰度低于1.00%;处理组中,黏土的鞘氨醇杆菌属(Sphingomonas)相对丰度分别比壤土和砂土高36.4%,13.8%,其中unclassified _Gemmatimonadaceae属相对丰度(2.96%)是壤土的5.19 倍。各处理组中unclassified_Bacteria、 unclassified_Gemmatimonadaceae属相对丰度均低于对照组,砂土处理组鞘氨醇杆菌属、Burkholderia_Caballeronia_Paraburkholderia属与unclassified_Acidobacteriales属相对丰度高于对照组,壤土处理组中除马赛菌属(Massilia)外其余细菌属相对丰度均低于对照组,其中壤土处理组中unclassified_Acidobacteriales属比对照组低71.2%。所有对照组与处理组中鞘氨醇杆菌属的相对丰度占比均超过4.00%;3 种质地土壤的处理组的中华单胞菌属和unclassified_Micrococcaceae属相对丰度为黏土>砂土>壤土。
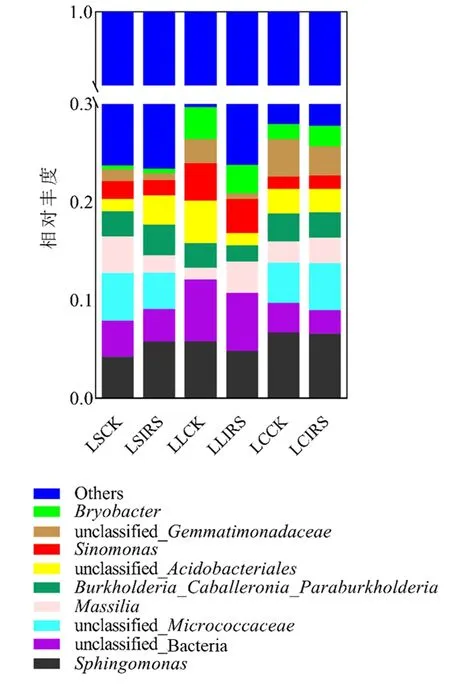
图1 青枯病发生后各质地土壤细菌群落在属水平相对丰度前10名的物种组成Figure 1 The soil bacterial communities in different textural soil were composed of the species with top 10 highest relative abundance at the genus level after occurence of bacterial wilt
由图2 可知,除土壤相对丰度较高的优势菌群外,3 种质地土壤部分细菌群落对照组、处理组间相对丰度差异较大(热图中颜色越深,物种相对丰度越高)。无论是对照组还是处理组,黏土中酸杆菌属(Acidibacter)相对丰度均低于砂土与壤土,而黏土中德沃斯氏菌属(Devosia)、中慢生根瘤菌属(Mesorhizobium)、硝化螺菌属(Nitrospira)、Haliangium属与慢生根瘤菌属(Bradyrhizobium)相对丰度均比砂土与壤土高;处理组中,壤土的德沃斯氏菌属、中慢生根瘤菌属与新草螺菌属(Noviherbaspirillum)相对丰度均低于砂土与黏土,而地杆菌属相对丰度则高于砂土和黏土。处理组中砂土仅芽孢杆菌属相对丰度高于壤土与黏土,与3种质地土壤对照组差异表现相同。壤土对照组与处理组间和黏土对照组与处理组间的德沃斯氏菌属(P<0.05)、硝化螺菌属(P<0.01)、慢生根瘤菌属(壤土:P<0.01;黏土:P<0.05)与Haliangium属(P<0.01)相对丰度差异显著。黏土处理组中德沃斯氏菌属(P<0.05)与Haliangium属(P<0.01)相对丰度显著高于黏土对照组,而硝化螺菌属、慢生根瘤菌属在对照组和处理组间差异表现与之相反。地杆菌属、类诺卡氏菌属(Nocardioides)、芽单胞菌属(Gemmatimonas)与Candidatus_Solibacter属相对丰度仅在壤土对照组与处理组间差异显著(P<0.01)。砂土与黏土处理组中青枯菌所在的雷尔氏菌属(Ralstonia)相对丰度分别显著高于各自对照组(P<0.01),壤土对照组与处理组间雷尔氏菌属相对丰度无显著差异,各质地土壤对照组与处理组中雷尔氏菌属相对丰度为:壤土<砂土<黏土。

图2 青枯病发生后各质地土壤对照与接种青枯菌处理组间差异显著细菌群落在属水平上相对丰度热图Figure 2 Heat map of the relative abundance of soil bacterial communities in different textural soil with the significant difference between the control and inoculation with Ralstonia solanacearum treatment at the genus level
2.4 青枯病与土壤环境因子的联系
番茄青枯病DI 与土壤理化性质、细菌α 多样性指数的Spearman 相关性分析,以及各质地土壤指标的主坐标分析(Principal coordinate analysis,PCoA)结果如图3 所示。3 种质地土壤DI 均与细菌Shannon 和Chao1 指数呈负相关,其中3 种质地土壤DI 与Chao1 指数呈显著负相关(P<0.05),砂土和壤土中DI 与pH 呈显著负相关(P<0.05),砂土和黏土中DI 与AN 呈正相关;黏土DI 与AK呈显著正相关(P<0.05),与SP 呈显著负相关(P<0.05),壤土DI 与OM 呈显著负相关(P<0.05)。图3d 为通过Bray-curtis 距离算法建立的土壤理化性质、细菌Shannon 与Chao1 指数的PCoA 结果,第一、二主坐标方差贡献率分别为61.3%和16.2%。由图可知,壤土对照组与处理组的理化性质及细菌α 多样性指数之间差异最小,砂土对照组与处理组、黏土对照组与处理组有一定距离。
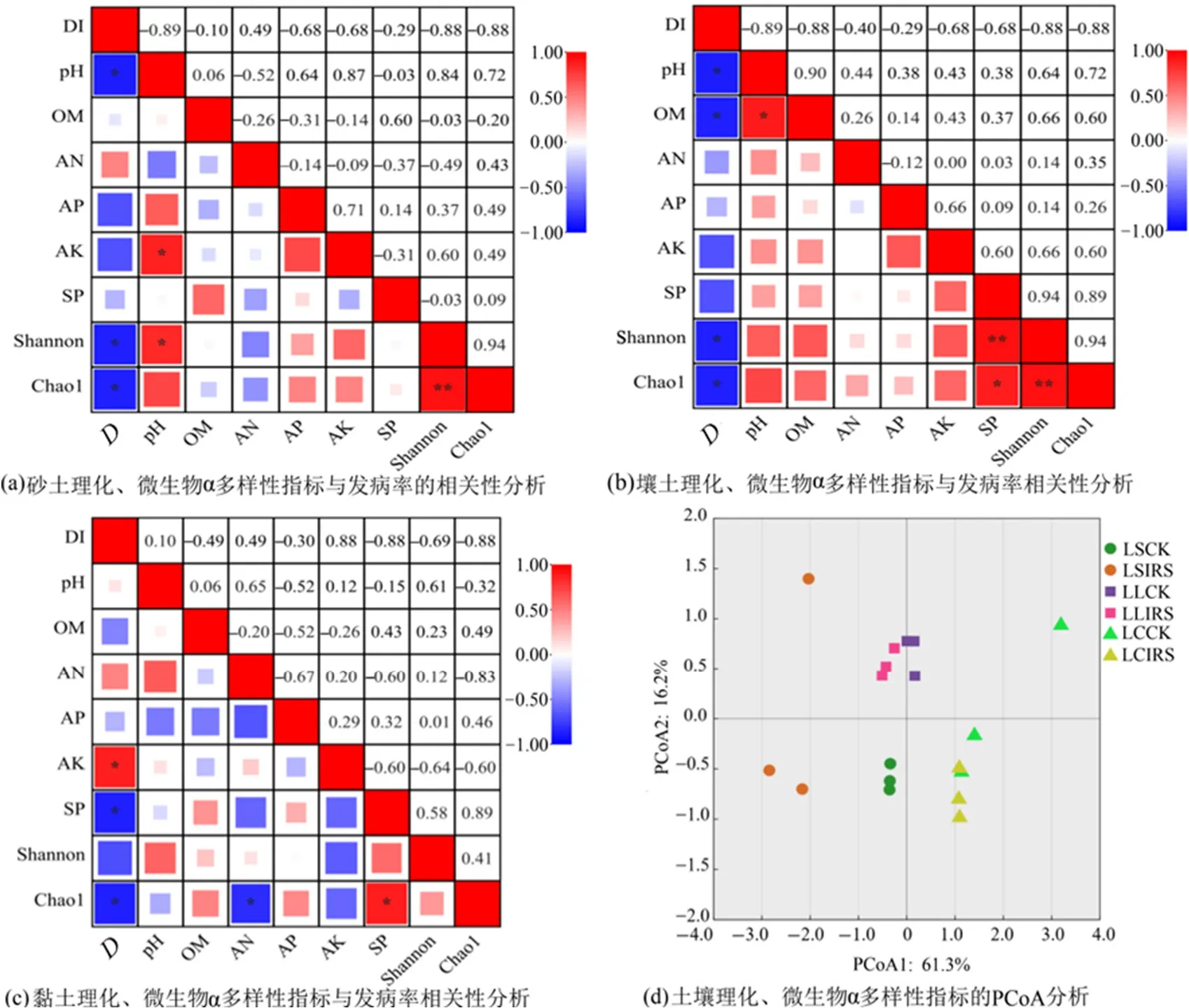
图3 不同质地土壤发病率与环境因子的相关分析以及各处理组理化、微生物α多样性指标的PCoA分析Figure 3 Correlation analysis of different textural soils’ disease incidence and soil environmental factors and the PCoA analysis of each treatments’ physicochemical and microbial α diversity indicators
3 讨论
3 种质地土壤中,黏土的pH 值更适宜青枯菌繁殖。pH 值为6.5 的弱酸性环境最适宜青枯菌生存(王贻鸿等,2018),砂土与壤土的土壤酸化加剧了青枯病的传播(Tafesse et al.,2021)。相较于砂土、壤土,黏土处理组的pH 最接近6.5,这可能是Spearman相关性结果中黏土pH 与D成正相关,且黏土对照组与处理组间pH 差异不显著的原因。由于壤土的pH低于5.0,导致青枯菌所在的雷尔氏菌属相对丰度远低于砂土和黏土。而砂土和黏土恶化的土壤环境反而促进了有益菌酸杆菌属的增殖(Lin et al.,2019)。
土壤OM 对维持土壤生态系统的平衡至关重要,3 种质地土壤处理组的OM 均低于对照组,Spearman相关性分析结果中OM 与D也呈负相关,说明OM含量较低的土壤中植物土传病害发生概率更高(Li et al.,2022)。处理组中黏土中具有分解有机物功能的德沃斯氏菌属和unclassified_Gemmatimonadaceae属相对丰度最高(Zhu et al.,2019;Talwar et al.,2020)。对比对照组与处理组,壤土优势菌群中同样扮演“分解者”角色的苔藓杆菌属相对丰度并未受到青枯病的影响(Yang et al.,2022),这可能是青枯病发病率最高的黏土的OM 含量仍高于砂土和壤土并且壤土OM 含量高于砂土的原因。3 种质地土壤的对照组与处理组间OM 含量差异不显著,可能是主要固碳微生物鞘氨醇杆菌属与unclassified_Micrococcaceae属相对丰度未受到青枯病传播的影响(Li et al.,2021;Wang et al.,2022)。
可提取的OM含量可作为评价土壤供氮能力的指标。研究表明土壤高OM 含量可提升氮供应能力(Ros,2012),这解释了壤土和黏土的AN 含量高于砂土的现象;而土壤氮素水平过高反而会促进青枯病的爆发,病原菌相对丰度也将因此升高(Wang et al.,2019)。正因如此,Spearman 相关性分析结果中黏土的OM 与壤土的DI 均与AN 呈负相关。相关固氮微生物包括黏土处理组的慢生根瘤菌属、硝化螺菌属和中慢生根瘤菌属相对丰度及壤土处理组中地杆菌属相对丰度均高于砂土处理组(Barbosa et al.,2021;Wang et al.,2021;Xue et al.,2022;肖健等,2022),这解释了壤土与黏土处理组中AN 含量高于砂土处理组的原因。马赛菌属中潜在硝化功能菌群相对丰度(如M.violaceinigra、M.mucilaginosa等)一定程度上促进了砂土处理组氮素水平的上升(Holochova et al.,2020)。值得一提的是,无论是对照组还是处理组,砂土中具备产脲酶功能的芽孢杆菌属相对丰度均高于壤土和黏土,这可能是砂土处理组的DI 低于黏土处理组的潜在原因(Fan et al.,2020)。
磷是番茄生长必需元素,直接影响番茄的生长状态和产量。本研究结果中,3 种质地土壤处理组AP 含量低于各自对照组,而Spearman 相关性分析结果表明,3 种质地土壤DI 与AP 均呈负相关;黏土的AP 含量远低于砂土和壤土,根据Cao et al.(2022)的研究,土壤氮磷比(N/P)<5 正是壤土与黏土的AP 与DI 相关性低的原因,土壤中马赛菌属与中华单胞菌属均具有磷增溶功能(Zheng et al.,2017;Tchakounte et al.,2018),且在各处理组中均为优势菌属,所以3 种质地土壤处理组中AP 含量相较于各自对照组并无显著差异;黏土较低的中华单胞菌属相对丰度可能是黏土AP 含量低于壤土和砂土的潜在原因。
植物从土壤吸收的钾元素有助于作物“抵御”青枯菌入侵(Su et al.,2022)。3 种质地土壤中仅黏土呈现处理组AK 含量高于对照组的现象,原因可能是青枯病发生后,黏土因含氮量过高,包括Haliangium属在内的反硝化菌将大量NO3−转化为的NH4+难以被番茄植株摄入(高升升,2020;Yin et al.,2022),番茄根系中一定浓度的NH4+对K+跨细胞膜运输有单方向拮抗作用(孙小茗,2006),土壤AK 无法被番茄植株充分吸收,导致黏土处理组中AK 含量高于对照组。
Spearman 相关性分析结果表明,3 种质地土壤SP 与DI 均为负相关,黏土较高的SP 是其各理化指标高于砂土和壤土的前提。黏土处理组的SP 低于对照组,间接导致黏土处理组土壤环境愈加恶劣,加剧了青枯病的传播(Mi et al.,2021)。
青枯病发生后,3 种质地土壤处理组细菌多样性都低于对照组,DI 与细菌Shannon 和Chao1 指数呈负相关,这与Wang et al.(2017)的研究结果一致,但本研究中黏土处理组细菌Shannon 和Chao1 指数均高于砂土与壤土处理组,说明土壤微生物丰富度低可能并不是青枯病发生的充分条件。PCoA 结果中壤土对照组与处理组间相关指标差异较小,一定程度上说明在青枯病发生后,壤土环境的稳定性强于砂土和黏土。值得注意的是,雷尔氏菌属相对丰度与青枯病DI 紧密相关,3 种质地土壤处理组雷尔氏菌属相对丰度、DI 按大小次序排列均为壤土<砂土<黏土。青枯菌属于雷尔氏菌属,是革兰氏阴性菌,利用自身效应蛋白ripl刺激植物分泌γ-氨基丁酸从而迅速从土壤进入植物木质部定殖,所以青枯病发生时,土壤雷尔氏菌属相对丰度仍低于土壤原有优势菌群(Xian et al.,2020)。
本研究为海南青枯病防治对策提供了一定理论基础,未来可结合不同质地砖红壤特征与青枯菌进入土壤后的迁移方式作进一步探究。
4 结论
本研究根据青枯病发生后海南3 种质地土壤理化指标与微生物多样性的差异,得出以下结论:
(1)海南砖红壤番茄青枯病发病率表现为黏土>砂土>壤土,影响发病率的关键因素之一是pH 值。
(2)海南砖红壤番茄青枯病的发生会导致土壤有机质、有效磷的流失。
(3)海南砖红壤青枯病的发生会导致土壤微生物多样性降低,但青枯病的发生并未对鞘氨醇杆菌属、unclassified_Micrococcaceae属、中华单胞菌属和苔藓杆菌属的生长造成明显影响,甚至促进了酸杆菌属的增殖。

