不同试验条件对巴马拟缨鱼性激素水平的影响
古昌辉,许明珠,程光平,,程蔓,韦云勇,麻艳群*
(1.广西大学动物科学技术学院/广西高校水生生物健康养殖与营养调控重点实验室,广西 南宁 530004;2.广西海洋研究所有限责任公司,广西 北海 536000)
巴马拟缨鱼(Pseudocrossocheilus bamaensis),属鲤形目(Cyprinformes),鲤科(Cyp-rinidae),野鲮亚科(Labeoninae),拟缨鱼属(Pseudocrossocheilus)[1],因富含脂肪,又称巴马油鱼。主要分布于广西境内巴马县的盘阳河和红水河的都安江段,喜穴居,一般晨昏活动,冬季进洞穴越冬,于春末夏初洪水期繁殖,在自然水域多以固着藻类为食[2],体型小而肥,是广西土著小型经济特色鱼类[3]。研究表明[4],巴马拟缨鱼肌肉中蛋白含量高,肉质细嫩,营养丰富,脂肪含量适中,富含各类氨基酸及不饱和脂肪酸,具有较高的营养价值。
鱼类的生长与繁殖,需要消耗大量的营养物质。研究表明[5],高蛋白含量的日粮,有利于异育银鲫雌鱼卵细胞的发育。脂肪含量为14%的配合饲料,可以促进海湾扇贝(Argopecten irradians)的性腺发育[6]。在自然界中,河水的流速能够刺激鱼类产卵行为[7-8]。在人工养殖条件下,流水刺激,会加强四大家鱼亲鱼的性细胞质量[9-10]。此外,光照、产卵场所基质、盐度等外源因子,均会对性腺的发育造成不同的影响。现探讨不同试验条件对巴马拟缨鱼血液性激素水平的影响,以期为巴马拟缨鱼生理生态学、规模化人工繁殖研究,提供科学依据。
1 材料与方法
1.1 时间与地点
2020 年6 月,试验周期365 d。试验地位于广西大学水产养殖基地。
1.2 试验材料
选择4 口圆形水泥池(直径3.0 m,池高1.4 m,水深0.8 m),面积均为7.1 m2,进、排水及供气(气控)设施完善,养殖用水均为经曝气的自来水。试验鱼采自红水河广西都安河段的野生巴马拟缨鱼,于6 月2 日运回广西大学水产养殖基地,经消毒处理、暂养和驯食配合饲料后,随机分入试验池养殖,各池放养量均为150 尾。雄鱼初始平均体质量(88.20±4.03)g,初始平均体长(26.35±2.10)cm;雌鱼初始平均体质量(112.40±8.05)g,初始平均体长(29.83±2.28)cm。饲料为海大容川牌对虾2 号沉性饲料(粗蛋白质≥47.0%、粗灰分≤18.0%、0.8≤钙≤4.0%、水分≤10.0%、粗纤维≤3.5%、总磷≥1.2%、粗脂肪≥5.0%、赖氨酸≥2.8%)。
1.3 试验设计
设A、B、C 和D 4 个试验组(未设平行组)和E对照组。各组试验条件:A 组投喂“红虫+对虾2 号料”(9∶1);B 组采用“混合水流”(涌流+旋流),用充(氧)气管从池底堆积的卵石堆底端自下向上充气,产生涌流,用小型水泵(85 W)于池内抽水并沿圆形池壁切线方向“推水”产生旋流,流速0.15 m/s,投喂对虾2 号料;C 组采用“红光”光照,用600 nm LED灯作光源,光色为红光,光照强度2 000 lx,光∶暗=12L∶12D(12L 为07:00—19:00,12D 为19:00 至次日07:00),投喂对虾2 号料;D 组采用“粗沙+卵石底质”(底质厚10 cm,粗沙面积∶卵石面积=50%∶50%),投喂对虾2 号料;E 组为试催产当天,从红水河广西都安河段采获并运回试验基地野生巴马拟缨鱼。
各组均为自然水温(16~30 ℃)。A 组(红虫+对虾二号料)日投饲率为4%,B、C、D 组对虾2 号料日投饲率1.3%~1.5%,每日投饲1 次(20:00 前后)。每周换水1 次,每次换水量约为原池水量的1/3。养殖全程开启增氧机持续充气增氧,保持池水ρ(溶解氧)>5 mg/L。
2021 年6 月18 日(推测的繁殖季节),从A、B、C、D 各组随机抽取6 尾(3 雌和3 雄)共24 尾;从E组随机抽取3 雌和3 雄共6 尾,采血测定性激素含量。从各试验组随机抽取3 雌和3 雄亲鱼共24 尾,用相同的催产剂[1 kg 雌鱼催产剂型及剂量:促黄体素释放激素(LHRH-A3)10 μg+注射用多情素绒促性素(I)(HCG)2 500 IU+多潘立酮注射液(DOM)15 mg],雄鱼催产剂量为雌鱼的1/2。注射激素72 h后,分别采集各组催产亲鱼血样,先用含间氨基苯甲酸乙酯甲磺酸盐(MS-222),将待采血亲鱼麻醉8~10 min,然后采用尾椎取血法采血,室温放置1 h,于3 500 r/min 离心10 min,结束后吸取上清液保存。采用双抗体夹心法测定样本鱼血清性激素水平。具体操作方法参照南京建成试剂盒说明书。
1.4 检测指标
雌二醇(E2)雌三醇(E3)孕酮(P)雌酮(E1)睾酮(T)。
1.5 数据分析
采用Microsoft Excel 2016 处理试验数据后,于SPSS25.0 软件进行单因素方差分析(One-way ANOVA)和多重比较(LSD 法),并判断在0.05 水平上差异的显著性,P>0.05 为差异不显著,P<0.05 为差异显著。试验结果用“平均数±标准差”表示。
2 结果与分析
2.1 各组巴马拟缨鱼性激素水平
2.1.1 雌鱼性激素
各组巴马拟缨鱼雌鱼(催产前)性激素水平见表1。

表1 各组雌鱼催产前性激素水平①
E2:相较于E 组,C 组的E2含量提高了0.5%,A组最低,下降了51.7%。C 组E2含量最高,比A、B、D组分别提高51.9%、6.0%和5.2%。分析表明,C 组最利于雌鱼E2的合成,A 组可能会抑制E2的合成,其抑制机理还有待研究。
E3:与E 组比较,E3含量除D 组略为上升外,其余各组均显示降低,其中B 组最低,下降了35.7%;D 组E3比A 组、B 组和C 组 分 别提高35.7%、64.2%、和10.2%,表明D 组有利于雌鱼E3的合成。比较各组间的E3含量,D 组最高,B 组最低,但差异不显著(P>0.05)。
P:A 组P 最大,C 组最小,与E 组比较,A、B、C和D 组的P 含量分别提高了13.5%、13.1%、7.5%和11.5%;各组间P 含量比较,A 组最高,比B 组、C 组和D 组分别提高0.5%、5.6%和1.9%,组间差异不显著。表明A 组较利于雌鱼P 的合成。
E1:与E 组比较,B 组E1提高33.7%,其余组均呈降低趋势,其中A 组、C 组和D 组分别降低34.8%、7.0%和32.2%;各组间比较,在B 组E1最高,比A 组提高56.8%,差异显著(P<0.05),比C组、D 组和分别提高38.3%、55.0%,但差异不显著(P>0.05)。从E1含量的绝对值看,B 组较有利于雌鱼E1合成。
2.1.2 雄鱼性激素
各组巴马拟缨鱼雄鱼T 变化见表2。由表2 可见,各试验组T 含量较E 组均呈下降趋势,差异显著(P<0.05)。其中B 组最低,降幅达56.0%,D 组相对下降幅度较小,为45.4%。各组间,D 组T 含量最高,比A、B 和C 组分别提高21.3%、24.0%和5.4%。各试验组雄鱼T 含量远未达到E 组水平。总体上,D组较有利于促进T 的合成。

表2 各组雄鱼睾酮含量①
2.2 各组巴马拟缨鱼催产前后性激素变化
2.2.1 雌鱼催产前后性激素变化
各组巴马拟缨鱼雌鱼催产前后性激素变化见图1(a)(b)(c)(d),图中柱上无字母表示催产前后组间差异不显著(P>0.05),字母不同表示催产前后组间差异显著(P<0.05)。由图1 可见,催产后,A 组E2升高36.64%,催产前后差异显著(P<0.05),B、C、D 组分别下降3.3%、43.18%和12.08%,催产前后差异不显著(P>0.05);E3含量在A、B 组分别提高17.60%、44.48%,其中B 组催产前后差异显著(P<0.05),在C、D 组分别降低37.75%、8.38%,催产前后差异不显著(P>0.05);P 含量在A、B 组分别降低1.90%、6.80%,在C、D 组上升,分别上升6.25%、0.87%,催产前后差异不显著(P>0.05);E1含量在A、B 分别下降了12.88%、54.62%,中B 组催产前后差异显著(P<0.05),在C、D 组分别上升了48.62%、50.65%,催产前后差异显著(P<0.05)。分析表明,注射催产剂有助于提高B 组E3以及C、D 组E1含量。
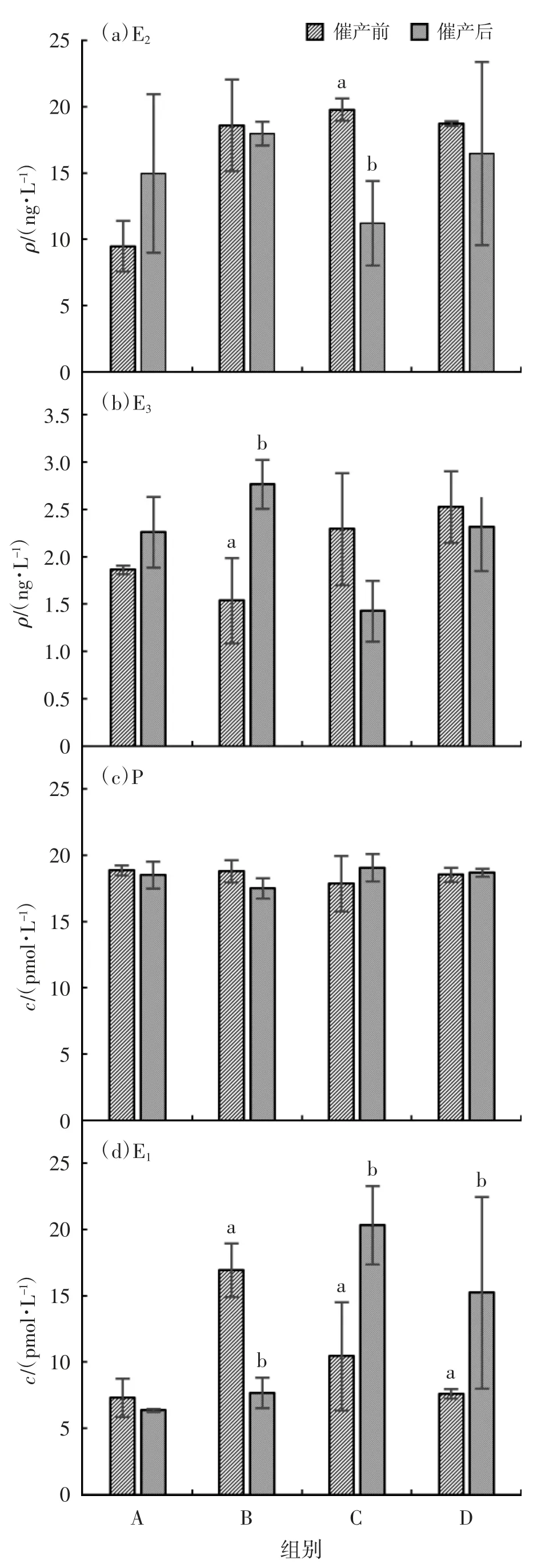
图1 各组巴马拟缨鱼雌鱼催产前后性激素含量变化
2.2.2 雄鱼催产前后T 含量变化
各组巴马拟缨鱼雄鱼催产前后T 含量变化见图2,图中柱上无字母表示催产前后组间差异不显著(P>0.05),字母不同表示催产前后组间差异显著(P<0.05)。由图2 可见,催产后,T 含量在A、B、C、D 分别下降了17.15%,17.39%,19.69%和35.73%,其中D 组催产前后差异显著(P<0.05)。分析表明,各组注射激素,均会抑制巴马拟缨鱼雄鱼T 的合成,D 组抑制作用更明显。
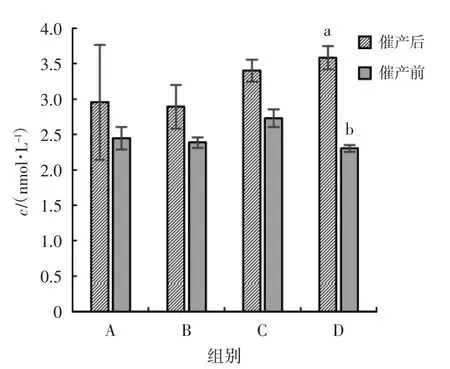
图2 各组巴马拟缨鱼雄鱼催产前后T 含量变化
2.3 人工催产对各组巴马拟缨鱼性激素水平的影响
2.3.1 雌鱼
各组巴马拟缨鱼雌鱼催产后激素变化见表3。由表3 可见,鱼催产后B 组E2含量最高,C 组最低,组间差异不显著(P>0.05);P 含量亦为C 组最高,B组最低,组间差异均不显著(P>0.05);E3含量在B 组最高,C 组最低,B 组和C 组间差异显著(P<0.05),其余组间差异不显著(P>0.05);E1含量在C 组最高,A 组最低,C、D 组与A、B 组差异显著(P<0.05)。分析表明,注射催产剂,有助于促进B 组培育条件下的E3以及C 组和D 组培育条件下E1的合成。

表3 各组雌鱼催产后性激素水平①
2.3.2 雄鱼
各组巴马拟缨鱼雄鱼注射催产剂后T 含量变化见表4。

表4 各组催产后雄鱼性激素水平
由表4 可见,催产后,A 组T 最高,D 组最低,但各组间无显著差异(P>0.05)。表明注射激素,在促进或抑制巴马拟缨鱼雄鱼T 合成方面,与各组的试验条件关系不大。
3 讨论
3.1 各组巴马拟缨鱼性激素水平
激素是由机体内分泌腺或内分泌细胞直接分泌到血液和淋巴中,对一定器官或组织产生兴奋或抑制作用,协调机体内部生理机能的特殊化学物质[11]。鱼类性类固醇激素(T、17β-E2等)是体内胆固醇的衍生物,对鱼体性腺发育、卵黄形成和卵细胞成熟具有重要的调控作用,因此性激素水平的改变,最终会影响到鱼类的繁殖功能[12]。颉志刚等[13]研究表明,摄食含有芳香化酶抑制剂来曲唑(letrozole, LZ)的试验饲料10 d 后,雌性光唇鱼的血浆E2水平显著下降,而雄性光唇鱼的血浆T 水平则无显著变化。本试验A 组雌鱼血清E2含量较E 组下降最多,表明红虫饲料当中可能含有某种物质抑制雌鱼的E2水平。
流水可以刺激鱼类侧线器官,通过中枢神经,诱使下丘脑合成和释放促性腺激素释放激素,进而引发脑垂体分泌促性腺激素,诱导亲鱼发情产卵[14]。宋波澜[15]研究表明,随着水流速的增加,红鳍银鲫的肌肉中的血红蛋白含量会显著提高。在本试验中,B 组雌鱼E1性激素水平较高,表明在混合水流刺激下,促进了巴马油鱼性激素的合成,对P和E1的促进效果较好。这可能是巴马拟缨鱼喜欢生活在水流湍急的水域,且对涌流敏感,B 组鱼在旋流和涌流混合水流作用下育,性激素水平提高。
仇登高[16]研究发现,不同的光照条件可以延缓或者加快大西洋鲑性腺的发育。狄正凯等[17]研究发现,延长光照周期,可以增加鱼类的摄食时间,提高摄食率,进而促进鱼类生长,但过长的光照时间,往往会导致鱼类的生长速度下降。本试验中,C 组P 含量在试验组中最低,E2含量最高,表明光照可能会刺激培育对象E2的合成,但同一光照周期又会抑制P 的合成。可能的原因为巴马拟缨鱼是洞穴习性生活的鱼类,对特定光照的敏感度较高。本试验设定的光照强度和周期变化,刺激了雌鱼,导致雌鱼特定性激素水平升高。底质类型对巴马拟缨鱼自然繁殖的成败尤为重要。张平梅等[18]研究表明,复杂的底质更有利于鲟的产卵行为。在本试验中,D 组的E3含量为试验组中最高,E2和P 水平也较高,可能是野生巴马拟缨鱼来自红水河流域,原生境中的底质复杂多变,而D 组底质环境比较接近野生环境,加上充足的饵料和安静的环境,有利于促进雌鱼性激素水平的提高。
3.2 各组巴马拟缨鱼催产前后性激素水平
利用外源激素处理,是促进养殖鱼类性腺成熟及产卵繁殖的重要方法。最常用的是利用促性腺激素释放激素的类似物(GnRHa),刺激脑垂体释放促性腺激素(GtH),诱导精巢性类固醇激素的生成和精子的排放[19-20]。鱼类卵巢发育受多种因素(温度[21]、人工配合饲料[22]、外源激素[23]等)的影响。相关研究表明[24],不同的外源激素,对卵巢作用不同,人工注射催产激素,能够促进半滑舌鳎卵巢更快地发育到下一个时期;但类雄激素可以抑制麦穗鱼卵巢发育,抑制程度随着浓度的变大而增加[25];绒毛膜促性腺激素(HCG)和鲤垂体(PT),对鳗鲡卵巢催熟效果较好,促黄体素释放激素(LHRH-A2)和丙酸睾丸素(TOP),则无明显效果[23];GnRH-a 可用于诱导大菱鲆多次产卵[26];多巴胺(DA)通过抑制促性腺激素(GtH)的分泌,从而阻断促性腺激素释放激素(GnRH)的作用[27]。
宋燕等[28]研究表明,在鱼类不同的生长时期,催产剂对于鱼体的性激素影响不同。邹忠义等[29]在对大鲵尿液性激素水平季节变化及其与繁殖的关系中发现,大鲵的E2含量需要达到一定的阈值后进行催产试验,才能刺激其产卵。本实验也是通过注射催产剂来研究性激素水平的变化,从而进一步研究人工养殖环境下,巴马拟缨鱼性腺的发育情况。蔡智鸣等[30]研究表明,鱼类的卵巢在Ⅳ期初时人工催产无效,只有发育到Ⅳ期中期,最好是Ⅳ期期末,催产才能成功。本试验在巴马拟缨鱼性腺尚未完全成熟的情况下进行试催产,以探索特定时期的巴马拟缨鱼性激素的变化。


