非洲猪瘟及其新型诊断检测技术研究进展
倪 超,魏 澍,冯寿华
(1. 沈阳农业大学动物科学与医学学院,辽宁 沈阳 110866;2. 辽宁省农业发展服务中心,辽宁 沈阳 110164)
非洲猪瘟(African Swine Fever,ASF) 是由非洲猪瘟病毒 (African Swine Fever Virus,ASFV) 引起的一种高致病性传染病。 根据毒力不同,ASFV 可以分为高致病性、中等毒力、低毒力以及感染无临床症状毒株,其中尤以高致病性ASFV 感染在临床上最为普遍[1],高致病性病毒感染的临床表现多为发热,食欲废绝,呼吸困难,肾、脾、淋巴结等器官的广泛性出血,急性感染可导致家猪死亡率近100%[2]。 世界动物卫生组织(OIE) 将ASFV列为法定报告的动物疫病之一,目前,ASF 尚无有效的商品化疫苗可以预防,也不存在有效的药物进行治疗,一经发现只能大规模扑杀,给生猪产业造成巨大的经济影响。 我国对ASF极为重视,并将ASF 列入优先防范的13 种重大外来动物疫病。
1 ASF 病原学
1.1 ASFV 基因组
ASFV 基因组由单分子线性、共价封闭的双链DNA 组成。 不同种类毒株的基因组长度在170 ~190 kbp,编码151 ~167 个ORF (开放阅读框)[3],基因组保守区长约125 kb,其左侧48 kb 与右侧22 kb 迥然不同,主要体现在中间区域,这也是直接导致不同非洲猪瘟病毒分离株基因长度出现差异的主要症结所在[4]。 ASFV 是一种大型的胞质内复制的病毒,200 nm 直径的ASFV 粒子呈二十面体对称,表现为同心圆状结构[5],病毒粒子由该基因组完成基因早期转录所需要的酶以及部分DNA 结合蛋白组成[6]。 ASFV 可以归类为核质大DNA病毒 (Nucleocytoplasmic Large DNA Viruses,NCLDV) 超家族成员之一。 属于非洲猪瘟病毒属,是该属中唯一成员[7],也是唯一的虫媒DNA 病毒。
ASFV 对高温、腐败和干燥具有极高的抵抗力[8]。 但也有研究表明,ASFV 在60 ℃时仅15 min 就无法检验到病毒粒子[9],使用脂溶剂及部分对苯基苯酚消毒剂灭活病毒效果较好。
1.2 ASFV 主要蛋白
有研究者发现,ASFV 所编码的蛋白中存在多种病毒蛋白能够诱导感染猪只产生免疫应答(五十几种蛋白)[10,11]。 有学者利用非洲猪瘟病毒编码的蛋白质进行蛋白质组学分析,鉴定出的68 种蛋白质,占ASFV 基因组编码能力的39%,其中大部分是病毒的结构蛋白且至少有54 个[12,13]。 ASFV 的主要致病结构就是衣壳和囊膜,衣壳蛋白主要包括p72 (B646L)和p49 (p B438L);p12 (O61R)、CD2v、p54( E183L )、p22 ( KR177R )、EP248R、PEP402R、EP199L 和p17 (D117L) 是主要的囊膜蛋白。 目前报道较多主要的结构蛋白p30、p54、p72 等,而研究较少的 pDP71L、pA238L、pE296R 等则属于典型的非结构蛋白。p72 与p17 是衣壳、内膜蛋白的代表蛋白[14]。
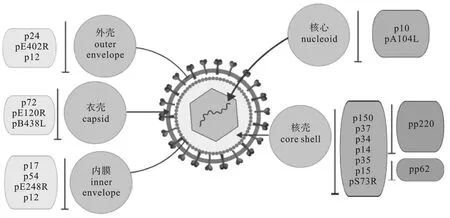
图1 ASFV 的结构和蛋白质组成
ASFV p72 蛋白,它是ASFV 最具代表性、研究最多、最具免疫原性的衣壳蛋白之一,由B646L 基因编码[15]。 B646L 基因可用于毒株分型与追溯毒株来源,研究病毒的同源与进化,p72 蛋白通常在病毒复制周期的后期表达[16]。已有实验表明,重组的p72 载体免疫原性与反应原性较好。 可以作为潜在的候选疫苗[17]。
ASFV P17 蛋白是一种病毒内囊膜上的晚期膜蛋白,由ASFV D117L 基因编码,分子量为13.1 kDa 左右[18]。 对于ASFV 的活力而言,p17 非常重要,并且对于病毒前体膜形成二十面体的过程非常关键[19]。 研究表明,p17 表达被抑制,会造成病毒编码的pp62 和pp220 水解加工受阻,导致其不能被正常切割而无法成熟,影响其到类核核芯壳的组装,并最终导致病毒的二十面体颗粒出现缺陷[20]。
CD2v 蛋白,一种类似于CD2 的蛋白,具有病毒黏附作用 (T 淋巴细胞表面黏附受体)[21],该蛋白由ASFV EP402R 基因编码。由ASFV ORF E183L 基因编码的p54 蛋白是病毒主要的结构蛋白,具有良好的抗原性,病毒粒子攻入动物机体后会刺激针对该蛋白的抗体形成,具有一定的保护作用,也有报道称该蛋白与细胞的凋亡有关[22,23]。
CP204L 基因编码的ASFV p30 蛋白,是一种磷酸蛋白。 p30 蛋白的主要功能是改变异质核糖核酸蛋白K (hnRNP -K) 在亚细胞层面的分布,并可能参与ASFV 感染过程中与mRNA 加工和输出相关的hnRNP - K 功能的调控[24]。 据UnitPro 数据库数据显示,p30 蛋白在ASFV 不同的分离株中表现出不同的蛋白大小。 ASFV p30 蛋白通常在病毒感染早期大量表达,亚细胞定位于宿主细胞的核与质。 并且存在有翻译后修饰现象,通常在第115 个N 端氨基酸的丝氨酸残基上进行磷酸化[25]。
2 ASFV 流行病学
ASF 疫情首次报道于1921 年的非洲肯尼亚地区,2018 年该病毒开始在我国大范围暴发[26,27]。 ASF 已经蔓延了几十年。 自2018 年以来,已有包括我国在内的14 个国家报告了3 797 例非洲猪瘟病例,其余13 个国家分别为波兰、俄罗斯、拉脱维亚、捷克共和国、罗马尼亚、摩尔多瓦、乌克兰、匈牙利、保加利亚、比利时、南非、科特迪瓦和赞比亚[28]。中国于2018 年在辽宁省出现首例ASF 后[29],ASF 疫情就在我国多地蔓延并暴发,截至目前,全国已发生ASF 疫情200 余起,商品化疫苗的匮乏加之防治措施的不完善使得我国对于ASF 疫情的防控纳履踵决,短期内病毒将难以彻底根除,ASF 疫情依然是当前生猪养殖业面临的主要风险。
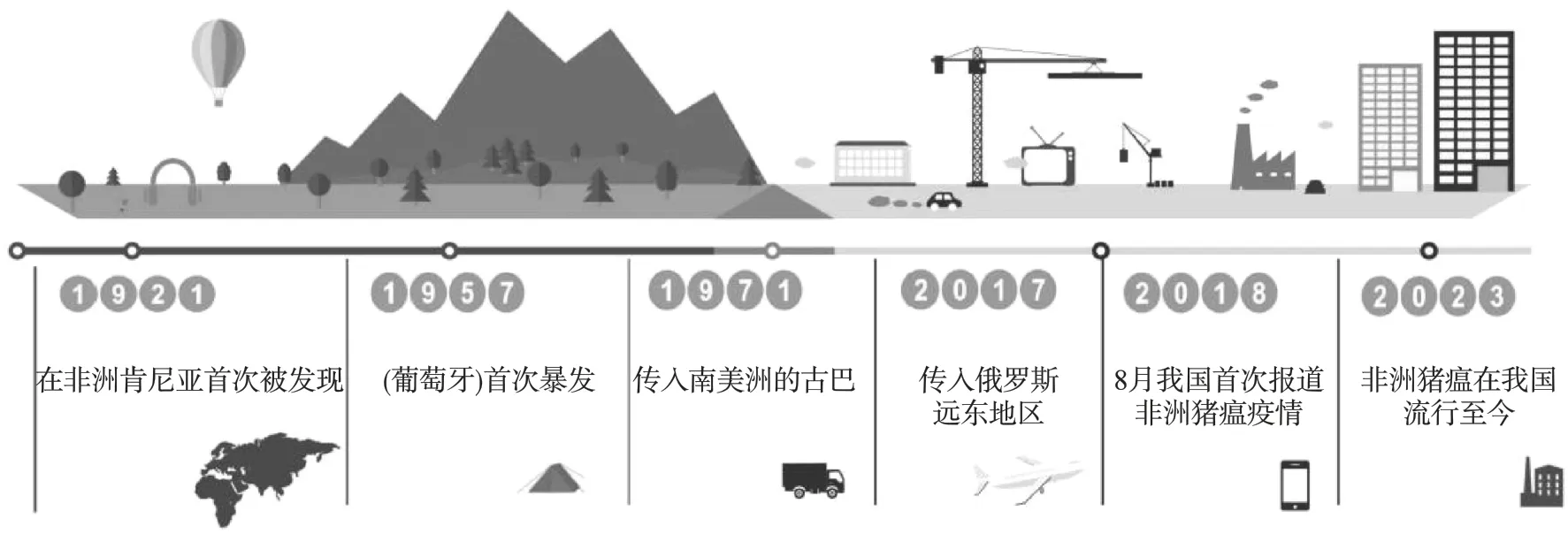
图2 非洲猪瘟的传播过程
非洲猪瘟的流行与病毒毒株、宿主、野猪(天然宿主) 分布、地理区域、蜱的活动以及环境因素具有相关性[30]。 ASFV 感染包括家猪、各种野猪等多种猪科动物[31]。 病毒感染的欧洲野猪表现出与家猪感染时相似的症状[32]。 而非洲野猪在感染病毒时通常不表现出症状,只隐性带毒,能够贮存病毒,因此野猪与软蜱形成的“森林循环”,是引起ASFV传播的重要环节之一[33]。 在天然宿主中,ASFV 呈现持续感染趋势,并且没有任何明显症状。 感染ASFV 的家猪有别于野猪,ASFV 会造成家猪致命性的出血热。
3 非洲猪瘟诊断技术
当前,仍然无法通过疫苗免疫来对非洲猪瘟的防控达到预期效果,所以,高效、准确的诊断对于该病早期提示与防控拥有重要意义。ASFV 基因型与血清型的多种多样,给疾病的早期诊断带来巨大困难。 国际兽疫局(OIE)推荐的非洲猪瘟的实验室诊断技术主要包括:病毒分离、常规和实时荧光定量PCR 检测、荧光抗体检测(FAT)[34],现阶段,均是针对ASFV 的结构蛋白及其编码基因开发的诊断与检测技术[35],最为常用的病原学诊断和更为精准的血清学诊断仍是目前该病应用最为广泛的检测手段。
3.1 病原学诊断技术
病原学诊断技术主要是通过病原体确定的检测方法,它的优势体现在非洲猪瘟疫情暴发的前期能够检测出带毒的可疑动物。 在ASF 的病原学诊断技术中,病毒分离 (Virus isolation) 是首要的病原学诊断技术,被视作检测金标准,成功分离ASFV 可以对毒株基因型、生物学特性以及可能的传入来源进行分析。 但是,由于ASF 属于一类动物疫病,分离ASFV过程中耗费时间与资源,因此,病毒分离通常只应用在诊断和进一步的分子研究过程[36]。ASFV 能够感染猪外周血白细胞并在其中复制,感染后的白细胞能够吸附红细胞[37]。 红细胞吸附实验 (haemadsoptiontest,HAO) 是鉴定ASFV 是最敏感的一种方法,但也存在耗时又费力的缺陷。 迄今应用最为广泛的分子生物学检测手段就是PCR 技术,主要由变性、退火以及延伸三个步骤组成,也会设置预变性和总延伸两个条件。 在特定引物的作用下可以放大目的DNA 片段,通过基因测序确定目的基因的序列。 PCR 方法具有特异性强,灵敏度高,而且操作简便,省时省力的优点。
环介导等温扩增(loop - mediated isothermal amplification,LAMP) 技术,这种方法需要设计4 个引物和一种DNA 聚合酶,这种酶必须具备链置换活性。 在恒定温度的条件下,这种方法可以特异、高效、快速地扩增目的基因[38]。 韦莹华等选择ASFV 的B646L 基因作为检测的靶标,利用Real -time LAMP 确定引物扩增的特异性和效率,并在此基础上,对两种ASFV 进行了可视化染料的选择和显色条件的优化,进而建立了两种ASFV 的等温比色分析方法,真实样本基因组可以在短时间内完成检测,检测结果可通过肉眼判断[39]。
3.2 血清学诊断技术
为了避免假阳性结果的干扰,依赖抗原抗体的血清学检测技术仍然在疫病确诊中起到重要作用。 血清学诊断技术的操作简便、微量、高效使得其成为近年来使用最频繁应用最广泛的检测技术之一。 OIE 当前阶段批准的基于ASFV 抗体的检测方法主要包括ELISA (酶联免疫吸附试验)、Western Blot (免疫印迹实验)、IIF (间接免疫荧光技术),IPT (间接免疫过氧化物酶检测) 等[40,41]。 ASF 血清学诊断中常用的是ELISA 法,因为不仅可以检测血清,还可以用于检测组织液。 为了保证诊断结果的准确性,ELISA 法检测为阳性的样品,还会用免疫印迹等方法再次进行确证。 在大规模血清普查时ELSIA 与对流免疫电泳具有优势。ELISA 通常用于初筛,Western Blot、IIF 和IPT方法用于进一步鉴定。
3.3 液相蛋白芯片检测技术
有着生命科学“登月计划” 的人类基因组计划最早由美国科学家提出,但直至1990 年才正式启动[42]。 这一计划的循序渐进,使得生物芯片技术从此欣欣向荣。 从最初生物芯片概念的形成到1995 年的迅猛发展,生物芯片技术极大地促进了生命信息领域的进步,当前,该技术在疾病诊断及药物研发等方面均得到了广泛的研究和应用[43]。 生物芯片(Biochips) 是一种基于生物分子之间高特异性作用的机理,融合了微电子、生物化学、微加工和计算机等多学科研究成果的一项检测技术。 它具有广阔的应用前景,区别于传统的分析检测手段,其构建的芯片将生物化学分析反应过程高度整合到一个载体上,可实现对成千盈百种核酸、小分子多肽与蛋白质等分子的高通量分析和检测。 蛋白芯片、基因芯片及芯片实验室是生物芯片的三大分支领域[44]。 随着蛋白质组学研究的不断细化,大规模、高通量的蛋白质分析必不可少,而蛋白质芯片技术的问世与完善恰好解决了这个问题。
蛋白芯片是将各种蛋白质固定于某一固相载体之上,用于对被测样本中与其发生特异性反应的组分进行分析。 该项技术又称为蛋白质微阵列,从20 世纪开始出现并被应用,它是一门微电子、微机械、化学等与生命科学结合的新兴技术[45],作为蛋白质组学研究工具,蛋白质微阵列所表现出的高通量、高灵敏度、高特异性等特点比传统蛋白质组学研究方法(二维凝胶电泳和酵母双杂交技术等) 更具有优势[46]。
液相蛋白芯片检测技术作为蛋白质微阵列技术与流式细胞术相嵌合的一种新型多通道高通量生物芯片检测体系新技术;该技术将流式细胞术、激光、荧光编码微球、数字信号处理和传统的生物化学技术融为一体,将核酸探针、抗原或抗体等生物分子包裹在特殊的微球(聚苯乙烯微球或磁性微球) 上,在液相中与待测物结合,并添加荧光标记的报道分子,最终在流式细胞仪的协助下检测微球表面荧光标记物[47-50]。 与传统的检测技术相比,液相蛋白芯片检测技术具有较多优点,它能对一个样本,也就是一个反应体系,同时检测500 个目标;并且还能对样本中所含的痕量待检物进行同时测定,具有很高的灵敏度性。 最重要的是它还具有节约样品、线性范围广、准确性和低成本等特点。
3.3.1 液相蛋白芯片检测技术原理 液相蛋白芯片检测技术的运载器是聚苯乙烯微球(直径为5. 6μm),现有的微球可分为四大类:xTAG 微球、SeroMap 微球、MagPlex 和Micro Plex 微球。 运用Flex map 三维(Flex map 3D)技术生产的微球含有3 个不同比例的荧光素,因此通过排列组合可以得到500 种微球。 利用该方法,我们将能够在同一样本上对500 个以上的靶标分子进行同时探测。 将羧基、组胺基等官能团连接到微球上,该官能团可与含有氨基、羧基等官能团的探针分子(抗原、抗体)结合,此官能团还可实时捕捉载体,实现对待测样本中目标分子的专一结合。 与此同时,该探针与藻红蛋白的荧光报告基因结合,就实现了对该探针的快速、灵敏的检测。 在读数过程中,该装置发出两道激光,一道是红光,用来鉴定微球自身的荧光,并识别其编号;藻红蛋白荧光则由另一道绿光来识别,最终根据荧光的强弱来定量测定。 只有当两个光束都能探测到讯号时所测的结果才具有可信度,如此一来,其他物质的干扰就会被排除。 除此之外,采用液相芯片技术检测一个样品时,每次系统会随机测定100 个微球的荧光值,并以中间值作为荧光强度值(Median Fluorescent Intensity,MFI)[51,52]。
3.3.2 液相蛋白芯片检测技术的应用 基于Luminex x MAP 技术发展起来的液相芯片技术是国外Luminex 公司研制的一种新式生物芯片探测技术平台,又称为悬浮芯片技术[53]。 Luminex 100 是Luminex 公司首次发布的液相芯片测试系统,Flex map 3D、Luminex 200 技术是该公司2001 年之后相继推出的检测系统。 液相芯片经过技术革新后,形成的Flex map 3D探测技术可对同一个靶标中500 种目的分子进行同时检测,将多通路检测技术又拓展到新的高度[54]。
后基因组测序期间,人类已积累了海量的基因组数据,对这些数据的后续研究及功能验证受到了学者们的广泛关注。 迄今为止,发展高通量、更快速、高可靠性、更经济的快速检测方法成为当前亟待解决的问题。 在过去的十几年里,液相蛋白芯片技术已逐渐成为一种新兴的蛋白质与基因组学研究的手段。 该技术所特有的高通量和高效率特点促进了它在新药物靶标、疾病治疗等方面研究,使它成为目前已知的更有效、更有前景的研究方法。 该项技术在人医领域的应用较为成熟,如Pandey Prashant 等在活体相关肾移植病例中,基于Luminex 对102 例病例特异性IgG I 类抗体MFI 值的比较分析[55];Espinosa 等也基于Luminex 技术以分析血清IP -10 作为狼疮活性生物标志物方面的性能[56]。 目前,液相蛋白芯片检测技术在致病微生物、毒素以及致敏性物质的检测中也得到了广泛的应用[57,58]。 液相蛋白芯片检测技术在呼吸道、虫媒介等病毒检测[59,60]、细菌检测[61]、基因检测[62]、药物残留[63]、细胞因子检测[64]等许多领域均得到了广泛的应用。同时,这也是美国食品药品监督管理局所认可的唯一一项诊断技术[65]。 由此可见,以液相蛋白芯片技术为主的检测手段,已逐步形成一种新的发展方向,对其开展的研究与应用同样如火如荼。 这为ASFV 的诊断及防治提供了一定的技术储备。
4 结语
ASF 的流行形势及疫病情况十分复杂,对其进行有效防控是我国生猪生产中的重要组成部分。 截至目前,我国32 个省市和自治区均发生ASF 疫情,对我国养猪业造成了重大损失。 由于缺乏有效的疫苗和药物进行防治,ASF 已成为制约我国养猪业健康、正向、稳定发展的重要因素[66]。 目前,非洲猪瘟感染性病毒粒子的结构已经得到阐明,但大多数病毒结构蛋白的定位及功能的研究仍然需要进一步的深化研究。 此外ASFV 基因组编码了许多目前功能未知的蛋白 (如 H240R、E184L、K145R 等在内的17 种蛋白)[17],这些还没有被完全了解的蛋白在逃避宿主的免疫反应过程中同样具有重要作用,也同样具有研究价值[67]。 疫苗接种是预防ASFV 最有效的方法之一,然而,现阶段,却没有商业化的疫苗能够预防ASFV 的传播,因此,对ASF 的控制仍是通过检疫和扑杀来完成。 在过去的几十年间,人们尝试了不同的疫苗研制策略,但收效甚微,当下,ASF 疫苗的研究热点主要集中在开发自然减毒疫苗和基因工程活毒疫苗等方面[68,69]。 研制低毒性、高效价、且适合群体免疫的ASF 商业化疫苗(亚单位疫苗,多肽疫苗等) 是未来需要继续深耕的重要方向。 从全球范围来看,ASFV 的发展趋势仍未见平息,对于ASF 疫情的监测和控制应是我国应对该病毒的主要着力点。 尽管P30、P72、P54 等重要结构蛋白具有作为ASFV 诊断目标的潜力[21],但这些蛋白始终不足以产生应对ASF 不同毒株的抗体介导保护作用[70]。 因此,未来ASFV 新型检测技术的开发多集中于在高通量、低成本、操作简单、便捷以及可重复性等方向,同时,应具备高特异性和高敏感性,能够更好地适应一线疫情现场检疫。 这对全球ASF 的有效防控具有重要意义。

