猪源大肠埃希菌血清型O145 菌株分离鉴定、耐药性及致病性研究
李清竹,吴长德
(1. 辽宁省动物疫病预防控制中心,辽宁 沈阳 110164;2. 沈阳农业大学,辽宁 沈阳 110866)
仔猪大肠埃希菌病是由致病性大肠埃希菌感染仔猪引起的,临床上以排出黄白色稀便为特征的疾病。 大肠埃希菌病是危害养猪业最重要的细菌性疾病之一,也是导致初生仔猪死亡最常见的原因,尤其是1 周龄内的仔猪感染后,病死率极高。 虽然仔猪大肠埃希菌病可以使用抗生素治疗,但由于抗生素在养殖业中的长期、大量、不合理地使用,致使大肠埃希菌新的耐药菌株不断产生,耐药谱不断扩大,尤其是多重耐药菌株的大量出现,导致本病的防控越来越困难。 本研究对辽宁地区某规模化猪场腹泻仔猪进行了大肠埃希菌分离鉴定,并对其致病力和耐药性进行了研究,以期为辽宁地区猪源大肠埃希菌病的防控提供理论依据。
1 试验材料
1.1 试验对象来源
辽宁某规模化种猪场3 日龄发病仔猪。
1.2 试验动物
体重为(20 ±1 g) SPF 级昆明小鼠,购自辽宁长生生物公司。
1.3 主要试剂
药敏纸片,购自杭州天和微生物试剂有限公司;细菌基因组提取试剂盒,购自天根生化科技 (北京) 有限公司;DL - 2000Marker、2 ×TaqMasterMix,购自康为世纪生物科技有限公司;细菌微量生化反应管,购自青岛高科技工业园海博生物科技有限公司。
1.4 主要仪器
隔水式电热恒温培养箱,上海龙跃仪器设备有限公司;梯度PCR 仪,德国analytik jena公司;电泳仪,美国Bio -Rad 公司;凝胶成像系统,美国Bio-Rad 公司。
2 试验方法
2.1 细菌的分离培养和纯化
无菌采集病死猪的肝脏接种于麦康凯琼脂平板,37 ℃恒温培养箱中培养12 h,观察菌落形态,挑取单一菌落进行革兰染色、镜检。从麦康凯琼脂平板上挑取单一典型菌落,接种于5 mL 营养肉汤培养基中,于37 ℃恒温培养箱中培养12 ~18 h,观察细菌生长情况,革兰氏染色,光学显微镜下观察。
2.2 生化试验
将麦康凯琼脂培养基上的单个菌落接种于各细菌微量生化鉴定管中,37 ℃培养24 h 以上后观察结果。
2.3 细菌16SrDNA 的鉴定
以分离菌的基因组DNA 为模板,采用16S rDNA 通用引物(具体见表1),10 μL 扩增体系为: 2 ×Taq PCR Master Mix 5 μL,上、下游引物各0.2 μL,模板1 μL,ddH2O 3.6 μL。扩增程序为: 95 ℃预变性5 min;95 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 min,共30 个循环,72 ℃再延伸5 min。 将PCR 产物进行1 % 琼脂糖凝胶电泳,观察结果。将PCR 结果阳性的产物送生工生物工程 ( 上海) 股份有限公司测序,测序结果在NCBI 数据库中比对。

表1 PCR 基因扩增的引物信息
2.4 分离菌药敏试验
药敏纸片琼脂扩散法参照美国临床实验室标准化协会 (Clinical andLaboratory Standards Institute,CLSI) 制定的标准进行,药敏结果判断标准按NCCLS2010 年标准,进行判断。
2.5 分离菌致病性试验
取SPF 昆明鼠20 只,随机分为对照组(10 只) 和试验组(10 只);用PBS 稀释营养肉汤培养12 h 的菌液,使菌液浓度为2.5 ×109cfu/mL,试验组每只腹腔注射菌液0.3 mL,对照组每只腹腔注射无菌PBS 0.3 mL,接种后每12 h 观察并记录小鼠的发病情况,对病死鼠及时进行剖检,观察病理变化,并无菌采集肝脏,在营养琼脂培养基划线培养,37 ℃培养12 h,观察菌落形态,革兰氏染色,镜检,以确定小鼠死亡原因。
2.6 引物的设计与合成
根据2.3 和2.4 试验结果,根据GenBank 中已经发表的大肠埃希菌的氨基糖苷类耐药基因aac (6') -Ⅰb、aac (3') -Ⅱ、armA,β-内酰胺类blaSHV、blaTEM、CTX-M,氟喹诺酮类耐药基因qnrA、qnrB、qnrS,大环内酯类耐药基因ermB、ermC、mefA;毒力基因Iss、iucD、FimH、irp2,由生工生物工程(上海) 股份有限公司设计合成引物,引物信息见表1。
2.7 耐药基因的检测
分离菌的基因组DNA 为模板,扩增体系(10 μL) 为: 2 ×TaqMasterMix5 μL,上、下游引物各0.2 μL,DNA 模板1 μL,ddH2O 3.6 μL;扩增程序为: 94℃预变性5min;94℃变性30s,58℃退火45s,72℃延伸1min,共35 个循环;72℃再延伸5min。 将PCR 产物进行1%琼脂糖凝胶电泳,观察结果。
2.8 毒力基因的检测
以分离菌的基因组DNA 为模板,扩增体系 (10 μL) 为: 2 × TaqMasterMix5μL,上、下游引物各0.2 μL,DNA 模板1 μL,ddH2O 3.6 μL;扩增程序为: 94 ℃预变性1 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共30 个循环;72 ℃再延伸5 min。 将PCR 产物进行1% 琼脂糖凝胶电泳,观察结果。
3 结果与分析
3.1 细菌的分离培养和镜检结果
麦康凯琼脂培养基上形成粉红色、边缘平滑的菌落;营养肉汤培养基明显浑浊,试管底部见少量白色沉淀。 对麦康凯琼脂培养基上的单菌落及营养肉汤培养物进行革兰氏染色,可见革兰氏阴性中等大小杆菌,符合大肠埃希菌形态特征。
3.2 分离菌生化试验结果
葡萄糖、甘露醇、麦芽糖、蔗糖、乳糖等细菌发酵试验结果均为阳性,酚红试验和M. R试验结果阳性,V -P 和H2S 试验以及柠檬酸盐利用试验结果均为阴性,生化试验结果符合大肠埃希菌特性。
3.3 分离菌株16srDNA 的检测
PCR 扩增产物1%琼脂糖凝胶电泳显示:扩增片段在1 500 bp 左右,与预期结果相符(见图1)。 将PCR 产物送上海生工生物工程股份有限公司测序,结果: 分离菌16SrDNA 全长1 432 bp,测序结果与NCBI 中登录号为CP031919.1 (其血清型为O145) 基因序列同源性最高,为99.44%,表明分离菌株为血清型O145 大肠埃希菌。

图1 16srDNA PCR 扩增产物电泳结果
3.4 药敏试验
分离菌株对头孢噻肟敏感;对阿米卡星中敏;对多黏菌素B、头孢唑啉、阿奇霉素、阿莫西林、大观霉素、环丙沙星、红霉素、多黏菌素E、利福平、复方磺胺甲唑和多西环素等11 种药物均耐药,见表2。
表2 分离菌药敏试验结果
3.5 致病性试验
试验组小鼠接种后12 h 出现症状,16 h开始小鼠陆续死亡,至36 h 全部死亡。 从死亡小鼠的肝脏中分离病原菌与接种的菌株比较,菌落形态和染色镜检结果一致。
3.6 耐药基因的检测
结果如图2 ~图5 所示,氨基糖苷类耐药基因aac (6') -Ⅰb、aac (3') -Ⅱ;β -内酰胺类blaTEM;氟喹诺酮类耐药基因qnrA;大环内酯类耐药基因ermB PCR 扩增产物1%琼脂糖凝胶电泳显示: 扩增片段分别在370 bp、482 bp、859 bp、627 bp、639 bp 左右,与预期结果相符。 阳性PCR 产物送生工生物工程(上海) 股份有限公司测序,结果与Gen Bank 中公布的目的基因序列一致,说明该菌株携带aac (6') -Ⅰb、aac (3') -Ⅱ、bla-TEM、qnrA 和ermB 等耐药基因。
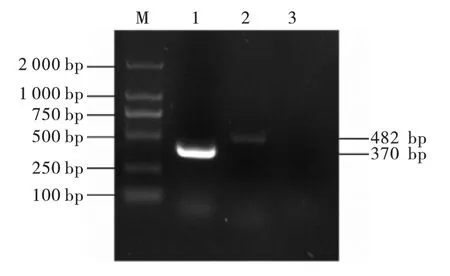
图2 氨基糖苷类耐药基因PCR 扩增结果
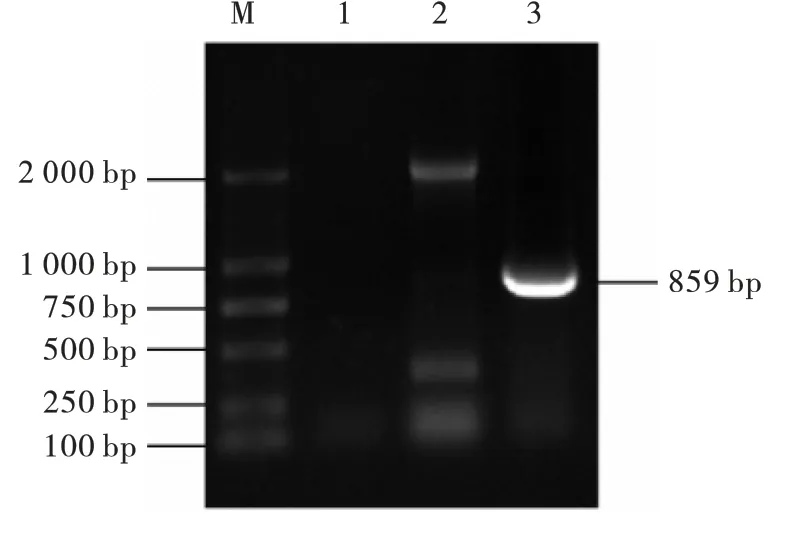
图3 β-内酰胺类耐药基因PCR 扩增结果
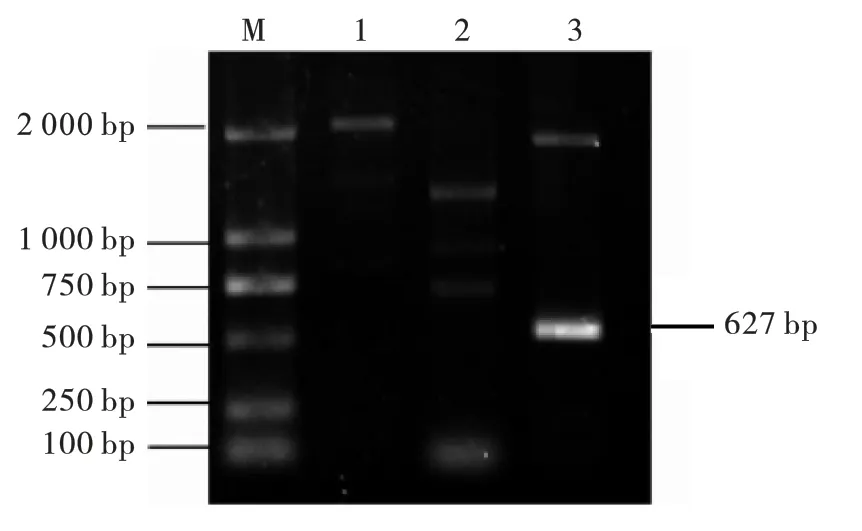
图4 氟喹诺酮类耐药基因PCR 扩增结果
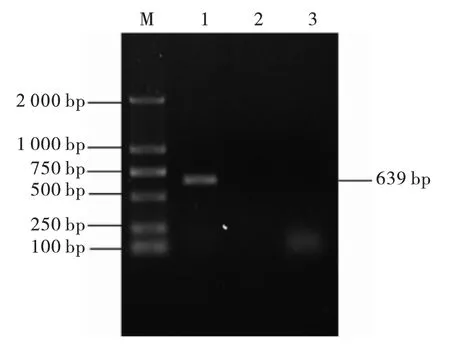
图5 大环内酯类耐药基因PCR 扩增结果
3.7 毒力基因的检测
结果如图6 所示,1%琼脂糖凝胶电泳显示: PCR 扩增片段分别在309 bp、508 bp、700 bp 左右出现目的条带,阳性PCR 产物送生工生物工程(上海) 股份有限公司测序,结果与Gen Bank 中公布的目的基因序列同源性最高,说明该菌株携带Iss、FimH、iucD 毒力基因。

图6 毒力基因PCR 扩增结果
4 讨论
近年来,伴随着养殖规模和饲养密度的不断扩大,疫病成为养殖业最大的瓶颈,尤其是2018 年的非洲猪瘟在我国的暴发,给养猪业带来了巨大的挑战。 抗生素是养殖过程中控制细菌性传染病最有效的方法,但是,由于养殖过程中抗生素的滥用,导致细菌的耐药性越来越严重,而且经常出现多重耐药现象[1,2]。 本研究从规模化猪场3 日龄腹泻仔猪分离得到的大肠埃希菌除了对头孢噻肟敏感、对阿米卡星中敏之外,对多黏菌素B、头孢唑啉、阿奇霉素、阿莫西林、大观霉素、环丙沙星、红霉素、多黏菌素E、利福平、复方磺胺甲唑和多西环素等11 种药物均呈现耐药,而且很多药物抑菌圈是零,因此,导致仔猪大肠埃希菌病等细菌性传染病的治疗越来越困难。 细菌所携带的毒力基因与其致病性密切相关[3-5],毒力基因的携带和传播,是防控仔猪致病性大肠埃希菌病最大的难题。 孔科委等(2014) 研究表明[6],在毒力较强大肠埃希菌中,iss 基因的PCR 扩增频率高达92.8%,而在无致病力(或低毒力) 大肠埃希菌中的PCR 扩增频率仅为16.7%。 本研究分离出的大肠埃希菌与肠外致病性大肠埃希菌O145 同源性最高,而肠外致病性大肠埃希菌都具有极强的毒力。 周磊等(2021)[7]对28 株肠外致病性大肠埃希菌相关毒力基因进行了检测,结果fimH、iucD、iss等基因出现的频率都超过50%,说明fim H、iucD、iss 等基因与大肠埃希菌致病性密切相关。 此外,不同地区猪源肠外致病性大肠埃希菌优势血清型存在差异,广东地区以O101 和O157 为优势[8],河南地区以O8、O9、O11、O26、O101、O138 和O161 为优势[9],河北地区以O53、O93 和O157 为优势[10],黑龙江地区以O8、O78 和O120 为优势[11],而辽宁地区目前还没见报道。 本试验分离菌株与CP031919.1 (血清型为O145 大肠埃希菌) 基因序列同源性最高,而且致病力极强,耐药现象严重,并出现多重耐药现象。 本试验的研究结果为进一步研究辽宁地区猪源大肠埃希菌优势血清学型毒株提供了基础数据,也为下一步研制针对辽宁地区乃至全国大肠埃希菌主要流行菌株同血清型疫苗提供了参考。

