基于光照和温度环境条件下杜氏盐藻的生长数学模型构建
张港生, 孙 鑫, 朱大玲
(天津科技大学 化工与材料学院,天津市卤水化工与资源生态化利用重点实验室,天津 300457)
1 前言
杜氏盐藻(Dunaliellasalina)是一种无细胞壁的单细胞嗜盐绿藻,是迄今为止发现的最耐盐真核生物之一[1],其含有丰富的营养成分,如蛋白质、脂质、维生素等[2]。在高光强、高盐、营养缺失等胁迫条件下,杜氏盐藻中β-胡萝卜素含量可以达到14%[3],同时,杜氏盐藻在盐度胁迫下也会产生大量甘油[4]。盐藻的培养条件简单,其培养不需要淡水资源,可以生存在较高浓度的盐水中,土地需求量也低,避免了对农业用地的影响。目前美国、中国和澳大利亚等国家已经实现了杜氏盐藻的规模化养殖[5]。但在盐藻的规模养殖过程中,仍存在许多需要解决的工艺问题,其中如何实现盐藻生长优化和生物量产量的预测,以提高养殖工艺的可调控性和生物产量的稳定性,是盐藻养殖行业面临的难点之一[6]。
近年来,数学模型模拟已被广泛应用于生物工艺的开发,是实现生物工艺从实验室小规模向工业化大规模转移的有效工具[7]。当前国内外对微生物生长模型的研究大多集中在食品安全方面,通过生长模型的预测来确定食品的保质期等,关于微藻生长模型的研究报道较少。Bernard等人研究了光和氮对微藻生长的影响,并提出了二者的反应器模型[8],Zhang等研究了光照和硝酸盐浓度对耐热绿藻Desmodesmussp.生长和产叶黄素的复杂影响,并提出了具有高精度的动力学模型[9]。Del Río等研究分析了雨生红球藻在光照和硝酸盐浓度影响下的虾青素产量,并开发了相应的动力学模型,将生长速度与光照强度和硝酸盐输入量相联系[10]。当前数学模型研究大多集中在绿藻方面,通常使用Droop、Monod等模型来预测单一营养条件下的生长速率[11],而有关生长环境的微藻生长模型研究较少。
盐藻的生长环境独特,生长周期长,其生长盐度范围为0.05~5 mol/L[12],生长周期大于18 d[13]。已成熟的盐藻规模养殖工艺通常为两段式养殖工艺,包括生长阶段和β-胡萝卜素积累阶段。其中,生长阶段为菌种活化、扩种和扩培三个工序的生物量积聚阶段;β-胡萝卜素积累阶段则是通过胁迫处理生长后期的藻液使得细胞内类胡萝卜素积累,以提高盐藻产品的商业价值[14]。生长阶段是盐藻养殖工艺的重要阶段,该阶段的生长可调控性和稳定性是保证产品产量和质量的重要前提。因此,文章针对盐藻养殖中两个重要的生长环境条件光照和温度对盐藻生物量的影响,构建盐藻生长阶段模型,以期实现根据实际环境条件对盐藻生物量产量进行预测,对盐藻规模养殖工艺完善及盐藻相关产品生产提供一定的理论依据和指导意义。
2 实验
2.1 实验原料和试剂
实验藻种为杜氏盐藻,由天津科技大学生物质资源利用实验室提供。
培养基(g/L):NaCl(≥98%,天津光复科技发展有限公司)根据需要添加;MgCl2·6H2O 1.5 g (≥98%,天津光复科技发展有限公司);MgSO4·7H2O 0.5 g(≥99%,天津市风船化学试剂科技有限公司);KCl 0.2 g(≥99%,天津市风船化学试剂科技有限公司);CaCl2·2H2O 0.2 g(≥98%,天津光复科技发展有限公司);KNO31 g(≥98%,天津市风船化学试剂科技有限公司);NaHCO30.043 g(≥99%,天津市风船化学试剂科技有限公司);KH2PO40.035 g(≥99.5%,天津光复科技发展有限公司),铁离子溶液10 mL,微量元素溶液10 mL。
铁离子溶液(mg/L):Na2EDTA 189 mg(≥99%,国药集团化学试剂有限公司);FeCl3·6H2O 244 mg(≥99%,天津市双船化学试剂厂)。
微量元素溶液(mg/L):H3BO361 mg(≥99.5%,天津科威有限公司);(NH4)6Mo7O24·4H2O 38 mg(≥99%,天津市风船化学试剂科技有限公司);CuSO4·5H2O 6 mg(≥99%,天大化工实验室);CoCl2·6H2O 5.1 mg(≥98%,天津市风船化学试剂科技有限公司);ZnCl24.1 mg(≥98%,天津市风船化学试剂科技有限公司);MnCl2·4H2O 4.1 mg(≥98%,天津市风船化学试剂科技有限公司)。
2.2 实验设备与分析仪器
精密电子天平(AL204、赛多利科学仪器(北京)有限公司)、实验室pH计(FE20、梅特勒—托利多仪器(上海)有限公司)、盐度计、紫外分光光度计(UV-1800、日本岛津有限公司)、高速台式冷冻离心机(TGL-16M、长沙湘仪离心机仪器有限公司)、真空干燥箱(DZF-6050、巩义市宏华仪器设备工贸有限公司)、盐藻培养箱(HNGZ-250、天津欧诺仪器股份有限公司)、生物显微镜(CX23LEDRFS1C、奥林巴斯(广州)工业有限公司)。
2.3 实验方法
2.3.1 藻种活化
取杜氏盐藻藻种接种于100 mL培养基中,接种量10%,在光照和温度分别为72 μmol/m2·s2和25 ℃环境条件下光照培养箱摇瓶培养25 d,光暗时间分别为12 h和12 h。
2.3.2 环境对盐藻生物量积累影响的实验设计
根据杜氏盐藻两段式养殖工艺的特点,分别选取光照和温度两个环境因素设计实验,获得的盐藻生物量积累数据用于数学模型构建。采用单因素分析法分别分析光照和温度对盐藻生长的影响。在光照单因素实验中,设计5个实验组,每个实验组温度条件固定为299.15 K,光照条件分别为36、54、72、90、108 μmol/m2·s2(表1)。在温度单因素实验中,设计5个实验组,每个实验组光照条件固定为72 μmol/m2·s2,温度条件分别为293.15、296.15、299.15、302.15、305.15 K(表1)。每个实验组设置三个平行,取平均值进行数据分析和模型模拟。每批次实验培养时间为25 d,每隔3 d取样检测盐藻生物量。为了证明模型的可预测性,另根据实际生产条件设计了两组不同温度和光照环境条件下的盐藻生长实验,具体工艺参数详见表1。
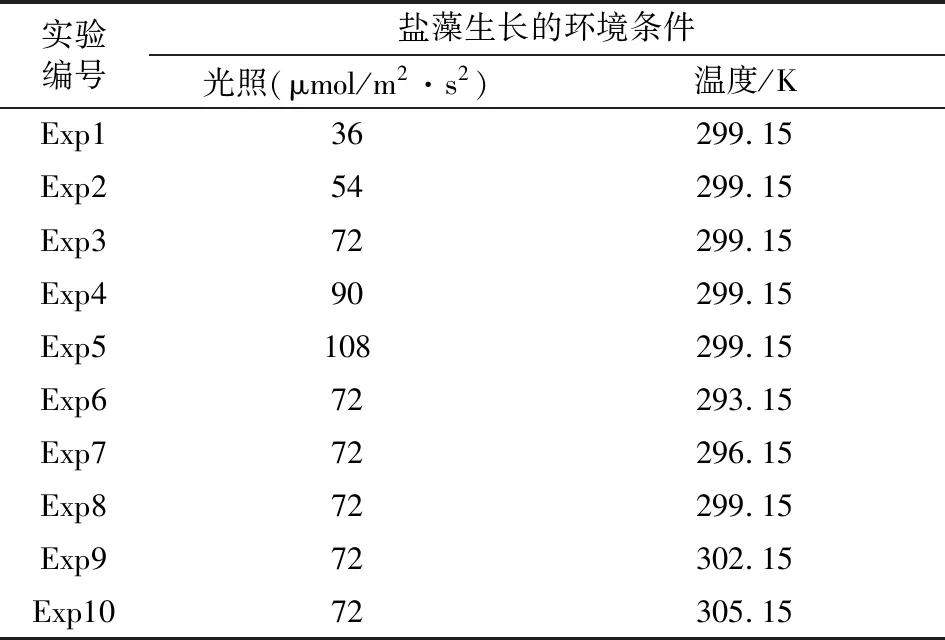
表1 盐藻生长阶段实验条件设计
2.3.3 盐藻生物量的测定
盐藻生物量的测定分别采用分光光度法和细胞干重法两种方法。
分光光度法。采用UV-Vis分光光度计(日本岛津UV-1800型)测量680 nm波长下藻液样品的光吸收值,即OD680。
细胞干重法。使用预先称重的Whatman GF/C过滤器,过滤10 mL藻液,并用2 mL 0.5 mol/L碳酸氢铵洗涤三次,然后在60 ℃下干燥16 h以上,直到重量恒定,根据最终和初始过滤器重量和过滤样品体积之间的差异计算[15],获得盐藻干重(Dry Weight,DW)。
分别测定相同藻液样品的OD680和DW,构建OD680和细胞干重之间的适当校准方程,将OD680值转换为生物量浓度。盐藻获得OD680与干藻类生物量(g/L)之间的关系曲线后,在接下来实验中,通过测定藻类OD680值,利用相关方程计算得到生物量。
2.3.4 盐藻比生长速率的测定
盐藻的生长速率由公式计算获得,具体如下:
式中:DWi和DWi-1分别代表第i时和第i-1时的生物量浓度;ti和ti-1分别代表取样时间为t时和ti-1时。
2.4 模型构建
当前微藻产高值产品工艺通常为两步法,第一步快速积累微藻生物量,第二步对微藻进行胁迫培养使其积累胡萝卜等高值物质。已有研究发现光照和温度是盐藻生物量积累阶段的重要环境因素,根据这两个条件建立模拟杜氏盐藻快速积累生物量的动态方程,将对盐藻养殖工艺优化提供帮助。文章在已有微藻相关研究的基础上[16],提出了一个盐藻生长动态模型,该模型根据不同环境因素对生长速率的影响程度,并基于动力学机理而来。
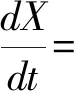
式中:X为生物量浓度,单位g/L;I为平均光照强度;ks为细胞生长的光饱和系数;ki细胞生长的光抑制值;A和B是指数前系数;E1为细胞生长的活化能;E2为细胞生长的灭活化能;μd为细胞衰减率。
公式模拟了生物量的生长速率,等式右边第一项表示生物量的增长,第二项表示盐藻细胞呼吸和衰变。
2.4.1 光照模型构建过程
藻类可利用光进行光合作用,光是藻细胞生长的能量来源之一,因此光照是微藻生长模拟中的重要参数,根据光照强度不同,藻细胞生长一般会经历三个光区,分别为光限制区、光饱和区和光抑制区。
光照强度显著影响生物量的增长速率,通常使用Aiba模型来描述[17]。
式中:μmax是细胞最大比生长速率;ks为细胞生长的光饱和系数;ki是细胞生长的光抑制系数。
当盐藻细胞在进行培养时,考虑到光衰减,细胞经受的局部光强度远低于入射光强度,所以为了考虑光衰减现象,一般采用Beer-Lambert定律来解释。与其他光传输模型相比,Beer-Lambert定律具有较高的精度和方便的参数估计[18]。
I=I0×e-kz
式中:I是光照强度;I0是垂直于介质表面进入的光照强度;z是深度;k是衰减率。
最近研究表明光衰减与藻类在生长过程中吸收光子、气泡散射和微生物散射有关,但也有研究表明微生物散射对光衰减的影响很低,可忽略不计[17,19]。实验在盐藻细胞培养过程中,未进行通气培养,所以忽略气泡散射对光衰减的影响。因此仅考虑了盐藻吸收光子的影响,对Beer-Lambert模型进行修正:
I=I0×e-αXz
式中:X为生物量浓度,单位g/L;α是藻类吸收系数。但是当该方程包含到Aiba模型中时,模型将同时包含时间维度和空间维度,同时需要一个偏微分方程模型,以便于参数估计、过程模拟和此后的过程优化,所以为了便于参数估计,对空间维度进行简化,使用平均光强度代替局部光强度:
2.4.2 温度模型构建过程
除了光照之外,研究发现温度显著影响细胞生长、细胞衰变和生物产物的积累,为了解释温度对生物生长速率的影响,实验采用Hinshelwood模型用于温度对微藻生长的影响[20]。
μ=A×e-E1/T-B×e-E2/T
式中:T为绝对温度,单位K;A、B、E1、E2为模型参数;E1和E2取代了Arrhenius模型原始形式中的气体常数活化能Eα/R,Hinshelwood模型第一项代表微藻的生长速率,第二项表示高温导致的微藻死亡速率。
2.4.3 参数估计过程
对参数的准确估计是模型构建中非常关键的一步,不可靠的参数将会严重影响模型的拟合和应用,文章提出一个非线性最小二乘法优化问题,将实验数据与模型输出值的平方差值作为目标函数,通过粒子群优化算法对生成的非线性规划问题进行求解(NLP),以达到近似的全局最优解,这项工作是通过MATLAB优化环境中编程得以实现。
3 结果与讨论
3.1 不同环境条件对盐藻生长的影响
通过测定不同细胞浓度的藻液OD680和DW,结果分析表明藻液的OD680与DW(g/L)呈现正相关性,结果见图1。藻液DW和OD680的相关方程为y=0.01+5.38x,其中,y为藻液的细胞干重;x为藻液在680 nm波长下的光吸收值。该方程R2大于99%,可信度高。因此,在后续实验中采用测定藻类OD680后,利用相关方程计算得出藻液的生物量。
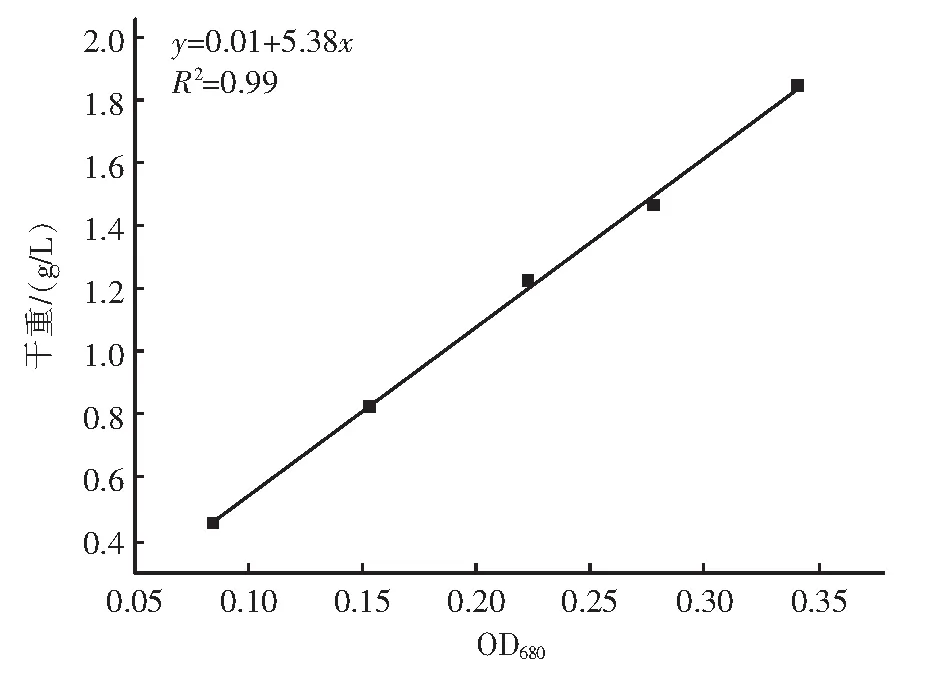
图1 盐藻藻液OD680与干重的标准曲线
在所有组别实验中,盐藻生物量在培养过程中都保持良好增长态势,由于初始接种生物量浓度相同,故可以通过比较最终生物量和生长速率来分析环境因素对生物量积累的影响。光照强度对盐藻生物量积累的影响结果表明,光照对盐藻的生长影响明显,随着光照强度的提高,盐藻的生物量积累和生长速率皆不断增加(图2a和图3a)。光照(Aiba)模型对盐藻生长速率曲线的拟合效果良好,R2为0.95,大于95%。在光照强度为36~72 μmol/m2·s2之间,随着光照强度的提高盐藻生长速率增加较快,在光照强度为90~108 μmol/m2·s2之间,盐藻的生长速率基本稳定,在光照强度为108 μmol/m2·s2条件下,盐藻的生物量积累和生长速率最大,分别为16.38 g/L和0.14/d(图3a)。在大多数情况下,平均光强越高,生物生长速率越大,这与Sui等发表的研究一致[21]。温度对盐藻生物量积累的影响结果表明,温度对盐藻生长影响较大,在最佳培养温度299.15 K时,盐藻的生物量和生长速率为14.94 g/L和0.12/d(图2b和图3b)。温度对盐藻生长的影响方式符合微藻温度动力学模型(Hinshelwood模型),模型拟合效果良好,R2为0.97,大于95%。盐藻生长速率在293.15~299.15 K(19~25 ℃)与温度呈正相关,在299.15~305.15 K(25~31 ℃)与温度成负相关(图3b)。
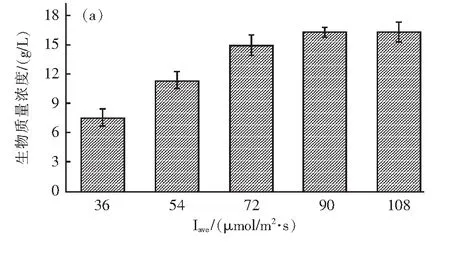
图2 光照强度对盐藻生长的影响
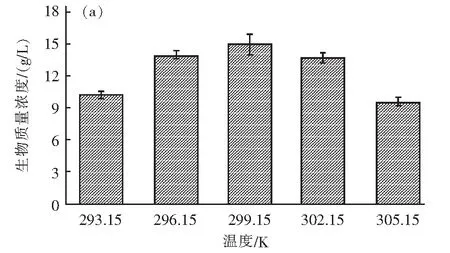
图3 温度对盐藻生长的影响
由上述分析可知,温度和光照环境条件均对杜氏盐藻的生长产生较大影响。其中,在299.15~305.15 K温度范围内,随着温度升高,盐藻生长速率开始急剧下降,从0.12降至0.096,下降了20%。这种急剧下降通常表示藻类细胞死亡,此条件下藻细胞内的酶活性和化学反应(如营养吸收)对温度的变化都十分敏感[22],以在规模化养殖中,温度恒定控制在适宜范围内对生物量高效积累是必需的。
3.2 盐藻生长模型构建
通过研究光照和温度两个环境因素对盐藻的生长的影响,得到10组实验数据,共90个数据点,以此来估计盐藻生长模型参数值。通过将参数问题转化为非线性规划问题,计算盐藻生长模型中的参数值,模型参数结果见表2。最优参数ks为38.38 μmol·photons/m2· s,ki为2 000 μmol·photons/m2· s,A、B、E1、E2分别为19.68、0.000 1、917.30、2 000,最大生长速率0.30/d,衰亡速率0.01/d。表2中μmax数值为0.30,相比于其他微藻,处于较高水平[23]。μd数值接近于0,这是因为拟合数据还未达到此类盐藻生长稳定期的缘故。通过粒子群优化后的光抑制系数ki为2 000 μmol·photons/m2·s,表明细胞生长过程中所受抑制力不强,未出现较大光衰减现象,参数模型过程中可以使用使用平均光强度代替局部光强度。优化后的盐藻生长模型为:
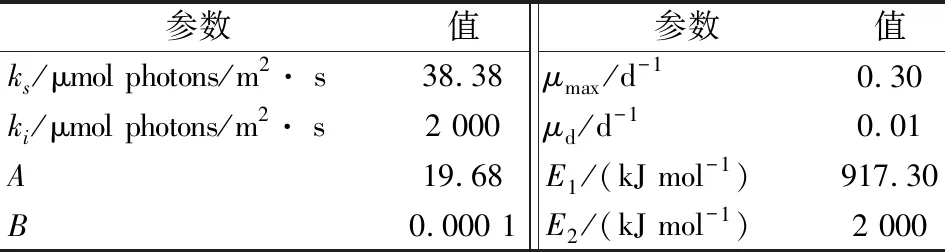
表2 盐藻生长模型的相关参数
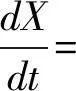
图4显示了盐藻生长模型结果与温度、光照影响下盐藻生物量积累实验结果的拟合情况。从图4可以看出盐藻生长模型模拟结果与实验数据的拟合度较高,这表明该研究提出的参数估计方法和模型对盐藻生长的预测是准确且适用的。其中,光照强度对生长的影响组别的模型模拟结果与实验数据的拟合效果皆较好,生物量增长阶段数据点拟合偏差7.5%以下。温度对生长的影响组别的模型模拟结果与实验数据的拟合效果部分较好。在温度为293.15~302.15 K之间的实验组别中模型模拟结果与实验数据的拟合效果较好,实验6~实验9生物量增长阶段数据点拟合偏差在10%以下;而实验10(温度305.15 K)的拟合曲线出现部分偏离,这可能是因为盐藻生长对温度变化非常敏感,较高温度对生长速率影响过大,导致误差偏大,拟合效果降低[24]。
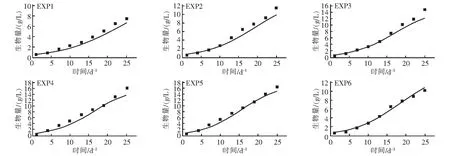
图4 盐藻生长模型拟合结果
3.3 动态模型可预测性的验证
研究基于光照和温度环境条件对生物量积累影响构建的盐藻生长模型,是否能够在盐藻规模养殖的实际生产进行应用,实现对养殖工艺操作条件的实时指导和产品产量的预估,关键取决于盐藻生长模型的精度和预测性能。因此,研究设计实验模拟了实际生产中常见的两种环境条件,分别是夏季的高温、高光强环境A(和冬季的低温、低光强环境B,具体工艺条件详见表3。两种环境条件的实验数据与模型预测值的拟合情况见图4和图5。预测A组的模型预测数据与实验数据的拟合偏差为9.4%;预测B组的模型预测数据与实验数据的拟合偏差为6%。
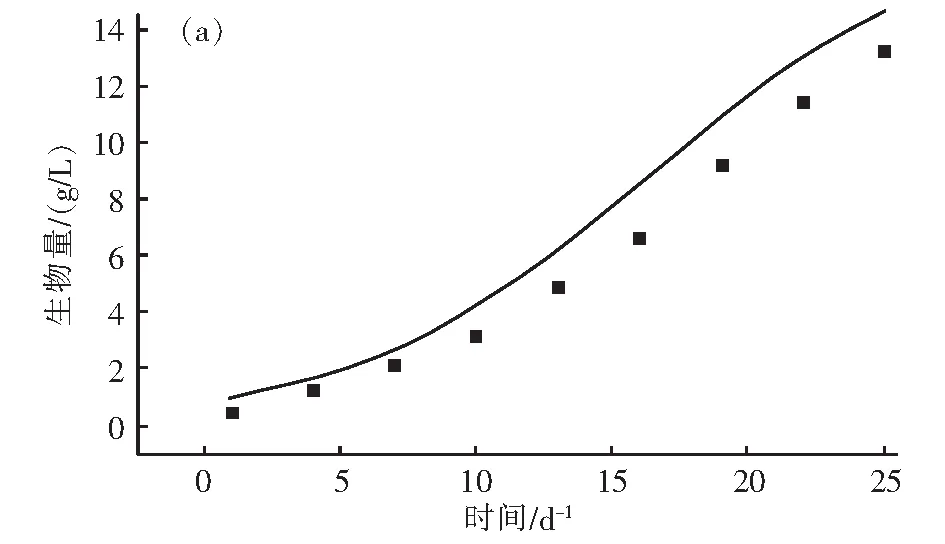
图5 不同环境条件下盐藻生长模型预测效果

表3 预测验证实验的工艺条件
与直接使用Logistic模型拟合微藻或微生物生长相比,盐藻生长模型创新性地考虑了环境因素对生物量积累的影响。Logistic模型是一种经典的生长模型,通常适用于描述生物体在恒定环境条件下的生长趋势。但是,在实际的盐藻养殖中,环境因素的变化会对盐藻的生长产生明显的影响,研究提出杜氏盐藻生长模型较好地考虑和描述环境条件对盐藻生长的影响,且通过实验数据的拟合验证了模型的精度和预测性能。与Logistic模型相比,杜氏盐藻生长模型具有更高的预测精度和可靠性,可以更准确地预测盐藻在不同环境条件下的生长情况。该模型可应用于盐藻规模养殖产业,对实际生产进行实时指导和产品产量预估,进而提高盐藻养殖的经济效益和可持续性。此外,杜氏盐藻生长模型还可以结合实时数据对模型进行参数优化,从而提高模型的适用性和可靠性,使模型具有更广泛的应用场景和更强的实用性,为盐藻养殖产业的可持续发展提供更好的解决方案。
4 结论
研究以杜氏盐藻为研究对象,通过分析光照和温度环境条件对盐藻生物量和生长速率的影响,成功构建盐藻生长模型并进行了预测验证。
采用单因素实验研究发现杜氏盐藻最佳光照和温度生长条件分别为25 ℃和108 μmol/m2·s2。光照强度和温度对杜氏盐藻的生物量积累和生长速率影响都较为明显。光照和温度对盐藻生长的影响方式分别符合光照(Aiba)模型和微藻温度动力学模型(Hinshelwood模型)。
成功构建基于光照和温度共影响下的盐藻生长模型,通过粒子群优化算法优化模型参数,优化后参数为光饱和系数为38.38 μmol·photons/m2·s,光衰减系数为2 000 μmol·photons/m2·s,A、B、E1、E2分别为19.35、0.000 1、136.44、2 000,最大生长速率0.30/d,衰亡速率0.01/d。
利用盐藻生长模型对高温、高光强和低温、低光强环境条件下的盐藻生物量积累情况进行预测,结果表明该模型具有一定精度和预测性,该盐藻生长模型可以在盐藻养殖中的过程控制和产量预估中发挥积极作用。

