吴茱萸碱对肿瘤血管增生的抑制作用及其机制*
刘磊,彭琴,吴泽明,黄欣慧,张广献,谭宇蕙
(广州中医药大学基础医学院,广州 510006)
统计报告显示,2020年全球新发癌症约1 930万例,癌症患者死亡1 000万例,其中我国新增癌症病例约457万,死亡病例300万[1]。大多数癌症患者确诊时已进入进展期或者中晚期,肿瘤已开始通过血行播散转移。肿瘤血管生成是肿瘤生长、进展和转移的重要因素[2],抑制血管生成已成为临床批准的治疗方法,然而目前却受到可选药少、疗效不足或耐药性的限制。由于肿瘤细胞迅猛增殖,代谢水平高,实体肿瘤中心区域容易出现缺血缺氧的状态,而缺氧能促进血管增生,诱导血管生成是肿瘤的十大特征之一,其病理性血管增生是以新生毛细血管的形成为主,而内皮细胞是构成毛细血管管壁的主要细胞,其来源于内皮祖细胞增殖分化或自身的继续增殖分裂,而内皮(祖)细胞增殖分化及迁移被证实是恶性肿瘤血管增生的重要环节[3-4]。有报道指出,内皮(祖)细胞增殖也像癌细胞一样依赖瓦伯格效应(Warburg effect,即依靠大量糖酵解提供合成代谢和能量代谢的原料)[5-6],因此,通过调整内皮(祖)细胞代谢以抑制血管增生可能是抗癌的新策略。
吴茱萸碱(evodiamine,EVO)是吴茱萸的主要活性成分之一。现代研究发现,EVO具有抗肿瘤、抗炎、抗菌、保护心血管系统及神经等药理作用[7]。本课题组前期已证实EVO对肝癌细胞的瓦伯格效应有显著的抑制作用,那么EVO能否抑制血管内皮细胞的瓦伯格效应?EVO是否通过影响内皮细胞糖代谢而抑制其增殖生长从而抗血管增生?这些尚不明确。本研究通过体外模拟人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)体内的缺氧状态,观察常氧和缺氧下内皮细胞糖代谢相关酶的变化、EVO的干预作用及相关信号通路变化,探讨EVO抗血管增生的作用及机制。
1 材料与方法
1.1材料
1.1.1细胞 HUVECs购自广州浩玛生物科技有限公司(货号:CL-0122);人肝母细胞肝癌细胞株(HepG2),由广州中医药大学基础医学院生物化学实验室长期保存。
1.1.2药物及试剂 EVO购自成都曼思特有限公司(批号:MUST-21050405);六水合氯化钴(CoCl2·6H2O)购自上海麦克林生化科技有限公司(批号:C13563922);内皮细胞专用培养基购自广州浩玛生物科技有限公司(货号:CM-0122);胎牛血清购自武汉普诺赛生命科技有限公司(批号:SA220119);高糖达尔伯克必需基本培养基(Dulbecco's minimum essential medium,DMEM)购自美国Gibco公司(货号:8122480);噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒、二甲亚砜、Annexin V/PI细胞凋亡检测试剂盒均购自广州瑞舒生物科技有限公司(货号分别为:10004162、MB2470、MA0220-1);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自Roche(货号:62344100);山羊抗鼠二抗、山羊抗兔二抗均购自ABclonal(批号:AS014、AS003);鼠抗β-actin抗体、兔抗HIF-1α抗体、兔抗PFKFB3抗体均购自ABclonal公司(批号分别为AC004、A6265、A6945);兔抗VEGFR2抗体购自Abcam公司(批号:GR256989-1)。
1.1.3仪器与设备 二氧化碳(CO2)细胞培养箱(美国Thermo Fisher公司,型号:FORMA371);超净工作台(上海博迅医疗生物仪器股份有限公司,型号:SW-CJ-2F);多功能酶标仪(PE公司,型号:PerKinElmer);流式细胞分析仪(美国BD公司,型号:Accuri C5);蛋白垂直电泳系统、蛋白转印系统(美国Bio-Rad公司);全自动化学发光图像分析系统(上海天能仪器有限公司,型号:5200)。
1.2方法
1.2.1细胞培养 将HUVECs、HepG2细胞分别置于内皮细胞专用培养基、10%胎牛血清+90%高糖DMEM培养基中,37 ℃、5%CO2饱和湿度条件下常规培养。细胞密度达到80%~90%,用含0.25%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶消化、离心并收集细胞(离心率1 000 r·min-1,r=7 cm,离心5 min),加入内皮细胞专用培养基或DMEM培养液制成单细胞悬液,选取第3~6代细胞进行后续实验。
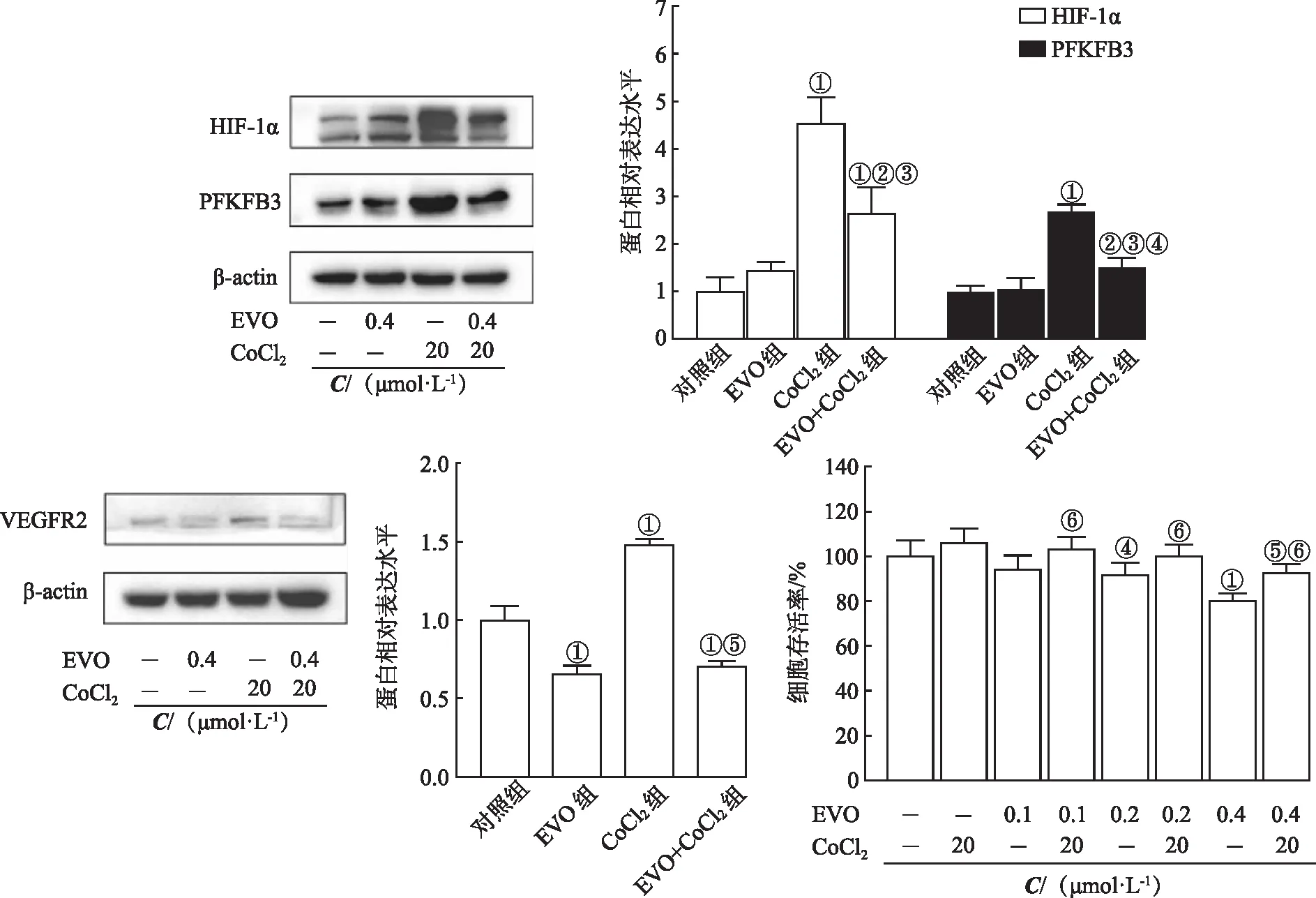
1.2.2MTT法检测细胞增殖情况 取对数生长期HUVECs、HepG2细胞分别制成单细胞悬液,均以每孔2 000个、细胞悬液100 μL接种于96孔板,培养24 h,即细胞贴壁,设置空白组(无细胞对照)、对照组(细胞对照)、实验组[EVO 和(或)CoCl2],实验组每孔加入不同浓度的EVO(0.1、0.2、0.4、0.8、1.6 μmol·L-1)或CoCl2(50、100、200、400、800 μmol·L-1)或二者联合100 μL,每个浓度梯度设置5个平行复孔。药物干预24 h,避光,每孔加入5 mg·mL-1MTT溶液10 μL,继续孵育4 h,吸弃上清液后每孔加入二甲亚砜150 μL,避光震荡10 min。酶标仪检测波长处490 nm吸光度值(A值)。细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。改良寇式法计算半数抑制浓度(half madimal inhibitory concentration,IC50):Lg(IC50)=Xm-I[P-(3-Pm-Pn)/4]及IC50=10 Lg(IC50)。
1.2.3流式细胞术检测HUVECs细胞凋亡水平 以每孔106个HUVECs接种至6孔板,待细胞贴壁后,设置对照组和EVO各浓度组,EVO处理24 h,用不含EDTA的胰酶消化、离心细胞,磷酸盐缓冲液重悬并离心细胞2次,收集细胞制成单细胞悬液,使用Annexin-V/PI双染料联合标记,避光孵育20 min,流式细胞仪检测各组细胞凋亡率。
1.2.4CoCl2体外模拟缺氧模型建立 参照“1.2.2节”以CoCl2(50、100、200、400、800 μmol·L-1)干预HUVECs 24 h,MTT法检测CoCl2对细胞增殖的影响,和参照“1.2.5”项CoCl2(50、100 μmol·L-1和5、10、20、40 μmol·L-1)干预HUVECs 24 h,Western blotting检测HUVECs的HIF-1α蛋白表达水平,以选择合适浓度的CoCl2建立体外模拟缺氧模型。
1.2.5Western blotting检测 以每孔106个HUVECs接种至6孔板,待细胞贴壁后,经EVO或(和)CoCl2干预24 h,使用RIPA裂解液提取细胞内总蛋白,BCA法测定总蛋白浓度,加入5倍十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)上样缓冲液稀释为1倍工作液,置于金属浴中加热10 min使蛋白变性。然后使用8%~10% SDS-PAGE凝胶电泳分离目的蛋白,采用湿转法将目的蛋白转印至PVDF膜上,5%脱脂奶粉室温封闭4 h,分别放入鼠抗β-actin抗体、兔抗HIF-1α、PFKFB3、VEGFR2抗体中(1:1 000稀释),4 ℃孵育过夜。经TBST缓冲液洗涤5 min,重复3次后,加入辣根过氧化酶(horseradish peroxidase,HRP)标记二抗,室温孵育1 h,TBST缓冲液再洗涤3次后采用电化学发光法显影,拍照并保存图像。使用ImageJ软件测量条带灰度值,β-actin作为内参,分析目的蛋白相对表达水平。
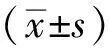
2 结果
2.1EVO对HUVECs、HepG2细胞增殖的影响 MTT检测结果显示,EVO对HUVECs、HepG2细胞的增殖均有显著抑制作用(P<0.05或P<0.01),对HUVECs、HepG2细胞IC50分别为1.15、1.07 μmol·L-1。由此可见,EVO对HUVECs抑制作用较对HepG2细胞稍弱,但抑制程度基本一致(图1)。

①与对照组比较,t=2.420,P<0.05;②与对照组比较,t=7.436~32.403,P<0.01。
2.2EVO对HUVECs诱导凋亡的影响 流式细胞术检测结果显示,各组EVO作用浓度分别为0、0.1、0.2、0.4 μmol·L-1,HUVECs凋亡率逐渐升高,分别为5.05%、7.26%、8.30%、8.61% (P<0.01),见图2。
①与对照组比较, t=-8.131,-8.461,-12.356,P<0.01。
2.3EVO对HUVECs的HIF-1α、PFKFB3和VEGFR2蛋白表达的影响 Western blotting检测结果显示,常氧条件下EVO对细胞的HIF-1α、Warburg效应的主要关键酶PFKFB3(内皮细胞主要表达的PFK的同工酶)没有明显下调作用,但对VEGFR2有明显的下调作用(P<0.01)(图3)。

①与对照组比较,t=6.706,7.867,P<0.01。
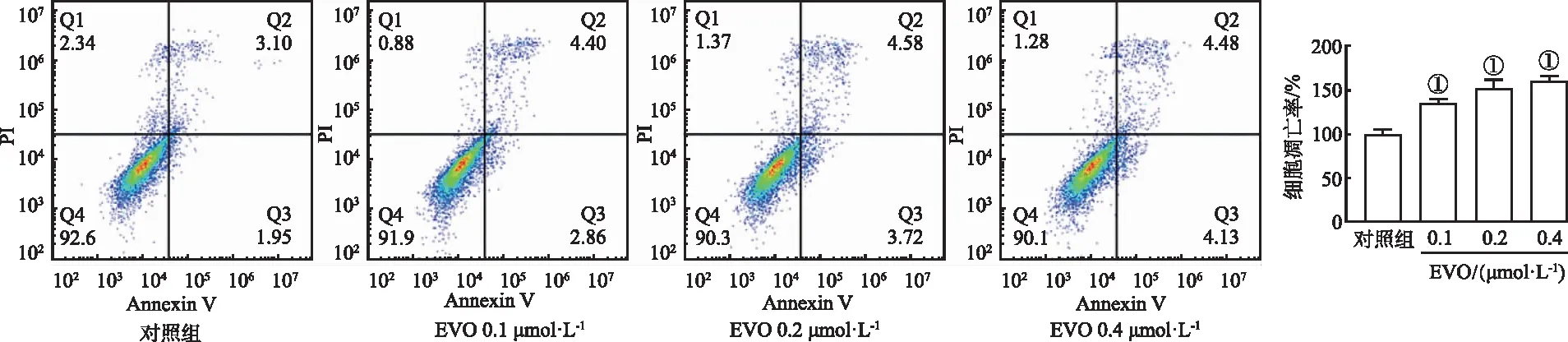
2.4CoCl2体外模拟缺氧模型的建立及CoCl2对HUVECs糖酵解代谢的影响 不同浓度CoCl2干预HUVECs 24 h,MTT检测结果见图4,随着CoCl2浓度的增加,HUVECs增殖有所增加,CoCl2作用浓度≤50 μmol L-1时,HUVECs增殖活性没有受到明显影响,也没有细胞毒性;100~400 μmol·L-1CoCl2明显促进生存率(P<0.01),800 μmol·L-1CoCl2时HUVECs生存率明显下降,浓度过高出现细胞毒现象,可能是体外细胞的非特异性死亡,但这么高的浓度才有抑制生长作用也说明CoCl2的细胞毒性很低。
①与对照组(0 μmol·L-1CoCl2)比较, t=-15.337~5.109,P<0.01。
Western blotting检测结果(图4)显示,常氧对照组HIF-1α蛋白表达水平很低,而随着CoCl2浓度的增加,CoCl2激活HIF-1α表达明显增加(P<0.01),说明CoCl2诱导的高表达HIF-1α的模型已成功建立。在HIF-1α高表达条件下,糖酵解关键酶PFKFB3与HIF-1α共同高表达,且均随CoCl2浓度升高而升高(P<0.01)。CoCl2浓度>5 μmol·L-1可显著提高HIF-1α的表达,但>50 μmol·L-1明显影响生存率,因此模拟缺氧模型的CoCl2合适浓度范围为5~50 μmol·L-1,选择对HUVECs生存率影响较小又显著提高HIF-1α蛋白表达的20 μmol·L-1CoCl2来建立模拟缺氧模型。
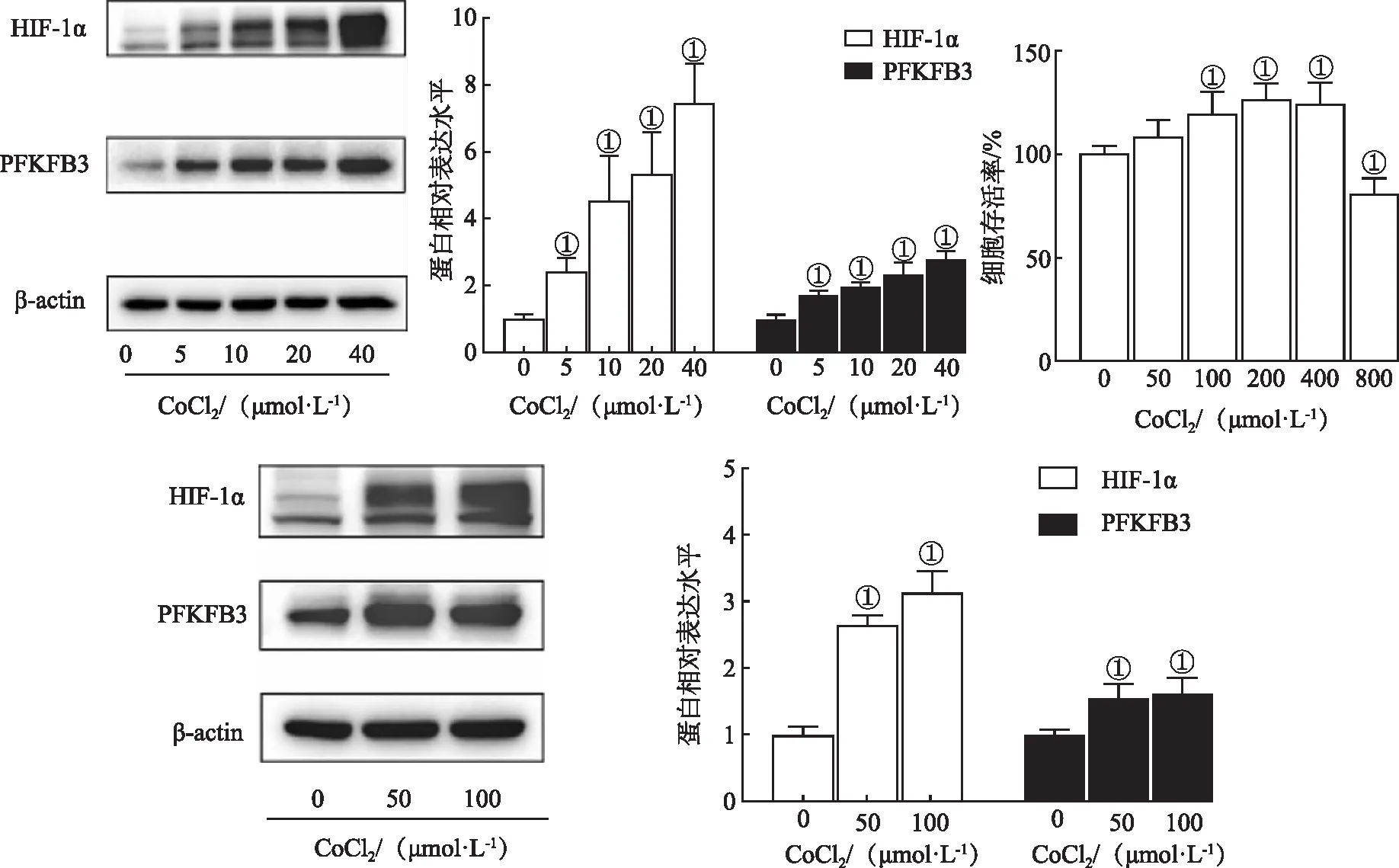
2.5EVO对内皮细胞代谢机制的影响 Western blotting结果(图5)显示,在常氧条件下EVO组HIF-1α、PFKFB3蛋白没有明显改变,而在CoCl2组即模拟缺氧模型组中HIF-1α、PFKFB3表达皆非常显著地升高(P<0.01),并且联合组(EVO+CoCl2)被CoCl2上调的HIF-1α、PFKFB3蛋白表达均受到EVO抑制(P<0.01),说明EVO在模拟缺氧条件下才抑制HIF-1α、PFKFB3,在常氧下没有此作用。HIF的激动剂CoCl2能上调EVO对PFKFB3的作用(P<0.05),说明EVO对PFKFB3的抑制是通过抑制HIF实现的。
①与对照组比较,t=-17.379~-4.670,P<0.01;②与EVO组比较,t=-3.202、-2.886,P<0.05;③与CoCl2组比较,t=4.196、9.350,P<0.05; ④与对照组比较,t=-4.255、-3.188,P<0.05;⑤与CoCl2组比较,t=26.963、4.387,P<0.01;⑥与EVO组(0.2、0.4 μmol·L-1)比较,t=-2.526、-3.836、-5.107,P<0.01。
在常氧条件下VEGFR2蛋白表达在EVO组中明显下调(P<0.01),而在CoCl2组中明显升高,说明HIF-1α能上调VEGFR2表达,在联合组中VEGFR2蛋白表达仍受到EVO明显抑制(P<0.01),联合组与EVO组的抑制作用相差不大,说明CoCl2不能逆转EVO对VEGFR2的抑制,EVO下调VEGFR2不是通过HIF通路实现的,也就是说,EVO可独立地抑制VEGFR信号通路。
MTT检测结果显示,CoCl2作用浓度为20 μmol·L-1时,HUVECs增殖活性没有受到明显影响,在EVO浓度为0.4 μmol·L-1时,HUVECs增殖活性受到明显抑制(P<0.01);在模拟缺氧条件下0.4 μmol·L-1EVO仍能抑制细胞增殖生长(P<0.01),但此抑制作用被CoCl2减弱,即CoCl2能够逆转EVO对细胞增殖生长的抑制作用(P<0.05),说明EVO是通过HIF抑制HUVECs增殖生长。
3 讨论
20世纪20年代,德国生物化学家Otto Warburg发现,与正常细胞比较,快速增殖的腹腔积液肿瘤细胞以惊人的高速率消耗葡萄糖,但它并不是完全用于氧化生成CO2和H2O,而是以乳酸的形式分泌并堆积为主,这种现象被称为瓦伯格效应,即指癌细胞无论有氧还是无氧均可进行大量的糖酵解。有学者提出,除肿瘤细胞外,大量糖酵解适用于所有的增殖细胞[5]。由于肿瘤细胞恶性增殖,肿瘤中心区域严重的缺氧状态是大多数实体肿瘤普遍存在的现象,这导致了肿瘤细胞代谢的改变,肿瘤细胞可通过稳定缺氧诱导因子并诱导其下游靶基因的激活,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、代谢关键酶基因HK2等[8],当大量分泌的促血管生成因子超过抗血管生成因子占据主导地位时,血管内皮细胞迅速地从分裂的休眠状态中被唤醒,同时开始大量地增殖、迁移,同样需要高速率的糖酵解来满足其生物合成和能量需求,而增殖、迁移的内皮细胞逐渐形成管状样的病理性血管。目前抑制血管生成以饥饿肿瘤已成为临床批准的有效治疗方法,其中最经典的是阻断VEGF/VEGFR通路以抑制新生血管的生长[9],几乎在所有内皮细胞上都有表达VEGFR2,它主要通过与VEGFA结合后激活下游一系列的细胞信号通路,导致内皮细胞增殖、迁移以及肿瘤新生血管的形成。因此,建立体外模拟缺氧模型对于研究内皮细胞的代谢非常有必要。目前常用的有物理和化学2种缺氧模型,其中,物理缺氧模型是最好的选择,但由于其需要昂贵的仪器设备和更为严谨的操作而限制了推广应用。而以CoCl2化学诱导法建立的体外模拟缺氧模型在常氧条件下就能够稳定细胞内HIF-1α蛋白的表达,因此也得到了普遍的认可[10]。目前已有报道指出CoCl2对多种类型的肿瘤细胞刺激的敏感性和耐受性不同[11],因此需要确定CoCl2对HUVECs增殖影响较小又能显著激活HIF-1α蛋白表达的合适浓度以建立体外模拟缺氧模型。
EVO是中药吴茱萸的主要药效成分。吴茱萸始载于《神农本草经》,列为中品;《中华人民共和国药典》记载:吴茱萸,性热,味辛、苦,有小毒;归肝、脾、胃、肾经;功效:散寒止痛,降逆止呕。由吴茱萸、黄连组成的左金丸源自朱丹溪的《丹溪心法》,主治肝胃不和,中医临床多用于消化系统疾病,而消化系统肿瘤多伴有肝胃不和证。本课题组前期已证实EVO对多株人肝癌细胞有明显抑制增殖生长、抑制瓦伯格效应和诱导凋亡作用;并能明显抑制小鼠肝癌移植瘤生长和延长荷瘤小鼠生存期。有研究证明EVO可以下调人结直肠癌HCT116中HIF-1α、VEGFA基因和蛋白的表达[12],还可以降低移植瘤组织中β-连环蛋白、VEGFA蛋白的表达和CD31、CD34的水平[13]。尽管目前对肿瘤血管增生与内皮细胞代谢、Warburg效应的关系已有不少文献报道,但EVO通过抑制内皮细胞代谢抗血管增生未见文献报道。
本研究结果表明,EVO对HUVECs 24 h的IC50为1.15 μmol·L-1,故选择低于IC50的EVO浓度进行后续实验。常氧条件下,EVO对HUVECs的HIF-1α、PFKFB3没有明显下调作用,提示EVO对正常血管内皮细胞代谢没有影响;MTT检测结果表明在CoCl2作用浓度≤50 μmol·L-1时,HUVECs增殖活性没有受到明显影响,也没有细胞毒性,同时Western blotting检测结果显示HUVECs的HIF-1α蛋白表达水平显著高于常氧对照组,这表明以CoCl2化学诱导模拟缺氧模型建立成功,PFKFB3与HIF-1α共同高表达,且均随CoCl2浓度升高而升高,说明HIF-1α的高表达能促进内皮细胞的糖酵解,并选择模拟缺氧模型的CoCl2作用浓度为20 μmol·L-1。EVO仅在模拟缺氧模型中有下调PFKFB3的作用,只影响HIF高表达的血管内皮细胞的糖酵解。研究表明,阻断PFKFB3可使HUVECs增殖和迁移能力减弱,抑制了移植瘤中肿瘤血管的生成及诱导肿瘤血管正常化[14-15];在血液系统中毛细血管内皮细胞的糖酵解速率更快、增殖能力更强,并且在血管分支形成的过程中其糖酵解速率还会进一步提高[16]。因此,EVO在模拟缺氧条件下可能下调PFKFB3进而抗肿瘤血管增生。CoCl2不能逆转EVO下调VEGFR的作用,说明虽然HIF能影响VEGFR表达,但EVO抑制VEGFR不是必须通过HIF通路实现的,即EVO可能分别独立地抑制HIF、VEGFR这两条信号通路。综上所述,本研究显示EVO可能通过HIF和VEGFR通路抑制内皮细胞的瓦伯格效应及增殖,从而抗肿瘤血管增生。

