黄瓜F-box基因家族的鉴定与生物信息学分析
史艳 肖雅茹 李丽霞 李梅兰

关键词:黄瓜;F-box基因家族;生物信息学;表达分析
植物在生长过程中常受环境带来的胁迫伤害,在此过程中进化出多种调节机制来保障其生命活动的正常进行,其中,F-box蛋白参与的泛素-蛋白酶体途径(UPP)是最重要的调节机制之一[1],可参与细胞内80%以上蛋白质的降解,从而防御和缓解胁迫带来的损伤[2]。由Skp1、Cullin1、F-box构成的E3泛素连接酶复合物(SCF)是UPP途径关键组分[3],其中含有F-box结构域的F-box蛋白可特异性识别底物并与之结合,参与调控胞内蛋白降解、受体识别、信号传导等生物学过程[4-6]。
F-box基因广泛存在于各种植物中,其家族鉴定的重要标识是F-box结构域,该结构域在物种进化中较为保守,由位于N端的40~50个氨基酸组成,可与C端其他结构域结合共同发挥作用[7]。随着第1个F-box基因UFO(Unusualfloralorgans)在拟南芥中被鉴定[8],對F-box基因的研究越来越深入,例如,F-box蛋白ACRE189/ACIF1通过调节茉莉酸和脱落酸的基因表达来参与防御反应[9];葡萄中分离出的F-box基因(BIG-24.1)在葡萄叶片感染灰霉病期间高表达,使植株表现出抗性增强[10];水稻F-box蛋白MoFwd1与MoSkp1相互作用,抑制分生孢子萌发,从而降低稻瘟病菌的致病性[11]。目前F-box基因家族已经在玉米[12]、小麦[13]、陆地棉[14]、番茄[15]、蚕豆[16]等作物中进行了全基因组鉴定及详细分析,但在主要蔬菜作物黄瓜(CucumissativusL.)中的研究较少。
本研究基于黄瓜基因组数据,利用生物信息学方法鉴定黄瓜F-box基因家族成员,系统分析了其基因结构、染色体定位、保守基序、蛋白质理化性质和结构、顺式作用元件及系统进化关系等特性,以及在不同生物胁迫下的表达模式,为进一步探究黄瓜F-box家族基因功能奠定理论基础。
1 材料和方法
1.1 黄瓜F-box基因家族获取与鉴定
从Pfam数据库查找下载拟南芥F-box保守结构域(Pfam号:PF00646)文件,在葫芦科作物基因组网站(http://cucurbitgenomics.org/)下载黄瓜的全基因组数据(cucumber_ChineseLong_v2_genome.fa)和蛋白质数据(cucumber_ChineseLong_v2_pep.fa)。通过HMMER3.0软件查找含有F-box保守结构域的黄瓜基因,设置E-value<10-5,作为F-box基因家族的候选成员。利用TBtools软件调取候选家族成员的氨基酸序列,通过NCBI中的CD-search功能鉴定候选成员保守结构域的完整性并去除冗余,具有完整F-box结构域的候选基因即为黄瓜F-box基因家族成员。
1.2 黄瓜F-box基因染色体定位分析
从葫芦科作物基因组网站下载黄瓜基因的gff文件,通过TBtools软件调取基因位置信息,利用在线网站MG2C-v2.0(http://mg2c.iask.in/mg2c_v2.0/)绘制染色体定位图并进行修饰。
1.3 黄瓜F-box基因结构和Motif分析
将F-box家族基因的CDS和基因全长的fasta文件导入GSDS2.0(http://gsds.gao-lab.org/index.php)进行黄瓜F-box基因结构分析。使用在线网站MEME(https://meme-suite.org/meme/tools/meme)进行保守基序分析,Motif参数设置为10[17],并利用TBtools软件对黄瓜F-box蛋白的保守基序进行可视化。
1.4 黄瓜F-box蛋白理化性质分析
将筛选出的F-box家族成员通过TBtools软件调取其氨基酸序列,并利用在线网站ExPASy(https://web.expasy.org/protparam/)进行理化性质的分析。
1.5 黄瓜F-box基因家族亚细胞定位与二、三级结构预测
通过在线网站Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/#)对黄瓜F-box基因家族蛋白进行亚细胞定位。利用SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线分析工具分析蛋白质的二级结构。通过在线网站SWISS-MODEL(https://swissmodel.Expasy.org/)对黄瓜F-box基因家族的蛋白质序列进行三级结构模型预测。
1.6 黄瓜F-box基因家族启动子顺式作用元件分析
利用在线分析网站PlantCARE(http://bioin?formatics.psb.ugent.be/webtools/plantcare/html/)中的SearchforCARE功能对黄瓜F-box基因家族起始密码子ATG上游2000bp的序列进行启动子顺式作用元件分析。
1.7 黄瓜F-box基因家族系统进化树分析
将黄瓜F-box基因家族的氨基酸序列使用MEGA7.0软件利用邻接法(Neighbor-joining,NJ)构建系统发育树,bootstrap设为1000[18]。利用在线网站iTOL(https://itol.embl.de/)对进化树进行美化。
1.8 黄瓜F-box基因的表达模式分析
利用前人报道的黄瓜RNA-seq数据信息,获取黄瓜在霜霉菌[19]和丁香假单胞菌[20]胁迫下F-box家族基因的表达量(每百万reads中来自某基因每千碱基长度的reads数,RPKM)信息,进行基因表达模式分析,以探讨F-box家族基因在防御生物胁迫方面的调节机制。
2 结果与分析
2.1 黄瓜F-box基因家族成员鉴定与染色体定位分析
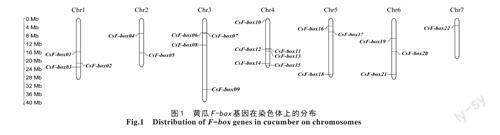
根据拟南芥F-box保守结构域信息在黄瓜基因组数据库筛选,并验证候选基因蛋白序列的保守性,结果显示,有22个与F-box保守结构序列高度匹配的蛋白序列(E-value<10-5),且不均匀分布在黄瓜7条染色体上(图1)。其中,4号染色体上被定位的基因最多,为6个,其次是3号染色体上有4个基因,1号、5号和6号染色体分别含有3个基因,2号染色体有2个基因,7号染色体有1个基因。依据22个基因在染色体上的排列顺序,依次命名为CsF-box01~CsF-box22。
2.2 黄瓜F-box基因结构和蛋白保守基序分析
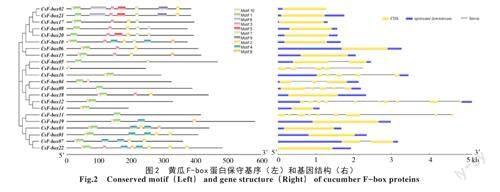
对22个家族成员进行基因结构分析,由图2可知,不同基因的长短各异,所含的外显子和内含子的数目和位置也存在差异。其中,有8个基因为断裂基因,外显子数目为2~10个;CsF-box12基因长度最长,且外显子个数最多;除基因CsF-box13、CsF-box11外,其余基因兩端均含有上游或下游结构。对黄瓜22个F-box基因进行多重序列比对和系统进化分析后,22个F-box基因划分为3类。根据进化关系的远近分析,位于同一分支上的基因结构具有相似性,例如第一类(CsF-box02、CsF-box06、CsF-box08、CsF-box10、CsF-box15、CsF-box17、CsF-box20、CsF-box21)的基因均只含有1个外显子无内含子,除基因CsF-box02外,其余基因两端均含有上游和下游结构。这说明黄瓜F-box基因家族在进化过程中是相对保守的。
对黄瓜F-box基因家族成员的保守基序进行分析,共鉴定出10个保守基序(图2),命名为Motif1~Motif10。除CsF-box13外,其余家族成员均含有Motif1,说明F-box基因家族相对保守。基于进化关系,家族成员可分为3类,每一类的基因保守基序具有相似性,第1类基因含有的Motif种类最多,为4~8个;第2类种类最少,除CsFbox09、CsF-box13外,均只含有Motif1和Motif10;第3类中,除CsF-box11只含有Motif1外,其余均含有Motif10、Motif4和Motif2。
2.3 黄瓜F-box蛋白质理化性质分析
对黄瓜F-box基因家族的编码蛋白进行理化性质分析,结果显示(表1),黄瓜F-box基因家族的编码蛋白的氨基酸数目和分子质量变化一致,其中,CsF-box14氨基酸数和分子质量最小,最大的是CsF-box19;等电点为5.10~9.71,有12个酸性蛋白,10个碱性蛋白;不稳定系数为33.59~62.59,其中,CsF-box01、CsF-box15、CsF-box21的不稳定系数小于40,为稳定蛋白,其余均为不稳定蛋白;亲水系数显示,有20个家族成员的亲水系数为负值,编码蛋白为亲水蛋白,2个成员为正值,为疏水蛋白。
2.4 黄瓜F-box蛋白亚细胞定位及二、三级结构预测
对黄瓜F-box基因家族编码蛋白的亚细胞定位结果分析(表2),发现有5个家族成员的编码蛋白被定位到细胞核中,12个被定位到细胞质中,3个被定位到线粒体中,CsF-box06编码蛋白被定位到细胞核和细胞质中,CsF-box10编码蛋白被定位到细胞质和线粒体中。对F-box基因家族成员进行了二级结构预测(表2),结果显示,55%家族成员的二级结构主要由延伸链和无规则卷曲构成,45%的家族成员主要由α-螺旋和无规则卷曲构成。为了探讨蛋白质二级结构预测的准确性,对22个家族成员的三级结构进行模型预测,结果如图3所示,预测的蛋白三级结构与二级结构基本一致。
2.5 启动子顺式作用元件分析
为了探究黄瓜F-box基因家族的功能,进行了启动子顺式作用元件分析,共鉴定出18个启动子顺式作用元件(图4)。根据功能不同分为4类,分别为光响应元件(3个)、激素响应元件(5个)、生长发育相关元件(5个)、胁迫响应相关元件(5个)。对启动子的分析表明,黄瓜F-box基因家族可参与调控黄瓜生长发育和抗逆反应紧密相关的多个代谢通路。
2.6 黄瓜F-box基因家族系统进化树分析
蛋白的氨基酸序列,与黄瓜22个F-box蛋白序列一起构建系统进化树,以探讨黄瓜F-box基因家族与其他物种的亲缘关系。如图5所示,黄瓜F-box基因家族可分为4个亚组,分别将其命名为第Ⅰ~Ⅳ亚族,每个亚组分别含有3、6、5、8个基因。从整体来看,黄瓜F-box家族成员与拟南芥的亲缘关系最近。在第Ⅰ亚组中,CsF-box09与AtF-box18、CsF-box05与AtF-box16分别聚为一小支,亲缘关系较近;第Ⅱ亚组中,CsF-box11与AtF-box05、CsF-box13与AtF-box01、CsF-box04与AtF-box12具有很强的同源性;第Ⅲ亚组中,CsF-box01、CsFbox03、CsF-box07、CsF-box22和SmF-box08关系紧密;第Ⅳ亚组中,CsF-box20与SlF-box06、CsFbox17与SmF-box05、CsF-box19与SmF-box04分别聚合在一个分支。
2.7 黄瓜F-box基因在生物胁迫下的表达模式分析
利用前人发表的黄瓜RNA-seq数据库,提取F-box家族基因表达信息,用于分析黄瓜F-box家族基因对霜霉病的响应模式。结果表明,在霜霉菌胁迫下有8个F-box家族基因在抗性品系IL51(R)和易感品系IL53(S)中差异表达(图6-A),其中,CsF-box08、CsF-box12、CsF-box21这3个基因随霜霉菌处理时间增长呈现表达量升高的趋势,相反地,基因CsF-box01、CsF-box09、CsF-box20和CsFbox14则随处理时间增长呈现出表达量下降的趋势。这说明该家族基因参与了霜霉菌侵染早期的响应途径,但其响应模式存在较大差异,基因间还可能存在拮抗作用。值得注意的是,基因CsFbox04只在抗性品系中表达量较高,而在易感品系中表达量较低,且在同品系内霜霉菌处理后的差异并不明显,因此,推测该基因可能是导致IL51和IL53对霜霉菌产生不同抗性的原因之一。
根据已发表的黄瓜细菌性叶斑病的转录组数据,提取丁香假单胞菌接种0、1d抗性品系Gy14和感病品系B10的基因表达信息,以探讨F-box家族基因在丁香假单胞菌胁迫早期的表达模式。结果发现,有2个F-box家族基因在抗性品系Gy14和感病品系B10中差异表达(图6-B)。其中,CsF-box09基因在Gy14和B10未接种丁香假单胞菌时表达量较高,但在接种1d时表达量较低;相反地,CsFbox10基因在未接种丁香假单胞菌时表达量较低,而接种1d时表达量较高。因此,推测CsF-box09可能负向调控黄瓜对细菌性叶斑病的抗性,而基因CsF-box10则与之相反,可能在调控黄瓜细菌性叶斑病抗性方面起积极作用。
3 结论与讨论
本研究通过生物信息学分析发现,黄瓜F-box基因家族编码蛋白绝大多数为不稳定的亲水蛋白,且45%F-box蛋白显示为碱性,这与油菜[21]和茶树[22]F-box蛋白理化性质分析结果一致。F-box蛋白亚细胞定位主要位于细胞质中,可能参与了细胞内某些物质的合成与降解,而苹果[23]和蚕豆[24]中的F-box蛋白主要定位到细胞外,可能参与了胞外某些特定的生物学过程,这种差异可能是由于基因在不同物种进化过程中产生了某种特定功能的分化造成的。根据亲缘关系的远近,位于同一类别的基因结构与保守基序具有相似性,由此推测F-box基因家族成员之间具有较高的保守性。启动子顺式作用元件分析发现,黄瓜F-box基因家族含有大量激素响应相关作用元件,其中,茉莉酸甲酯[25-26]、脱落酸[27-28]、水杨酸[29-30]、生长素[31]、赤霉素[32]是植物获得抗性的重要调节剂,F-box基因可能是通过参与植物激素信号传导过程,来响应胁迫反应[33]。
黄瓜在生产过程中常遭遇各种胁迫,其中以霜霉病、细菌性叶斑病、白粉病为代表的叶片病害尤为常见。在病害暴发时,黄瓜轻则减产20%~30%,重则造成毁灭性损害。为探究黄瓜F-box基因在生物胁迫下的作用,对其进行了表达模式分析,结果表明,F-box基因参与了霜霉菌和丁香假单胞菌胁迫下黄瓜的防御途径,在一定程度上缓解了生物胁迫带来的损伤。由进化树可知,CsF-box01与SmF-box08、CsF-box14与SmF-box02、CsF-box21与SmF-box07亲缘关系较近,推测其结构与功能可能存在相似性。其中SmF-box08(Kelch结构域)是茄子对细菌性叶斑病抗性起正调控作用的候选基因[34];SmF-box02编码EBF1蛋白[34],EBF1可抑制乙烯(Eth)的信号传导[35];SmF-box07(LRR结构域)在茄子对细菌性叶斑病抗性起负调控作用[34]。基因CsF-box01(含有Kelch结构域)、CsF-box14(编码EBF1蛋白)、CsF-box21(LRR结构域)在霜霉菌胁迫下差异性表达,因此,推测CsF-box01正向调控黄瓜对霜霉病的抗性,CsF-box14可能通过抑制乙烯信号转导来调控黄瓜对霜霉病的抗性,CsF-box21可能在黄瓜霜霉病抗性方面起负调控作用。AtF-box18基因编码EID1蛋白为脱落酸的信号传导的负调控因子,可增强植物对温度、干旱、盐引起的非生物胁迫的抗性[36]。由进化树可知,基因CsF-box09与AtF-box18聚为一支,具有高度同源性。且CsF-box09在霜霉菌和丁香假单胞菌胁迫下差异表达,并含有脱落酸反应元件,因此,推测基因CsF-box09可能负调控脱落酸的信号传导来增强对霜霉病和叶斑病的抗性。CsF-box04同源基因AtF-box12编码的F-box-Nictaba蛋白被证明是一种可结合N-乙酰乳糖胺的功能性凝集素,可参与水杨酸相关通路的植物防御反应,在拟南芥中过表达该基因可减轻由丁香假单胞菌胁迫造成的伤害[37]。CsF-box04基因含有水杨酸反应元件,并在抗性品系中表达量较高,因此,推测该基因是通过参与水杨酸相关防御通路来增强对病原菌的抗性。
本研究通過生物信息学的方法共鉴定出22个CsF-boxes,其分布在7条染色体上,均含有F-box(PF00646)结构域,大多数成员含有Motif1基序,且在细胞质和细胞核中均有分布。CsF-boxes启动子区存在大量与激素响应、生长发育和胁迫响应相关顺式作用元件。对霜霉菌和丁香假单胞菌胁迫后叶片中CsF-boxes基因表达模式进行分析,发现分别有8、2个F-boxes基因在病原菌胁迫下差异性表达,其表达模式多样。其中,CsF-box09与AtFbox18、CsF-box04与AtF-box12为同源基因,且CsF-box09和CsF-box04分别含有脱落酸、水杨酸反应元件,因此,推测CsF-box09负调控脱落酸信号转导来增强抗病性,CsF-box04则是通过参与水杨酸相关防御通路正向调控黄瓜霜霉病抗性。该结果为深入研究黄瓜F-box基因的生物学功能及响应生物胁迫机制提供了参考。

