超声波法提取野生蒲公英植株及花中黄酮类化合物的研究
曹丽丽,曲妍,纪德清
(黑龙江八一农垦大学理学院,大庆 163319)
蒲公英是一种非常常见的多年生草本植物,具有抑菌和抗氧化等作用[1-3],蒲公英植株[4]和蒲公英花中[5]的黄酮类化合物含量都比较高。早在1985 年,WolbisMaria 等[6]就曾对蒲公英花进行过色谱分析,并从中检出20 种黄酮类化合物。黄酮类化合物具有较强的防止氧化、衰老、预防心脑血管疾病、抗肿瘤、消炎、镇痛、利胆、保肝等功效[7],常用于冠心病、心绞痛治疗的舒血宁片中就含有黄酮类化合物。研究发现黄酮类化合物对人体健康十分重要,由于人体不能直接合成黄酮类化合物,只能通过食用富含黄酮类化合物的食物来满足人体对黄酮的需求,野生的蒲公英就是廉价、易得获取黄酮类化合物的来源之一。蒲公英野生资源极为丰富,对食品、保健品和药品行业来说具有很高的开发价值[8]。
目前,蒲公英中所含的黄酮类化合物的提取方法主要有回流法、超声波法、微波法和超临界流体萃取法等[9]。金京玲等[10]采用传统热回流法提取蒲公英中的黄酮类化合物,结果表明碱地蒲公英中黄酮类化合物含量为4.16%。贾娟等[11]采用超声波和微波法提取蒲公英中的黄酮类化合物,结果表明超声法得率为1.9121%,微波法得率为2.406 6%,微波法提取效果更好。范萌等[12]利用乙醇浸提法提取蒲公英中的黄酮类化合物,黄酮类化合物提取率为4.86%。朱庆莉等[13]通过超临界CO2流体萃取工艺对蒲公英中的黄酮类化合物进行提取,初步探讨了黄酮类化合物对淀粉液化芽孢杆菌、大肠杆菌和黑曲霉均具有一定程度的抑制效果;史易暖[14]研究发现蒲公英中黄酮类化合物对乳腺癌细胞具有一定的影响。但目前对于蒲公英不同部位(蒲公英植株和蒲公英花)有效成分的含量分析及比较,以及各部位的性质、特点、应用等研究还不多见。
试验以大庆地区野生蒲公英植株和蒲公英花作为原料,利用超声波法以乙醇为提取溶剂对其中的黄酮类化合物进行提取,经可见光谱和红外光谱测试对黄酮类化合物粗提液成分进行了定性分析[15],以期为蒲公英植株及蒲公英花的成分的进一步研究及其深加工提供参考。
1 材料和方法
1.1 材料与试剂
蒲公英植株和蒲公英花,黑龙江八一农垦大学校园;无水乙醇,分析纯,天津市科密欧化学试剂有限公司;硝酸铝,分析纯,天津市福晨化学试剂厂;亚硝酸钠,分析纯,沈阳新兴试剂厂;芦丁标准品,江西佰草源生物科技有限公司。
1.2 主要仪器
T6-1650E 紫外-可见分光光度仪:北京普析通用仪器有限责任公司;Nicolet iS5 红外光谱仪:赛默飞世尔科技有限公司;ALC-310.3 电子分析天平:上海精密科学仪器有限公司;KH-500DE 数控超声波清洗器:昆山禾创超声仪器有限公司;HH-1 数显恒温水浴锅:江苏维纳太科仪器有限公司。
1.3 试验方法
1.3.1 样品预处理
采集带花的蒲公英,将植株和花分离后分别洗净晒干,粉碎,密封冷藏,备用。
1.3.2 最大吸收波长的测定
黄酮类化合物和芦丁结构中都含有2-苯基色原酮,具有相同的吸光特性,因此,试验选用芦丁作为标准品溶液[16]进行最大吸收波长的测定和标准曲线的建立。参考相峰[17]的方法并稍作修改,具体步骤如下:准确称取12.5 mg 芦丁标准品,用60%的乙醇溶剂溶解后定容至50 mL,此时溶液浓度为0.25 mg·mL-1。吸取上述容量瓶中溶液2.00 mL 于25 mL 容量瓶中,采用亚硝酸钠-硝酸铝比色法进行下一步溶液的配制;首先向容量瓶中加入0.50 mL 的亚硝酸钠(10%)溶液,摇匀并充分反应5 min;再向其中加入2.00 mL 硝酸铝溶液(5%);摇匀并充分反应5 min 后用60%的乙醇定容。在400~700 nm 范围内进行吸光度的测定,吸光度最大处所对应的波长为芦丁标准溶液的最大吸收波长。
1.3.3 标准曲线的建立
分别准确吸取0、1.00、2.00、3.00、4.00、5.00 mL和6.00 mL 1.3.2 中的芦丁标准溶液于7 个25 mL 容量瓶中,采用与上述1.3.2 中相同的比色法进行溶液的配制。以1.3.2 测得的最大吸收波长为入射光波长,分别测定上述7 个不同浓度溶液的吸光度。最后根据计算出的7 个溶液的浓度和测得的吸光度绘制标准曲线。
1.3.4 单因素试验
(1)用分析天平准确称取1 g 蒲公英植株和蒲公英花干粉,用60%乙醇溶液浸提,分别改变料液的配比〔1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)〕,于50 ℃下超声30 min,超声功率300 W。
(2)用分析天平准确称取1 g 蒲公英植株和蒲公英花干粉,用60%乙醇溶液浸提,分别改变超声时间(20、30、40、50、60 min),于50 ℃下及料液比1∶40 的条件下进行提取,超声功率300 W。
(3)用分析天平准确称取1 g 蒲公英植株和蒲公英花干粉,用60%乙醇溶液浸提,分别改变超声温度(40、50、60、70、80 ℃),于料液比1∶40 的条件下超声40 min,超声功率300 W。
按照上述条件对蒲公英植株和花中的黄酮类化合物进行提取。将过滤后的粗提液用吸量管准确移取2.00 mL 于25 mL 容量瓶中,按照1.3.2 配制标准溶液的试验步骤进行粗提液的配制,考察各单因素不同水平对蒲公英植株和花中黄酮类化合物的影响。在测得的最大吸收波长处测定上述粗提液的吸光度,根据1.3.3 中所得的标准曲线方程由吸光度计算出蒲公英植株和花的粗提液中黄酮类化合物的得率,从而确定较优的提取条件。黄酮类化合物得率的计算方法为[15]:
式中:C:根据标准曲线方程计算得到的粗提液中黄酮类化合物的浓度(μg·mL-1);V:粗提液的体积(mL);N:粗提液的稀释倍数;M:蒲公英植株或蒲公英花的质量(g)。
1.3.5 正交试验设计
通过单因素试验确定每个因素的水平范围,即选取得率最大处及其前后两个点作为每个因素的水平值,再结合料液比、超声时间、温度三个因素,设计正交试验,以探寻蒲公英植株和花中黄酮类化合物提取条件的最优组合。表1 和表2 为所设计的正交试验因素水平表。

表1 蒲公英植株正交试验因素水平表Table 1 Factor level table of dandelion plant orthogonal test

表2 蒲公英花正交试验因素水平表Table 2 Factor level table of dandelion flower orthogonal test
1.3.6 黄酮类化合物的定性表征
可见光谱法:取1.3.4 中配制好的蒲公英植株和蒲公英花的粗提液,在400~700 nm 波长范围内进行光谱扫描,并与1.3.2 中芦丁标准品溶液的可见吸收光谱进行对比,初步确定粗提液的成分。
红外光谱法:在波数为4 000~500 cm-1的范围内,对芦丁标准品、蒲公英植株、蒲公英花粗提液进行测试,并根据各基团吸收峰范围,将蒲公英植株、蒲公英花红外光谱与芦丁标准品的红外光谱进行对比,进一步确定粗提液的成分。
2 结果与分析
2.1 最大吸收波长的确定
芦丁标准品溶液在400~700 nm 波长范围内的最大吸收波长见图1。

图1 芦丁标准溶液的可见吸收光谱Fig.1 Visual absorption spectrum of rutin standard solution
图1 表明:在测定的可见光波长范围内,最大吸光度处所对应的波长为510 nm。因此,试验以510 nm为最大吸收波长确定蒲公英植株和花中的黄酮类化合物。
2.2 标准曲线的绘制
根据1.3.3 测定结果绘制的芦丁标准品的标准曲线。根据朗伯比尔定律对曲线进行线性拟合,拟合后的标准曲线方程为:y=0.007 91 x,方程的决定系数R2=0.999 6。
2.3 单因素试验结果分析
2.3.1 蒲公英植株中黄酮类化合物的提取
不同料液比条件下,蒲公英植株中黄酮类化合物的得率变化情况如图2(a)示。在料液比为1∶40 之前,料液比增大,蒲公英植株中黄酮类化合物的得率增加;在料液比为1∶40 之后,随着溶剂用量的增大,蒲公英植株中黄酮类化合物的得率稍有下降;得率在料液比为1∶40 处最大。这主要是由于溶剂用量增加的同时,黄酮类化合物与溶剂的接触空间(或面积)也增加了,此时黄酮类化合物的溶解平衡向溶解方向移动,因此得率也随之增加。但是当料液比增大到一定程度,乙醇溶剂中黄酮类化合物基本达到饱和状态而使溶解过程达到平衡而不再发生移动,得率基本不会再增加[18]。

图2 各因素对蒲公英植株中黄酮类化合物得率的影响Fig.2 Effect of various factors on the extraction rate of flavonoids from dandelion plants
蒲公英植株中黄酮类化合物得率随提取时间的变化如图2(b)所示。超声时间从20 min 增加至40 min,得率从2.80%增加到4.50%;当时间从40 min 增加至60 min,得率却由4.50%降至3.56%,黄酮类化合物的得率在40 min 处达到峰值。这是因为蒲公英植株中的黄酮类化合物溶解到溶剂中的这一过程达到平衡需要时间,时间较短,黄酮类化合物没有被完全浸提出来,得率较低;而时间过长则会使已经被浸提出来的黄酮类化合物发生氧化,浓度降低,得率也会随之下降[19]。所以,蒲公英植株中黄酮类化合物的最佳提取时间为40 min。超声波提取法能够使溶剂的机械振动加快,从而使溶解速度加快,试验在40 min的得率可达4.50%,而热回流提取法90 min 的得率仅为4.16%[10]。
图2(c)是不同温度下,蒲公英植株中黄酮类化合物得率的变化情况。温度在40 ℃至60 ℃区间内得率急剧增大,温度到达60 ℃时得率最高为4.12%;温度再升高得率明显下降。其中一个原因是:温度升高,分子的运动加剧,从动力学角度来看溶解速度迅速增大,从而使蒲公英植株中的黄酮类化合物快速溶解到溶剂中;但温度达到某一值后,溶解主要受热力学控制而达到平衡。另一原因是因为高温条件加速了黄酮类化合物的氧化反应[20]。因此蒲公英植株中黄酮类化合物的最佳提取温度为60 ℃。
2.3.2 蒲公英花中黄酮类化合物的提取
不同料液比条件下,蒲公英花中黄酮类化合物的得率情况如图3(a)所示。当料液比在1∶40 之前,随着溶剂用量的增大,蒲公英花中黄酮类化合物的得率呈线性增加;在料液比为1∶40 之后,随着溶剂用量的增大,蒲公英花中黄酮类化合物的得率呈现不明显的减小趋势。其原因与蒲公英植株中黄酮类化合物的提取相似,由此可知提取蒲公英花中黄酮类化合物的最佳料液比为1∶40。

图3 各因素对蒲公英花中黄酮类化合物得率的影响Fig.3 Effect of various factors on the extraction rate of flavonoids from dandelion flowers
图3(b)为不同提取时间条件下,蒲公英花中黄酮类化合物的得率变化情况。超声时间在50 min 时,对蒲公英花中黄酮类化合物的提取效果最好,得率最大;在50 min 前,得率随着超声时间的增加而增加;在超声时间超过50 min 之后,得率呈下降趋势。原因与蒲公英植株中黄酮类化合物的提取相似,提取蒲公英花中黄酮类化合物的最佳超声时间为50 min。
蒲公英花中黄酮类化合物的得率随温度的变化如图3(c)所示,得率最大出现在温度60 ℃处。在40~60 ℃之间,黄酮类化合物的得率与温度呈正相关;60 ℃以后,黄酮类化合物的得率与温度呈负相关。原因与蒲公英植株中黄酮类化合物的提取相似,蒲公英花中黄酮类化合物的最佳提取温度为60 ℃。
2.4 正交试验结果分析
表3、表4 为三因素三水平正交试验设计表及结果。
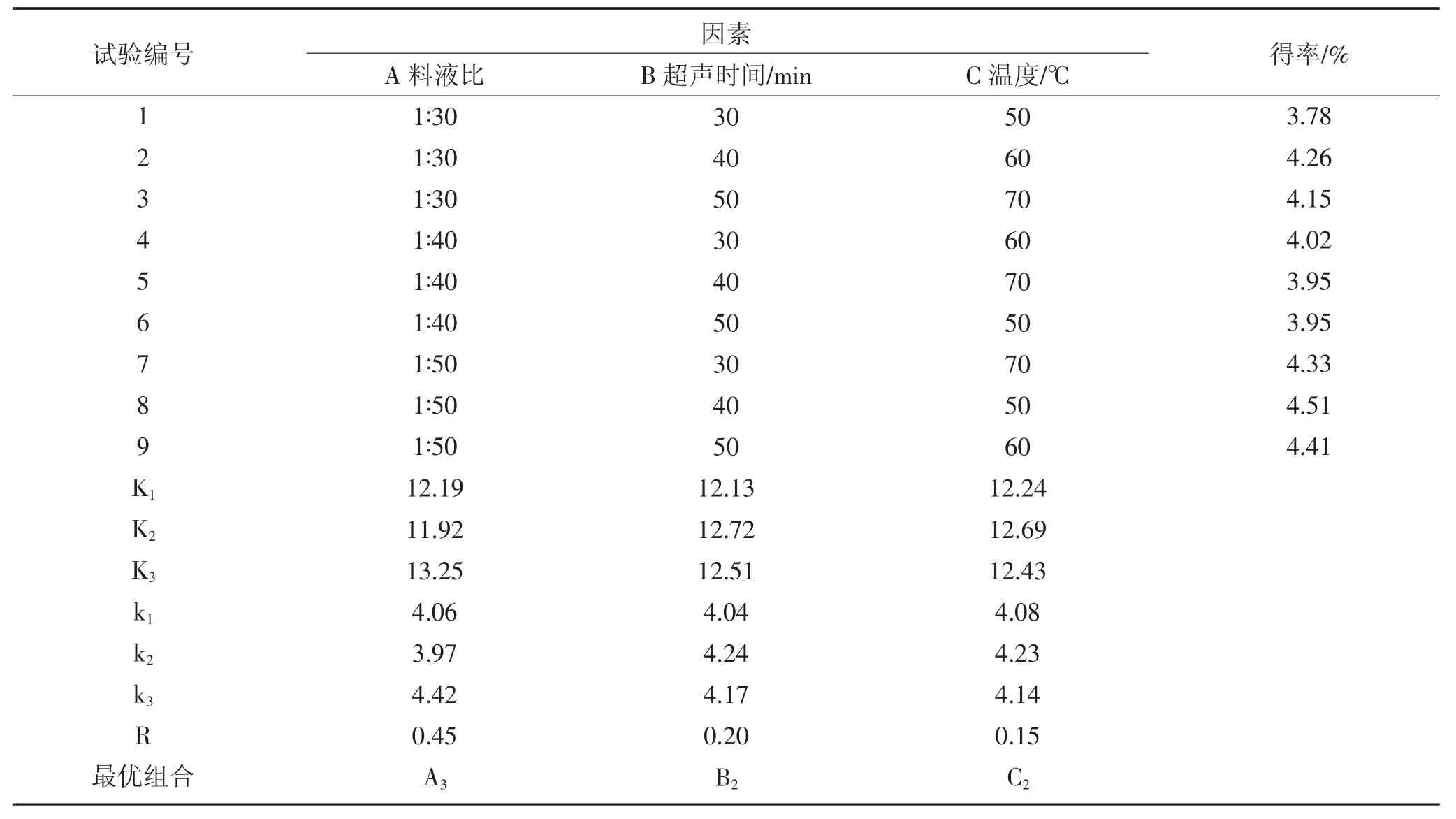
表3 L9(33)正交试验设计及结果(蒲公英植株)Table 3 Orthogonal experimental design and results of L9(33)(dandelion plant)
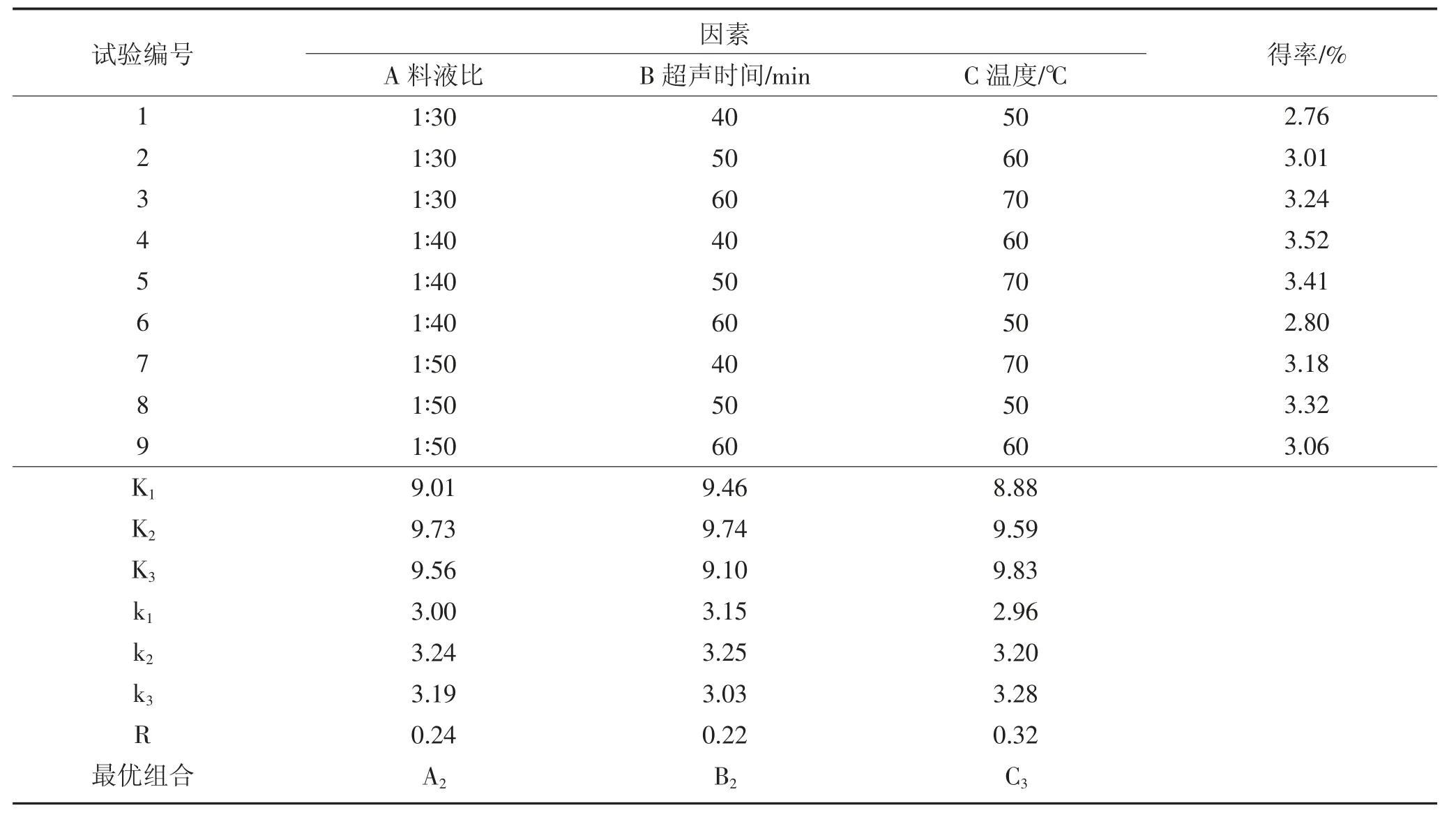
表4 L9(33)正交试验设计及结果(蒲公英花)Table 4 Orthogonal experimental design and results of L9(33)(dandelion flowers)
根据表3 中试验数据,在提取过程中选取的三个影响因素中,影响蒲公英植株中黄酮类化合物得率最为明显的因素是A,其次为B、C,即主次顺序为:料液比>超声时间>温度。在试验范围内提取蒲公英植株中黄酮类化合物的最优组合为A3B2C2,对应表1 中的料液比1∶50(g∶mL),超声时间40 min,温度60 ℃。
由表4 试验结果可知,三个影响因素中,对蒲公英花中黄酮类化合物的提取效果影响最大的为C,其次为A、B,即主次顺序为:温度>料液比>超声时间。在试验范围内提取蒲公英花中黄酮类化合物的最优组合为A2B2C3,对应表2 中的料液比1∶40(g∶mL),超声时间50 min,温度70 ℃。
2.5 验证试验
在蒲公英植株和蒲公英花的最佳提取工艺条件下,即蒲公英植株∶料液比1∶50(g∶mL),超声时间40 min,温度60 ℃;蒲公英花∶料液比1∶40,超声时间50 min,温度70 ℃,对蒲公英植株与蒲公英花中的黄酮类化合物进行了提取,得率分别为,蒲公英植株:4.86%、蒲公英花:3.95%。与范萌等[12]通过Design-Expert 软件设计的响应面优化实验所得的蒲公英植株中黄酮类化合物的得率相当。
2.6 黄酮类化合物的表征与定量检测
2.6.1 粗提液的可见吸收光谱
如图4 所示,蒲公英植株和花的可见吸收光谱与标准品的可见吸收光谱基本一致,最大吸收峰所对应的波长都是510 nm。由此得知,蒲公英植株和花的粗提液成分与芦丁标准溶液成分基本一致。

图4 芦丁标准品、蒲公英植株和蒲公英花提取液的可见吸收光谱图Fig.4 Visual absorption spectrum of rutin standards Dandelion plant and Dandelion flower extracts

图5 芦丁标准品、蒲公英植株和蒲公英花提取液的红外吸收光谱图Fig.5 Infrared absorption spectrum of rutin standards,Dandelion plant and Dandelion flower extracts
2.6.2 红外吸收光谱
图4 为芦丁标准品、蒲公英植株和蒲公英花的红外吸收光谱。
羟基、烷氧基和异戊烯氧基等基团是天然黄酮类化合物中常有的取代基,波数在3 100~3 460、1 600~1 640 cm-1,以及1 372、1 242、1 058 cm-1的红外光谱振动峰是黄酮类化合物的特征峰[21]。
如图4 蒲公英植株和花的红外光谱在3 426 cm-1处出现的宽而强的峰为O-H 基的吸收峰,说明存在大量缔合的-OH 基团;在2 926、2 850、1 387 cm-1附近有较强的表征CH2-和CH3-的吸收峰出现,证明饱和碳上的氢较多;1 635 cm-1处的吸收峰为羰基的伸缩振动峰;1 518~1 322 cm-1范围内的吸收峰为苯环的吸收峰,证明苯环的存在;1 320~1 158 cm-1范围内的吸收峰是羟基的弯曲振动吸收峰;在1 271 和1 045 cm-1两处的吸收峰分别为C-O-C 键的反对称和对称伸缩振动峰;890~700 cm-1范围内的吸收峰为苯环上取代基引起的吸收峰。上述特征峰与标准品特征峰基本一致,说明蒲公英植株和花的粗提液是典型的黄酮类化合物。
3 结论
(1)蒲公英植株与蒲公英花的粗提液中含有黄酮类化合物。
(2)结合单因素试验所确定的因素水平范围,选取料液比、超声时间、温度三个因素,设计三因素三水平的正交试验并得出:影响蒲公英植株中黄酮类化合物得率的三个主要因素,影响作用由大到小依次为:超声时间>料液比>温度;影响蒲公英花中黄酮类化合物得率的三个主要因素,影响作用由大到小依次为:温度>料液比>超声时间。
(3)蒲公英植株中黄酮类化合物的最佳提取条件为:料液比1∶50(g∶mL),超声时间40 min,温度60 ℃;蒲公英花中黄酮类化合物的最佳提取条件为:料液比1∶40(g∶mL),超声时间50 min,温度70 ℃。应用上述条件,对蒲公英植株和花中的黄酮类化合物进行提取并验证,得到蒲公英植株的得率为4.86%,蒲公英花为3.95%。试验结果表明,蒲公英植株中黄酮类化合物的含量高于蒲公英花中黄酮类化合物的含量。
(4)试验为蒲公英及蒲公英花中黄酮类化合物的研究,及其深加工提供了有益的参考。

