草地早熟禾蛋白激酶CIPK32基因克隆及非生物胁迫响应分析
陈 阳,王 琦,高岩松,尤 学,熊 毅,金一锋
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
蛋白激酶(Protein kinase)具有添加磷酸基调节靶蛋白的活性定位、蛋白-蛋白相互作用等特性,其在植物对逆境胁迫中发挥重要作用[1]。蔗糖非发酵1(SNF1)蛋白激酶(SnRK)属于丝氨酸/苏氨酸蛋白激酶类,包含3个家族:SnRK1、SnRK2和SnRK3,该蛋白的磷酸化途径在被激活的条件下调节下游基因表达,从而调节不同的应激反应和生理过程[2]。其中,植物SnRK3激酶亚家族中的结构包含N端激酶区和C端调控区,可与钙传感器钙调神经磷酸酶B样蛋白(CBL)相互作用,形成一个复杂的网络,介导钙信号和一系列复杂的环境刺激[3-5],所以,SnRK3又被称为CIPK(Calcineurin B-like protein interacting protein kinase)。研究发现,CIPK家族基因参与多种应对非生物胁迫(环境胁迫、营养缺乏和植物激素)、ROS信号传导以及植物生长发育相关的过程[6-8]。
Kanwar等[9]研究发现,水稻(OryzasativaL.)OsCIPK31和OsCIPK32等多个CIPK成员在干旱处理中转录上调。过表达水稻OsCIPK3、OsCIPK12和OsCIPK15可增强幼苗期的耐寒性、耐旱性和耐盐性[9]。过表达玉米(ZeamaysL.)ZmCIPK8提高了植株的耐旱性[10]。大麦(HordeumvulgareL.)HbCIPK2会通过维持K+/Na+稳态来调节耐盐性[11]。Hu等[12]研究发现,CIPK8在低氮胁迫下的硝酸盐低亲和力反应中起着积极调节作用。油菜(BrassicanapusL.)BnCIPK6可参与植物对低磷胁迫的反应,在低磷条件下,油菜BnCIPK6的表达上调,过表达BnCIPK6的拟南芥(Arabidopsisthaliana)表现出比野生型更多的生物量积累[13]。研究发现,拟南芥AtCIPK26的过度表达增加了发芽种子对ABA抑制作用的敏感性[14]。CIPK9和CIPK23也与低K+应激有关,CIPK9和CBL3的过表达表现出类似的低K+敏感性表型[13]。综上可见,CIPK基因家族对生物应对非生物胁迫有重要作用。
草地早熟禾(PoapratensisL.)属于禾本科多年生草本,具有质地纤细、观赏性良好、成坪速度较快、抗寒性强等优良性状,可用于绿地、公园以及园林绿化中。但是在面对非生物胁迫时,经常会造成植株出苗难、生长慢、绿期短、秋季早衰甚至死亡等现象的发生[15-17]。因此,在草坪草应用领域中应注重提高草地早熟禾抗逆境胁迫能力,对草地早熟禾抗逆境胁迫基因的研究也至关重要。本研究拟克隆获得草地早熟禾CIPK32基因,并进行生物信息学分析。利用实时荧光定量PCR检测CIPK32基因不同组织及干旱、盐、氮素和磷素胁迫下的表达模式。本研究结果不仅有助于理解CIPK32基因的结构特征,也为进一步探索CIPK32基因在逆境胁迫应答等过程中的作用机制提供了基础。
1 材料和方法
1.1 试验材料及处理方法
草地早熟禾午夜Ⅱ号为供试材料,将种子均匀的播撒在营养土内,放置于光照培养箱中等待萌发,培养条件为:白天/夜晚温度25 ℃/15 ℃,相对湿度60%,光/暗为14 h/10 h,光照强度600 μmol/(m2·s),培育3个月后进行非生物胁迫处理。
选择生长健康、长势一致的草地早熟禾植株,将根部清洗干净,转移至1/2 Hoagland水培液中进行预培养,培养15 d后,进行不同胁迫处理。处理方式为:对1/2 Hoagland水培液中生长14 d的草地早熟禾植株分别进行10% PEG6000模拟干旱处理、盐处理(0,30,100,200 mmol/L NaCl)、氮处理(0,1.5,15.0 mmol/L NaNO3)、磷处理(0,0.1,1.0 mmol/L KH2PO4),配置3种不同浓度的NaNO3、KH2PO4溶液分别作为氮源、磷源。每3个处理作为一个生物学重复,处理21 d后取样,取根、茎、叶后迅速置于液氮中保存。
1.2 CIPK32基因克隆
利用BioXM2.7.1软件设计CIPK32基因克隆引物,上游引物CIPK32-F:5′-CCAGAGGGGGAATAAGGCAG-3′,下游引物CIPK32-R:5′-CCTTCTTAGCAGCGATTTGG-3′。以草地早熟禾叶片提取的RNA反转录获得的cDNA为模板,通过PCR得到CIPK32基因的序列。PCR反应总体系为25 μL,在PCR中加入12.5 μL的2×Es Taq MasterMix,1 μL cDNA,1 μLCIPK32-F/R,9.5 μL ddH2O。对PCR产物进行琼脂糖凝胶电泳处理,找出相应的基因产物,然后将PCR产物的测序送往上海生工来完成。
1.3 CIPK32基因生物信息学分析
通过SWISS-MODEL、NCBI-CDD、TMpred、SignaIP 4.1、Netphos、PSORT等在线软件对编码氨基酸序列进行蛋白结构、蛋白保守结构功能域、跨膜区域、信号肽、磷酸化位点、亚细胞定位进行预测分析;应用MEGA 7.0软件构建进化树;采用ClustalW对CIPK32编码氨基酸进行同源比对等。
1.4 草地早熟禾CIPK32基因对不同组织及不同逆境响应分析
根据试剂盒提取生长期为3个月的草地早熟禾植株根、茎、叶3个部位的RNA,之后用于qRT-PCR测定草地早熟禾CIPK32基因在不同组织部位的相对表达量。提取经过PEG6000、NaCl、N、P胁迫样本的叶部RNA,用于qRT-PCR测定草地早熟禾CIPK32基因在逆境响应过程中的相对表达量。qRT-PCR采用相对定量分析,UBQ为内参基因[18],利用TB Green®Premix Ex TaqTMⅡ试剂盒,总体系为50 μL。qRT-PCR程序为:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。
2 结果与分析
2.1 草地早熟禾CIPK32基因的克隆
采用设计的特异性引物CIPK32-F/R(表1)和草地早熟禾cDNA为模板,利用RT-PCR技术进行扩增,获得1 354 bp的目的条带(图1)。测序结果显示,CIPK32基因序列含有的ORF为1 320 bp,共编码439个氨基酸,与预测结果一致。

M.DL2000.
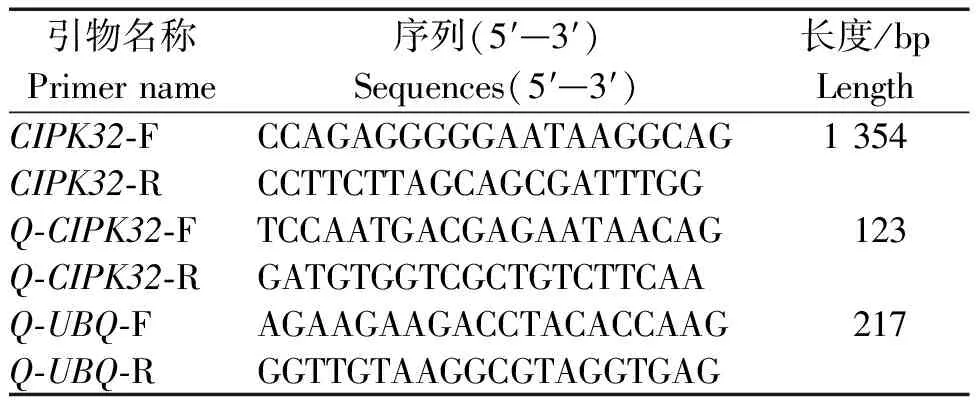
表1 基因克隆及荧光定量所需引物
2.2 生物信息学分析
用ProtPrarm对CIPK32蛋白进行理化性质分析,结果显示,CIPK32相对分子质量50.28 ku,等电点为6.82,蛋白质分子式为C2249H3574N608O665S16,为不稳定蛋白。在CIPK32蛋白中亮氨酸(Leu)成分含量最高,为10.3%。氨基酸残基中具有正/负电荷的残基Asp+Glu、Arg+Lys,分别为68,67个,平均亲水系数为-0.463,为亲水性蛋白(表2)。亚细胞定位预测显示,CIPK32蛋白定位于细胞质中。利用Netphos对磷酸化位点进行预测分析,结果表明,草地早熟禾CIPK32氨基酸磷酸化位点包含:丝氨酸14个,苏氨酸18个,酪氨酸4个(图2)。
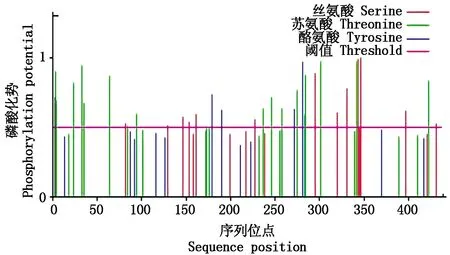
图2 草地早熟禾CIPK32蛋白的磷酸化位点

表2 草地早熟禾CIPK32编码氨基酸组成
NCBI在线分析分析结果表明,CIPK32蛋白包含典型的结构域STKc_SnRK3和CIPK_C(图3)。用MEGA 7.0对多物种CIPK编码氨基酸进行进化树分析,发现草地早熟禾CIPK32编码氨基酸与山羊草(Aegilopstauschii)CIPK32(XP_020198391.1)、黑麦草(Loliumrigidum)CIPK32(XP_047091407.1)、大麦CIPK32(XP_044980943.1)编码氨基酸同源性较高,分别为95.90%,95.90%,95.67%(图4)。通过MEME,将草地早熟禾CIPK32保守序列区域分析MEME设定为12个保守的基序,可以看出,草地早熟禾与大麦、黑麦草、小麦(TriticumaestivumL.)等禾本科植物CIPK32蛋白结构域非常相似。将草地早熟禾CIPK32与山羊草、黑麦草、大麦、小麦CIPK32氨基酸序列进行多序列比较,发现其含有酰胺化位点、N-糖基化位点、N-肉豆蔻酰化位点、蛋白激酶C磷酸化位点、CBL作用位点、PP2C等结合位点(图5)。
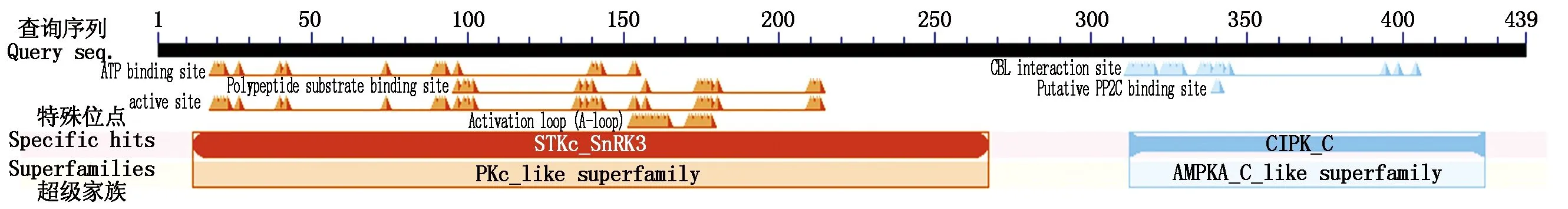
图3 草地早熟禾CIPK32的CDD结构域

图4 草地早熟禾CIPK32氨基酸序列的进化树及MEME分析

①.酰胺化位点;②.N-糖基化位点;③.亮氨酸拉链图案;④.N-肉豆蔻酰化位点;⑤.cAMP-cGMP依赖的蛋白激酶磷酸化位点;⑥.CBL作用位点;⑦.PP2C结合位点;+.酪氨酸激酶磷酸化位点;=.蛋白激酶ATP结合区信号;#.丝氨酸/苏氨酸蛋白激酶活性位点信号;红线.酪蛋白激酶Ⅱ磷酸化位点;蓝线.蛋白激酶C磷酸化位点。
应用SOPMA软件对CIPK32蛋白的二级结构进行了预测,发现CIPK32的二级结构包括:α-螺旋、不规则卷曲、β-转角、延伸链,占比分别为39.64%,32.80%,10.93%,16.63%。通过SWISS-MODEL在线分析,发现CIPK32蛋白三级结构的组成与蛋白二级结构预测的结果一致(图6)。
2.3 草地早熟禾CIPK32基因在非生物胁迫下的表达模式
2.3.1 草地早熟禾CIPK32基因组织特异性 从图7可以看出,草地早熟禾CIPK32基因的表达水平在组织部位中存在着显著性差异,其中叶部表达量最高,根部表达量最低。
2.3.2 非生物胁迫对草地早熟禾CIPK32基因表达水平的影响 本研究测定了10% PEG6000模拟干旱不同时间段的草地早熟禾CIPK32基因表达水平。从图8-A中可以看出,随着干旱时间的增加,草地早熟禾CIPK32基因相对表达量呈现先升高后降低的趋势,16 h的相对表达量最高,是0 h的6.2倍,而24 h的相对表达量比16 h降低了43.97%。由图8-B可以看出,草地早熟禾CIPK32基因表达水平随NaCl浓度的升高呈上调的趋势,200 mmol/L NaCl是0 mmol/L NaCl的6.9倍,可见,盐胁迫促进该基因的表达。图8-C中可见,NaNO3处理显著影响CIPK32基因的表达水平,0 mmol/L NaNO3>15.0 mmol/L NaNO3>15.0 mmol/L NaNO3,无氮或低氮环境均促进该基因的表达。图8-D中可见,随着KH2PO4浓度的增加,草地早熟禾CIPK32基因的表达呈先上升后下降的趋势,相对表达量为:0.1 mmol/L KH2PO4>0 mmol/L KH2PO4>1.0 mmol/L KH2PO4,低磷处理(0.1 mmol/L KH2PO4)更有利于其表达。综上,干旱、盐、氮素或磷素胁迫均显著影响草地早熟禾CIPK32基因的表达。
3 结论与讨论
蔗糖非发酵1(SNF1)相关蛋白激酶(SnRKs)通过激活蛋白磷酸化途径在应对非生物胁迫中发挥着重要作用[15]。根据基因结构和序列相似性,这些基因在植物中分为3个亚科:SnRK1、SnRK2和SnRK3。研究发现,拟南芥含有3个AtSnRK1、10个AtSnRK2、26个AtSnRK3基因[19],水稻中含有50个SnRK基因,其中4个OsSnRK1、11个OsSnRK2和35个OsSnRK3,大麦HvSnRK基因家族3个亚科中最多样化的一组。SnRK1s成员的特征是存在N末端蛋白激酶(Pkinase)结构域、泛素相关(UBA)结构域和激酶相关1(KA1)结构域。SnRK2s成员含有一个N端激酶域和另一个C端调节域。SnRK3s成员又被称为CIPK,结构上包括N-末端的激酶结构域和C-末端的调节结构域,其含有保守NAF(Asn-Ala-Phe)结构域,该结构域是自调节结构域并且含有能够与2C型蛋白质磷酸酶(PP2C)相互作用的PPI结构域[4]。研究发现,大多数水稻、棉花(GossypiumhirsutumL.)、木薯(Manihotesculenta)等CIPK成员含有NAF结构域和PPI结构域[20-21]。本研究中,草地早熟禾CIPK32包含N-末端的激酶结构域STKc_SnRK3和CBL相互作用蛋白激酶的C端调节域(CIPK_C),其中312—314aa为NAF(Asn-Ala-Phe)结构域。
研究发现,水稻OsCIPK基因(OsCIPK11、OsCIPK14、OsCIPK18、OsCIPK20和OsCIPK24)穗期差异表达中上调,在种子期表达量较低[9]。研究发现,小麦GzCIPK19在叶中表达量高于根、茎和籽粒[22]。甜瓜(CucumismeloL.)CmCIPKs(CmCIPK3、CmCIPK8、CmCIPK9、CmCIPK24等)在各组织中表达水平都很高,CmCIPK20仅在叶中表达[23]。大豆(GlycinemaxL.)GmCIPK6、GmCIPK34和GmCIPK15在叶部和花部中表达较高[24]。陈小晶等[25]研究发现,玉米ZmCIPK32在授粉后叶部的表达量显著高于冠根和根尖。烟草(NicotianatabacumL.)NtCIPK3的表达量排序为叶>茎>根>花[26]。这与本研究结果相似,草地早熟禾叶部CIPK32相对表达量显著高于根部与茎部。
随着多个物种中全基因组数据的公布,CIPK家族成员进行了分析与功能鉴定,例如,水稻[9]、棉花[20]、葡萄(VitisviniferaL.)[27]、白梨(Pyrusbretschneideri)[28]、茄子(SolanummelongenaL.)[29]、小麦[30]、大豆[31]等植物。研究发现,棉花GhCIPK6的过度表达增加了转基因拟南芥中对盐、干旱和激素胁迫的抗逆境能力[32]。例如在干旱条件下,GhCIPK在叶片和根部均上调,在干旱处理12 h后高表达[20]。大豆GmCIPK2基因在叶部、茎部相对表达量较高[31]。干旱处理促进甘蔗ScCIPK1的表达,响应NaCl胁迫,ABA胁迫下ScCIPK21在3,6 h的表达上调[33]。Wang等[34]发现,小麦TaCIPK27的过表达可以增加转基因拟南芥对干旱的耐受性,但降低了对ABA处理的敏感性。在拟南芥中,AtCIPK3的表达水平在幼苗的早期发育阶段增强,并且AtCIPK3突变体在种子萌发期间在脱落酸(ABA)胁迫下表现出高度敏感性[35]。而二穗短柄草(BrachypodiumdistachyonL.)BdCIPK31基因表达受到ABA的显著抑制,并参与ABA信号通路的信号转导,超表达BdCIPK31基因还能够降低盐胁迫导致的根部K+流失[36]。
研究发现,在水稻OsCIPK基因家族中,OsCIPK6、OsCIPK16、OsCIPK17、OsCIPK19、OsCIPK25和OsCIPK29在干旱胁迫和盐胁迫中上调[9]。盐(NaCl:200 mmol/L)和干旱胁迫(PEG:10%)处理促进葡萄VvCIPK基因家族中VvCIPK3、VvCIPK24和VvCIPK39基因的上调[27]。黄石连[37]发现,狗牙根(Cynodonspp.)CdCIPK5可能参与调控植物多种信号途径,过表达CdCIPK5可以提高水稻对盐胁迫的耐性。二穗短柄草BdCIPK31基因也在调节植物对干旱和盐胁迫的响应中发挥作用。干旱胁迫抑制BdCIPK31基因的表达,200 mmol/L NaCl水培处理对BdCIPK31基因的表达有促进作用[38]。这与本研究结果相似,干旱胁迫及NaCl胁迫显著地提升草地早熟禾CIPK32基因的表达水平。这可能因为二穗短柄草CIPK31与CIPK32在同一个进化树分支且距离较近,而草地早熟禾CIPK32与二穗短柄草CIPK32高度同源,其功能相似。研究发现,CIPK8不仅参与硝酸盐调控的快速转录控制,还参与硝酸盐长期调控的根系生长[12]。本研究中,CIPK32积极响应低氮或低磷处理,但是其功能还需进一步验证。综上所述,CIPK基因家族在非生物胁迫中具有潜在的作用,尤其是在干旱、盐胁迫下积极响应表达。
本研究克隆草地早熟禾CIPK32基因并对其进行表达模式分析。结果发现,草地早熟禾CIPK32基因表达具有组织特异性,并能够积极响应非生物胁迫。综上,该基因可能参与调控草地早熟禾多种非生物胁迫过程。这为后续挖掘草地早熟禾CIPK家族基因的功能提供了理论基础。

