NaCl胁迫下壳聚糖对菜用大豆叶、根蔗糖代谢的调控效应
李 星,孟 飞,郝佳奇,王 聪
(内蒙古民族大学 农学院,内蒙古 通辽 028042)
近年来我国农业用地盐渍化问题尤为突出,各种类型盐渍土总量约占全国耕地面积的20%[1],盐胁迫已是现阶段影响植物生长的主要非生物胁迫之一[2]。豆科植物可与根瘤菌共生结瘤固氮,培肥地力、增加产量并改善品质,同时,还可减少化肥氮施用量。然而,豆科植物与根瘤菌共生关系的建立会受到盐胁迫等逆境因子的限制。李梅等[3]研究发现,随着盐浓度的升高,蒺藜苜蓿的根瘤数不断减少,根瘤不断变小,固氮区的细胞数量也相应减少。王聪等[4]研究表明,NaCl胁迫导致菜用大豆根瘤数、根瘤鲜质量、植株含氮量显著下降,植株生长受到抑制。结瘤过程对植物本身来说是一个高度耗能的过程,需要消耗大量的碳源和能源。研究显示,大豆根瘤每固定1 g氮,需消耗15~20 g碳水化合物,大豆光合产物的16%会被根瘤消耗[5]。而光合产物主要是以蔗糖的形式运输到“库”端[6],与蔗糖代谢密切相关的酶主要包括蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)和转化酶[7]。蔗糖的合成、向根部转运及其在根部的积累状况对豆科植物根瘤形成、生长产生重要影响。研究发现,大豆根瘤的形成和固氮作用主要依赖于蔗糖的输入和代谢[8]。而且,蔗糖不仅为豆科植物结瘤固氮提供碳源和能源,还可作为信号分子抑制或激活结瘤相关基因表达[9]。大豆 MADS-Box 家族转录因子GmNMHC5能够促进大豆结瘤,而GmNMHC5的表达受到蔗糖的调控,内源蔗糖水平提高会诱导GmNMHC5的表达进而促进大豆结瘤[10]。然而,盐胁迫会严重影响植物的蔗糖代谢。NaCl胁迫可使植物叶片SPS活性下降,蔗糖转化酶活性升高,导致蔗糖含量下降[11]。因此,增强盐胁迫下叶片蔗糖合成及向根系的运输能力,对促进豆科植物的结瘤固氮具有重要意义。
壳聚糖是甲壳素脱乙酰化后得到的一种聚氨基葡萄糖,是一种廉价清洁的化学物质,其能够增强植物抗逆性的观点已得到普遍证实。研究发现,对四叶期的番茄幼苗进行壳聚糖处理,可通过提高苯丙氨酸解氨酶(PAL)、几丁质酶、β-1,3-葡聚糖酶活性,诱导番茄幼苗产生对早疫病的抗病性[12]。干旱胁迫下,壳聚糖处理后的大豆幼苗保护酶活性增强,提高了抗旱性[13]。外源壳聚糖可通过提高辣椒幼苗体内可溶性糖含量,降低丙二醛(MDA)含量,提高辣椒幼苗抗冷性[14]。盐胁迫下,外源壳聚糖可提高小麦种子α-淀粉酶活性,增强幼苗抗氧化能力、渗透调节能力及根系活力,诱导小麦种子及幼苗提高耐盐性[15]。前期的研究也发现,壳聚糖可显著提高盐胁迫下菜用大豆的根瘤数、根瘤鲜质量和固氮量[4],但盐胁迫下壳聚糖对豆科植物,特别是对菜用大豆结瘤调控机制的研究尚属空白。为此,本研究探讨NaCl胁迫下壳聚糖对菜用大豆蔗糖代谢及其在根部积累的影响,以期为深入研究盐逆境下壳聚糖诱导豆科植物结瘤的生理机制提供参考。
1 材料和方法
1.1 供试材料
菜用大豆选用主栽品种日本青,接种与其共生匹配性较好的快生型根瘤菌HH103[16](购自黑龙江省农业科学院微生物研究所)。
1.2 试验方法
1.2.1 试材培育 播种钵准备:选口径和高度都为 10 cm且底部有小孔的塑料苗钵,引纱布条穿过(所有纱布条的长、宽规格一致),装入蛭石,蛭石中均匀加入用无菌水配制的无氮营养液,以抓紧不滴水、松开不抱团为宜,然后将塑料钵置于口径10 cm、装有 1/4 Fahraeus无氮营养液的组培瓶上方,但塑料钵底部不接触到营养液,纱布条浸入营养液用于吸取液体,以维持塑料钵中营养液浓度和 NaCl 浓度。
播种:将经过消毒的种子播入塑料钵中,每钵2粒,每钵定苗1株。
幼苗培养:幼苗在人工气候箱中培养,白天光强为150 μmol/(m2·s),光周期为14 h光照/10 h黑暗,昼夜温度保持在25 ℃/18 ℃。
所有试验用具和蛭石高温高压灭菌20 min。
1.2.2 试验处理 试验设4个处理:叶面喷施无菌水,根部浇灌无氮营养液(CK);叶面喷施壳聚糖水溶液,根部浇灌无氮营养液(T1);叶面喷施无菌水,根部浇灌溶有NaCl的无氮营养液(T2);叶面喷施壳聚糖水溶液,根部浇灌溶有NaCl的无氮营养液(T3)。每处理12株,3次重复,完全随机排列。壳聚糖处理的适宜浓度为200 mg/L,NaCl处理的适宜浓度为50 mmol/L。
1.2.3 壳聚糖诱导和NaCl处理 待2片真叶完全展开后进行壳聚糖处理。用手持小型喷雾器将壳聚糖溶液均匀喷洒在幼苗叶片上,以量足但不下滴为宜,CK和T2处理喷洒无菌水。壳聚糖诱导处理5 d后进行NaCl处理,NaCl溶于1/4浓度Fahraeus无氮营养液,均匀浇入基质中。CK和T1处理仅浇灌无氮营养液。
1.2.4 接种 NaCl处理后随即接种。将根瘤菌悬浮液稀释至OD600值为0.1,用移液枪取摇匀的菌悬液喷注到幼苗根部周围,每株接种1 mL,然后再覆盖1层1 cm左右蛭石保湿。
1.3 指标测定
蔗糖代谢指标分别在接种后0,2,5,10,20,30 d测定,根瘤数以及根瘤鲜质量在接种后10,20,30 d测定。
蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)、中性转化酶(NI)、酸性转化酶(AI)参考赵智中等[17]的方法进行测定;蔗糖含量采用间苯二酚法测定[18],葡萄糖和果糖含量采用蒽酮-硫酸比色法测定[19]。
1.4 数据分析
采用SPSS 20.0与Microsoft Excel 2016软件进行数据分析处理,多重比较采用Duncan′s新复极差法。
2 结果与分析
2.1 壳聚糖对NaCl胁迫下菜用大豆结瘤的影响
由表1可知,NaCl胁迫(T2)导致菜用大豆的根瘤数与根瘤鲜质量均显著下降,各时期平均降幅达36.06%和29.91%。而壳聚糖处理(T3)后,菜用大豆的结瘤数与根瘤鲜质量在整个处理期间均较T2显著升高,平均增幅分别为T2的26.87%和25.63%。无盐条件下,外源壳聚糖(T1)使菜用大豆的结瘤数与根瘤鲜质量在各处理时期均较CK显著升高。说明NaCl胁迫会抑制菜用大豆结瘤,而壳聚糖处理在盐胁迫和无盐条件下均能显著促进菜用大豆根瘤的形成与生长。
2.2 壳聚糖对NaCl胁迫下菜用大豆叶、根蔗糖含量的影响
由图1可知,NaCl胁迫(T2)下菜用大豆叶片蔗糖含量的变化较平缓,CK为先降低后升高再降低趋势,其他条件下整体呈上升趋势;根的蔗糖含量在CK和T2条件下整体呈先升后降的趋势,而壳聚糖诱导后整体呈上升趋势。T2处理使叶片的蔗糖含量在整个处理期间均较CK显著升高,其中第30 天的增幅达CK的1.12倍;根的蔗糖含量在胁迫10 d显著降低,其余时期均显著高于CK。壳聚糖处理(T3)后,叶、根的蔗糖含量在各胁迫时期均较T2显著升高,平均增幅分别为11.32%和21.32%,其中根在30 d的增幅高达43.89%。无盐条件下,外源壳聚糖(T1)使叶、根的蔗糖含量均显著高于CK。表明无论是在盐胁迫还是无盐条件下,外源壳聚糖均可诱导菜用大豆叶片蔗糖的合成,促进根部蔗糖的积累。

不同小写字母表示处理间差异显著(P<0.05)。图2—6同。
2.3 壳聚糖对NaCl胁迫下菜用大豆叶、根还原糖含量的影响
由图2可知,随时间延续,各处理叶片还原糖含量整体呈现先升高后降低的趋势,而根的还原糖含量变化较平缓。NaCl胁迫(T2)导致菜用大豆叶、根的还原糖含量在各胁迫阶段均显著下降,尤其是根在胁迫中、后期的降幅较大,10,20,30 d的降幅分别达22.43%,21.92%,24.23%。壳聚糖处理(T3)后,叶、根的还原糖含量在各处理时期均显著高于T2,平均增幅分别为10.22%,11.11%。T1条件下,菜用大豆叶、根的还原糖含量在整个处理期间均显著高于CK。
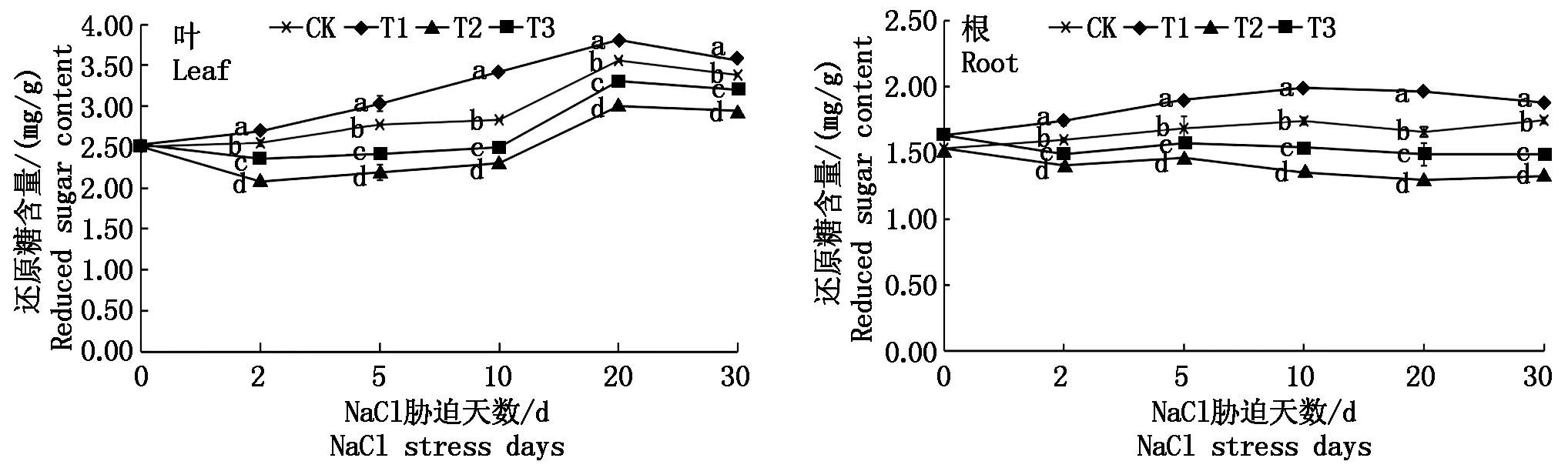
图2 NaCl胁迫下外源壳聚糖对菜用大豆还原糖含量的影响
2.4 壳聚糖对NaCl胁迫下菜用大豆叶、根蔗糖合成酶(SS)活性的影响
由图3可知,NaCl胁迫(T2)使菜用大豆叶片和根的SS活性在整个处理期间均大幅升高,平均增幅分别达CK的1.15,1.17倍。壳聚糖处理(T3)后,叶片SS活性在胁迫10,20,30 d较T2显著升高,增幅分别达T2的25.03%,25.59%,23.55%,其余时期无显著差异;根的SS活性在各处理时期均显著高于T2,在胁迫2,5,10,20,30 d较T2增幅分别为77.76%,35.41%,31.48%,45.97%,26.73%。T1条件下,叶片和根的SS活性在各处理时期均较CK显著升高。

图3 NaCl胁迫下外源壳聚糖对菜用大豆蔗糖合成酶活性的影响
2.5 壳聚糖对NaCl胁迫下菜用大豆叶、根蔗糖磷酸合成酶(SPS)活性的影响
由图4可知,NaCl胁迫(T2)下,菜用大豆叶片SPS活性在处理第10,20,30天较CK显著升高,其余时期无显著差异;根的SPS活性在整个胁迫期间均显著高于CK。与T2相比,T3处理使叶片SPS活性在胁迫第2,5,10天显著升高,平均增幅达19.36%,其余时期差异不显著;根的SPS活性在胁迫第2天时无显著差异,在第5,10,20,30天均显著升高,平均增幅为14.28%。T1条件下,叶片与根的SPS活性在各处理时期均显著高于CK。

图4 NaCl胁迫下外源壳聚糖对菜用大豆蔗糖磷酸合成酶活性的影响
2.6 壳聚糖对NaCl胁迫下菜用大豆叶、根中性转化酶(NI)活性的影响
由图5可知,NaCl胁迫(T2)下,菜用大豆叶和根的NI活性均较CK显著降低;壳聚糖处理(T3)后,叶和根的NI活性在整个胁迫期间均显著高于T2,平均增幅分别为7.37%和9.48%,其中,叶在10,30 d、根在2,5,10 d接近CK水平。T1条件下,叶片NI活性在整个处理期间均显著高于CK;根在10 d与CK相比差异不显著,其余时期均较CK显著升高。表明壳聚糖处理在盐胁迫和无盐条件下均能有效提高NI活性。
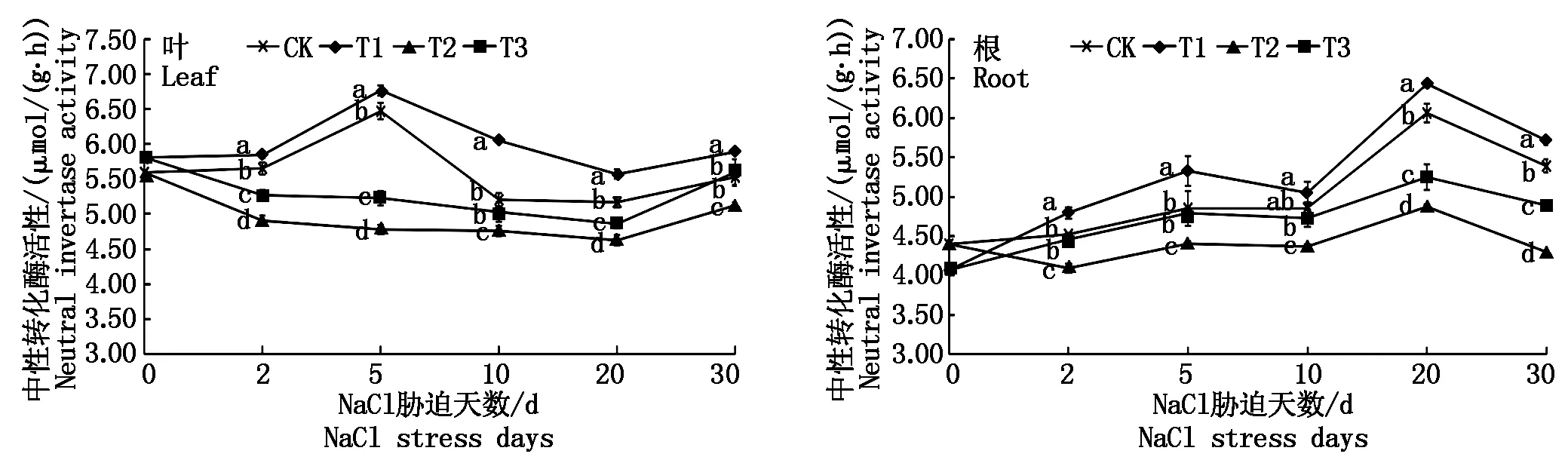
图 5 NaCl胁迫下外源壳聚糖对菜用大豆中性转化酶活性的影响
2.7 壳聚糖对NaCl胁迫下菜用大豆叶、根酸性转化酶(AI)活性的影响
由图6可知,NaCl胁迫(T2)使菜用大豆叶和根的AI活性在各胁迫阶段均显著降低;壳聚糖处理(T3)后,叶、根的AI活性均较T2显著升高,其中,叶片在20,30 d的酶活性接近CK水平;根在5,10,30 d接近CK水平,2,20 d显著高于CK,增幅达9.74%,9.99%。T1处理后,叶片在5,20 d、根在第2天酶活性与CK相比差异不显著,其余时期均显著高于CK。可见,NaCl胁迫显著抑制了菜用大豆的AI活性,而壳聚糖处理则在盐胁迫和无盐条件下对叶、根的AI活性均产生了显著的诱导作用。
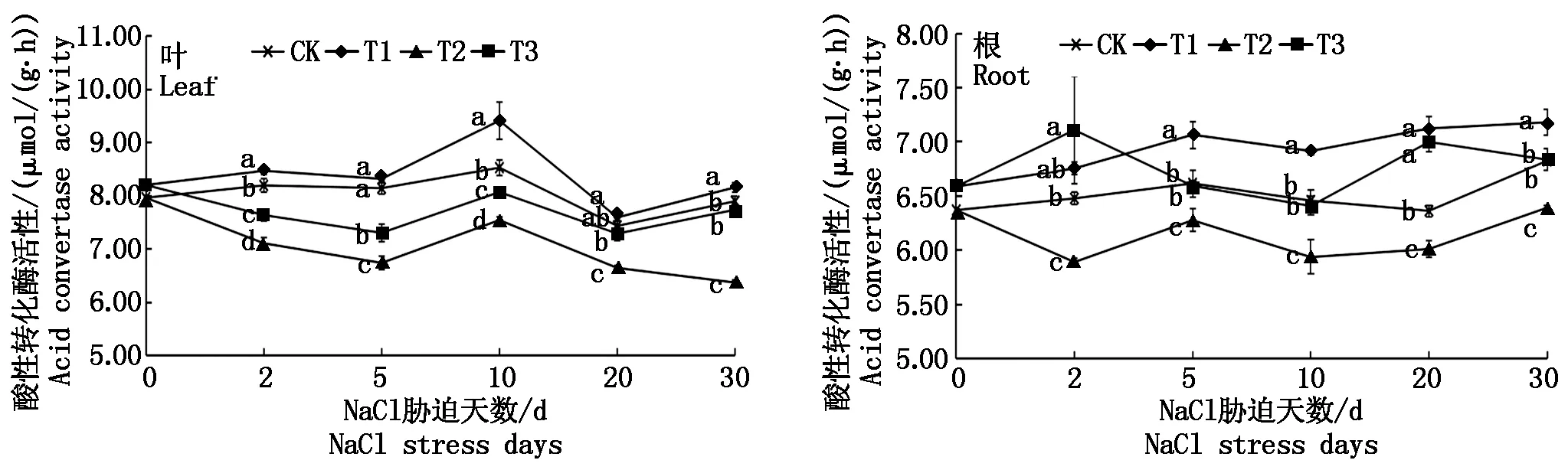
图 6 NaCl胁迫下外源壳聚糖对菜用大豆酸性转化酶活性的影响
3 结论与讨论
3.1 NaCl胁迫下壳聚糖对菜用大豆叶片蔗糖代谢的影响
蔗糖作为光合作用的重要产物和长距离运输的主要形式参与代谢,光合器官中蔗糖含量的多少直接影响其向“库”端的转移和积累,进而影响植物生长发育,对豆科植物而言,还会直接影响根瘤的形成与生长,最终影响产量。而叶片蔗糖代谢水平对“源”端的供应能力至关重要。本研究中,NaCl胁迫提高了菜用大豆叶片的SS和SPS活性,降低了NI和AI活性,导致叶片蔗糖含量升高,还原糖含量下降,而壳聚糖处理使NaCl胁迫下菜用大豆叶片SS、SPS和NI、AI活性均显著升高,这与盐胁迫下外源NO调控玉米叶片蔗糖代谢的结果相近[20]。作为早期的光合产物,叶片蔗糖含量的变化与光合效率密切相关。有研究发现,外源壳聚糖显著提高了NaCl胁迫下菜用大豆的净光合速率(Pn)[21],这就为叶片蔗糖的合成奠定了良好基础。同时,叶片蔗糖含量变化还要受到蔗糖代谢途径中关键酶综合作用的影响。本研究中,菜用大豆蔗糖合成和降解的动态平衡受SS、SPS和NI、AI共同作用,壳聚糖通过诱导其活性整体升高,增强蔗糖合成和分解能力,促使蔗糖代谢高效运转,这可能是NaCl胁迫下菜用大豆叶片蔗糖、还原糖含量升高的主要原因。此外,叶片蔗糖含量变化还与蔗糖向根部运转有关,这需要在根中进一步说明。
3.2 NaCl胁迫下壳聚糖对菜用大豆根系蔗糖代谢及结瘤的影响
根在生长发育和形态建成过程中需要积累大量的碳化物,蔗糖是从“源”到“库”的主要运输形式。“库”器官蔗糖的积累来自“源”端的转运、自身合成及降解[22]。本研究发现,NaCl胁迫使菜用大豆根中NI、AI活性显著下降,而壳聚糖处理显著提高了其在NaCl胁迫下的NI和AI活性。NI、AI作为蔗糖从韧皮部卸出的主要驱动力,能够在“源”端和“库”端形成蔗糖梯度,加速蔗糖向“库”端运输和分配[23-24]。根中NI和AI活性升高,势必增加“库”强,进而增强蔗糖从叶片向根的转运能力,促进蔗糖向根部的运输;再者,由于壳聚糖处理显著提高了NaCl胁迫下根系的SS、SPS活性,促使蔗糖分解、合成高效循环,致使根中蔗糖、还原糖含量整体升高。需要说明的是,“库”强的增加反过来也可促进叶片蔗糖的合成[25],这也可能是壳聚糖促使叶片蔗糖代谢高效运转的另一重要方面。糖类是根瘤在形成、生长过程中主要的碳源和能源。本研究中,外源壳聚糖使NaCl胁迫下菜用大豆根中蔗糖、还原糖含量升高,一方面为菜用大豆根系生长和结瘤提供了充足的碳源和能源,另一方面,蔗糖含量升高还可诱导结瘤基因表达,促进结瘤;同时,蔗糖、还原糖等可溶性糖作为渗透调节物质,其含量升高还可缓解盐胁迫对根系的伤害,这可能是壳聚糖提高NaCl胁迫下菜用大豆结瘤能力的重要原因之一。值得注意的是,尽管NaCl胁迫使根中蔗糖含量升高,但根瘤数、根瘤鲜质量均显著降低,这可能与还原糖含量下降有关,同时也说明还原糖可能是根瘤形成与生长过程中直接的碳源和能源。
豆科植物结瘤过程中会受到多种因素的影响,如根毛生长发育状况,大豆异黄酮、生长素等结瘤信号物质代谢及其在根部积累等。盐胁迫下,壳聚糖如何调控根毛生长发育和信号物质代谢及其在根部积累,还有待于进一步研究。
壳聚糖通过诱导NaCl胁迫下菜用大豆叶、根蔗糖代谢高水平运转,促进蔗糖向根部转移,进而为根系生长和根瘤形成及生长提供较充足的碳源和能源,同时,高水平蔗糖也可促进结瘤基因表达;此外,蔗糖、还原糖等含量升高也有效缓解了盐胁迫对根系的伤害,这可能是壳聚糖提高NaCl胁迫下菜用大豆结瘤能力的重要原因之一。

