牛circMYH8的鉴定及其调控牛肌原代细胞增殖的功能探究
岳炳霖,杨友抓拉母,冉宏标,王 会,蔡 欣,王嘉博,柴志欣,彭 巍,舒 适,付长其,王国文,钟金城
(1.西南民族大学 青藏高原动物遗传资源保护与利用四川省、教育部重点实验室,四川 成都 610041;2.青海大学 青海省畜牧兽医科学院,青海 西宁 810016)
骨骼肌是哺乳动物最大的组织,约占总体质量的40%,维持着机体新陈代谢、呼吸和运动等基本功能[1-3]。脊椎动物的骨骼肌主要来源于中胚层生皮肌节,由生肌祖细胞经增殖分化形成梭形单核成肌细胞,而后向肌肉形成部位迁移,经过一系列的增殖、分化和融合过程最终形成成熟肌纤维,另有一部分成肌细胞不发生融合形成卫星细胞用于损伤肌肉的再生[4]。脊椎动物骨骼肌纤维在胎儿期就已保持数目恒定,出生后主要通过肌纤维的肥大增加肌肉量[5]。牛骨骼肌原代细胞是从出生前牛背最长肌组织中分离的,作为一种体外模型细胞,可用于研究早期牛骨骼肌的增殖过程。
骨骼肌的生长发育是一个极其复杂的过程,对其转录调控机制的研究一直是分子遗传领域的热点。随着转录组测序技术的飞速发展,围绕骨骼肌生长发育相关基因的功能鉴定及转录调控机制研究已取得大量的成果[6]。近年来,非编码RNA研究逐渐兴起,其对骨骼肌发育的调控也成为研究热点。环状RNA是由一类不具有5′末端帽子和3′末端poly(A)尾,以共价键形成环状闭合结构的非编码RNA,与线性mRNA相比,环状RNA共价闭合的结构使其不易被核酸外切酶RNase R降解,具有更高的稳定性[7]。根据环状RNA的起源,其主要被分为四类:外显子环状RNA、外显子-内含子环状RNA、内含子环状RNA以及基因间环状RNA[8]。环状RNA是一种反向剪接的产物,具有时空特异性及组织细胞特异性。大量的研究证实环状RNA广泛参与调控动物机体生长发育过程,其中涉及最为广泛的是环状RNA作为miRNA的分子海绵的ceRNA调控,此外,环状RNA可以和功能蛋白结合参与剪接调控、转录调控、表观遗传修饰以及蛋白翻译调控[9]。circMYH8位于秦川牛19号染色体上,是由MYH8基因的29—33外显子环化形成,秦川牛不同发育时期背最长肌环状RNA测序结果显示,circMYH8在胎牛背最长肌的表达水平很高,可能参与牛骨骼肌早期发育。本研究首先利用生物学手段鉴定circMYH8为环状RNA,接着以牛肌原代细胞为细胞模型,探究circMYH8对牛肌原代细胞增殖的调控作用,为高产率肉牛的培育提供新的分子靶标。
1 材料和方法
1.1 试验材料
本试验所使用的试验动物是我国五大良种黄牛品种之首的秦川牛,为了防止或减少RNA的降解,将所采集的组织样用无酶离心管装,保存在-80 ℃冰箱。牛肌原代细胞从胎牛背最长肌样品中分离,并在20%胎牛血清和1%青霉素链霉素中培养。本试验所用的主要试剂如下:TRIzol 试剂(TaKaRa;中国)、反转录试剂盒(TaKaRa;日本)、荧光定量试剂盒(TaKaRa;日本)、琼脂糖(Hydragene;美国)、核质提取试剂盒(Life Technologies;美国)、RIPA裂解液(Solarbio;中国)、DMEM高糖培养基(Thermo Scientific;美国)、EdU细胞增殖试剂盒(RiboBio;中国)、PCD 2.1载体(吉赛;中国)、inhibitor(通用生物;中国)。
1.2 主要仪器
PCR仪(ALD1244;美国Bio-Rad)、荧光定量PCR仪(Bio-Rad CFX96;美国Bio-Rad)、凝胶成像仪(UNIVERSAL HOOD Ⅱ;美国Bio-Rad)、高速冷冻离心机(BIOFUGE PRIMO R;美国Thermo)、多功能酶标仪(BioTek Synergy2;美国BioTek)、多功能成像分析系统(FluorChem M system;美国ProteinSimple)、细胞培养箱(3111;美国Thermo)。
1.3 试验方法
1.3.1 牛肌原代细胞分离及培养 首先,将胎牛放入灭菌大培养皿内,用酒精棉球全面擦拭皮肤,利用手术刀剥离皮肤与筋膜,取适量肌肉组织并用无菌PBS冲洗3次。接着,将冲洗好的肌肉组织放入已加少量PBS的培养皿中,用灭菌剪刀将肌肉组织剪碎后转至10 mL离心管,去上清后加入组织4倍体积的0.2%Ⅱ型胶原酶,37 ℃水浴摇床消化3 h。利用孔径38 μm滤网过滤消化后的细胞,并将过滤得到的细胞用无菌PBS清洗3次(1 500 r/min),最后用含有20%胎牛血清和1%青霉素-链霉素的完全培养基悬浮细胞并继续培养。
1.3.2 RNA提取及RT-qPCR 利用TRIzol试剂(TaKaRa;日本)和核质提取试剂盒分别提取总RNA以及细胞核和细胞质RNA;利用反转录试剂盒合成cDNA;使用荧光定量试剂盒在荧光定量PCR仪上进行RT-qPCR。其中将反转录得到的cDNA稀释10倍作为模板,GAPDH为内参,表达量用2-ΔΔCt值进行校正。荧光定量反应体系(15 μL)为:SYBR®Premix Ex TaqTM Ⅱ(2×)7.5 μL、上下游引物各1 μL、cDNA 1 μL、去离子水4.5 μL。所使用PCR的反应程序包括以下步骤:95 ℃,240 s 预变性;95 ℃,20 s变性;55 ℃,20 s 退火;72 ℃,20 s延伸;共40个循环,整个试验过程保持避光。本试验所有引物信息如表1所示。

表1 引物信息
1.3.3 RNase R处理及核质分离 RNase R是一种可以切割降解RNA的核糖核酸外切酶,来源于大肠杆菌,能够消化几乎所有的线性RNA分子,但不易消化环状RNA以及套索结构,因此,可以用于环状RNA的鉴定。用20 U/μL的 RNase R处理牛背最长肌总RNA 4 h,再进行反转录后即可通过PCR检测circMYH8的稳定性。参考核质提取试剂盒说明书进行牛肌原代细胞核质RNA的分离。
1.3.4 circMYH8的鉴定 设计合成circMYH8的divergent primer及convergent primer 2组引物分别用来扩增circMYH8及其线性转录物。使用NCBI中的primer design tool软件设计相关引物,由于环状RNA与mRNA不同,它不具有5′和3′末端,而是RNA剪切过程中反向拼接产生的闭合的环状结构,因此,设计divergent primer与convergent primer也不相同,设计convergent primer时要考虑产物应包含环化位点。设计引物时:Tm值应不低于40 ℃;GC含量最好在40%~60%;上下游引物的Tm值和GC含量均应相差不大;引物的长度最好在18~25 nt;扩增产物长度最好在100~250 bp,不宜太长。引物合成成功后,分别以牛背最长肌cDNA、RNase R处理的牛背最长肌cDNA以及牛背最长肌gDNA为模板进行PCR扩增,通过测序及琼脂糖凝胶电泳进行鉴定。所述的PCR的扩增体系(20 μL)为:50 ng/μL模板DNA 1 μL、10 pmol/L的引物divergent primer或convergent primer对应的上下游引物各1 μL、PCR Mix 10 μL、去离子水7 μL。所使用PCR的反应程序包括以下步骤:95 ℃预变性5 min;95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,共15个循环;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,共20个循环;72 ℃延伸10 min。
1.3.5 载体构建及干扰片段合成 设计circMYH8全长引物,以牛背最长肌cDNA为模板PCR扩增circMYH8全长片段后,和PCD 2.1载体同时进行KpnⅠ和BamH Ⅰ双酶切,回收酶切片段后利用T4DNA Ligase进行酶连反应,酶连产物转化至DH5α感受态细胞并进行涂板,最后挑单克隆菌进行菌液PCR,选取阳性菌液送测序,将测序正确的菌液纯化试剂盒抽提circMYH8过表达载体。为了合成circMYH8干扰片段,设计了circMYH8环化位点为靶点的siRNAs并由通用生物公司合成,circMYH8-si的序列为:5′-GGAAGCAGAGGTGAATATT-3′。siRNA设计原则:片段长度19~21 nt;GC含量40%~60%;避免出现超过4个连续A/T;首位尽量避免重复;序列位置应在环化位点两侧分布均匀;一般会在干扰片段的3′末端加TT悬垂。
1.3.6 细胞转染 首先培养肌原代细胞,并将细胞接种到12孔板中。转染前,将孔板里的培养基换为OPTI-MEM培养基。以12孔板规格为例:根据载体或RNA寡核苷酸的浓度,将50 pmol的RNA寡核苷酸溶解于100 μL OPTI-MEM培养基中(A),同时用100 μL OPTI-MEM培养基溶解1.5 μL R0531,室温静置5 min(B)。将(A)缓缓加入(B)中,轻轻混匀,室温孵育15 min。最后将(A)(B)混合液加入相应的孔板中,“十字法”将培养基摇匀,放入培养箱中继续培养。
1.3.7 Western Blot 使用RIPA裂解液裂解细胞提取总蛋白,并通过BCA分析试剂盒(Solarbio;中国)进行蛋白定量,并在SDS中等量煮沸变性蛋白;SDS-PAGE凝胶每孔上样20 mg蛋白质,并在120 V,2 h条件下进行电泳,接着将蛋白质转移到PVDF膜(Millipore;德国)上并在200 mA条件下转膜3 h;TBST洗涤10 min,5%脱脂奶粉封闭膜2 h后,4 ℃与一抗孵育过夜;TBST洗涤膜3次后与HRP二抗常温孵育2 h,TBST洗涤3次后使用ECL试剂(TransGen Biotech;中国)通过化学发光系统(Bio-Rad;美国)检测蛋白信号。
1.3.8 EdU检测细胞增殖及流式细胞术 参考EdU细胞增殖试剂盒说明书,根据试剂盒说明书处理96孔板细胞,并采用荧光显微镜(DM5000B;德国)获取EdU图像。流式细胞术检测细胞周期:待细胞汇合度为80%左右时胰酶消化细胞,收集至2 mL离心管中,PBS清洗细胞2次;PBS清洗细胞后离心弃上清,加入预冷70%乙醇于4 ℃固定过夜;离心收集细胞,以1 mL的PBS洗细胞2次,加入500 μL PI染液(含50 μg/mL碘化丙啶(PI)的PBS,100 μg/mL RNase A,0.2% Triton X-100),4 ℃避光孵育30 min;利用流式细胞仪进行检测,计数2~3万个细胞,使用细胞周期拟和软件分析数据。
1.3.9 数据分析 使用GraphPad Prism 8.0和SPSS 22.0软件进行数据分析。2组分析采用独立样本t检验,3组或更多组采用单因素方差分析(ANOVA)。所有试验数据均以平均值±标准误差(s)表示。
2 结果与分析
2.1 circMYH8的筛选
用于筛选的测序数据来自秦川牛胎儿90 d和成年24月龄2个不同发育时期背最长肌的环状RNA测序结果,其中,每个发育阶段有3个牛骨骼肌样本,总共包含6个通过质量控制的牛骨骼肌RNA样品,并基于Illumina HiSeq 2500平台进行环状RNA高通量测序。根据|log2FC|>1及P<0.01的阈值对高通量测序数据进行过滤,筛选出牛背最长肌2个发育阶段差异表达的环状RNA(图1-A),然后对其中显著差异的环状RNA进行不同发育阶段骨骼肌表达水平验证,RT-qPCR结果表明,circMYH8在胎牛骨骼肌的表达高于在成年牛骨骼肌中的表达,这与RNA-seq数据一致(图1-B),暗示circMYH8在骨骼肌增殖中的调控作用。
2.2 circMYH8的鉴定
circMYH8来源于牛19号染色体上MYH8基因的29—33外显子,使用circMYH8的divergent primer进行PCR扩增,产物Sanger测序结果证实circMYH8具有反向拼接位点(图2-A)。接着琼脂糖凝胶电泳结果显示:以牛背最长肌cDNA或RNase R处理的牛背最长肌cDNA作为模板,circMYH8 divergent primer能够成功扩增出产物,但以牛背最长肌gDNA作为模板时,circMYH8 divergent primer不能扩增出产物;以牛背最长肌cDNA或牛背最长肌gDNA作为模板,circMYH8 convergent primer能够成功扩增出产物,但当使用RNase R处理的牛背最长肌cDNA作为模板时,circMYH8 convergent primer不能扩增出产物,该结果证实了circMYH8的真实性(图2-B)。对circMYH8进行了细胞核质定位试验,发现circMYH8在细胞核和细胞质中都存在(图2-C)。circMYH8 的RNase R抗性检测结果显示RNase R极显著降低了线性MYH8和β-actin的表达水平,而对circMYH8无显著影响(图2-D)。以上结果确证circMYH8是环状RNA。

A.circMYH8在牛基因组上的定位,以及Sanger测序证实了circMYH8环化位点的存在;B.PCR扩增和琼脂糖凝胶电泳结果确证了circMYH8的真实性;C.细胞核质定位试验显示circMYH8定位于细胞核和细胞质;D.RNase R的抗性试验结果显示circMYH8比线性MYH8更稳定。
2.3 circMYH8抑制牛肌原代细胞增殖
为了探究circMYH8对牛骨骼肌增殖表型的影响,使用circMYH8过表达载体和干扰片段在培养24 h的牛肌原代细胞中成功过表达及抑制circMYH8(图3-A、B)。首先收集细胞,利用qRT-PCR及Western Blot手段检测增殖标志基因CDK2、CyclinD1、CDK4及P21的表达水平,结果表明:circMYH8过表达显著抑制了CyclinD1和CDK4的转录水平,对CDK2和P21的转录水平无显著影响(图3-C),而干扰circMYH8极显著抑制了P21的转录水平(图3-D)。circMYH8过表达显著抑制了CDK2、CyclinD1和CDK4的翻译水平,促进了P21的翻译水平,而干扰circMYH8对这些增殖标志基因的翻译水平几乎没有影响(图3-E)。随后,EdU检测结果显示,circMYH8过表达显著抑制了牛肌原代细胞的增殖,而干扰circMYH8对牛肌原代细胞增殖有促进作用(图4-A)。此外,通过流式细胞术检测试验进一步评估circMYH8对牛肌原代细胞周期分布的影响。结果表明,circMYH8过表达不影响细胞周期分布,而干扰circMYH8促进了S期细胞比例的增加(图4-B)。总之,这些试验结果表明,circMYH8能够抑制牛肌原代细胞增殖。

A,B.circMYH8在培养24 h的牛肌原代细胞中被成功过表达(A)及抑制(B);C、D.过表达(C)及干扰(D)circMYH8后CDK2、CyclinD1、CDK4及P21的mRNA水平;E.过表达及干扰circMYH8后CDK2、CyclinD1、CDK4及P21的蛋白水平。不同小写字母表示差异显著(P<0.05)。
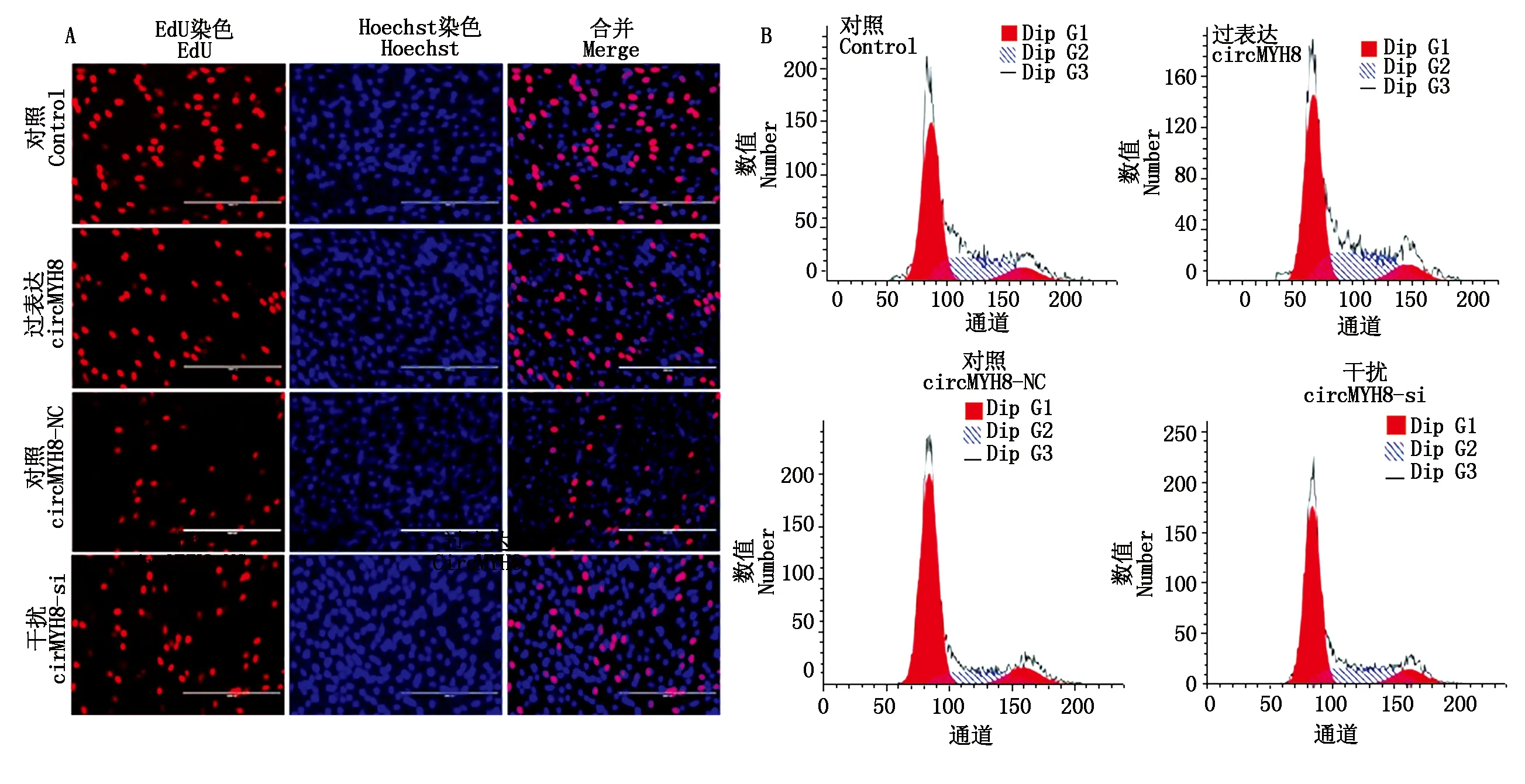
A.EdU检测用于评估细胞增殖能力,刻度尺,200 mm;B.流式细胞术检测细胞周期分布。提供的数据来自3个独立的试验。
3 结论与讨论
近年来,随着高通量测序技术不断的升级优化,动物细胞中的各类非编码RNA被广泛发掘鉴定,其中研究最多的是miRNA和长链非编码RNA,而环状RNA因其环化闭合的结构,相较于其他非编码RNA稳定性更高,在动物生命活动中可能发挥重要的作用,从而受到广泛的重视[10-12]。研究发现,尽管环状RNA的物种间保守性不高,但其以组织和发育阶段特异性方式发挥基因调控功能[13]。环状RNA通常含有丰富的miRNA结合位点,可以充当miRNA的分子海绵发挥ceRNA调控作用,间接调控miRNA的靶基因,例如Hansen等[14]发现,环状RNA ciRS-7及Sry分别拥有73个miR-7靶位点以及16个miR-138靶位点,通过吸附miRNA,ciRS-7和Sry能够间接调控其靶基因。最近,也有研究显示,环状RNA可以通过介导蛋白-RNA相互作用调控动物各种生理病理过程,例如,circAmotl1被发现通过招募STAT3启动Dnmt3a转录从而促进NIH3T3细胞增殖和伤口愈合[15],Du等[16]证实circFoxo3通过与p53及E3泛素连接酶MDM2相互作用,导致MDM2对p53的泛素化和降解,从而影响癌细胞的凋亡。此外,环状RNA还被证实通过编码微肽参与蛋白翻译调控[17]。
本研究的数据来源于牛的2个不同发育阶段骨骼肌环状RNA测序,用以筛选出差异表达的环状RNA[18]。骨骼肌的发育过程极其复杂,涉及产前及产后2个阶段,包括肌纤维的形成、增加以及再生[19]。其中胎儿90 d为产前阶段,此时存在着大量肌肉祖细胞的增殖发生,而24月龄为产后阶段,这期间肌纤维已经完全形成[20]。这些具有发育阶段特异性表达模式的环状RNA可能参与调控骨骼肌发育。作为反向剪接产物的环状RNA,在套索、顺式作用元件以及反式作用因子的驱动下反向剪接环化促使其形成[21],因此,证实反向剪接环化位点的存在是环状RNA鉴定的关键。在这里,设计出能扩增出环化位点的divergent primer用以环状RNA的鉴定。此外,线性产物和环化产物的转录存在竞争[22-23],同时设计出能扩增出线性产物的convergent primer用以对照,通过PCR扩增测序及胶图鉴定,本研究证实了circMYH8是环状RNA。
在骨骼肌发育研究领域,骨骼肌细胞的增殖表型是评估骨骼肌细胞发育的重要指标。由于脊椎动物骨骼肌纤维在胎儿期就已保持数目恒定,出生后主要通过肌纤维的肥大增加肌肉量,因此,早期骨骼肌细胞的增殖调控决定着骨骼肌纤维的数目,也直接决定着畜禽动物的产肉性能[5]。越来越多的研究表明,非编码RNA参与骨骼肌细胞增殖调控,尤其是miRNA,其中miR-1、miR-133和miR-206已被证实特异性地调控成肌细胞的增殖[24-25]。目前,关于环状RNA调控畜禽骨骼肌增殖研究也逐渐增多,例如,牛circLMO7、circRILPL1和circCPE分别通过吸附miR-378a-3p、miR-145和miR-138促进牛成肌细胞增殖[18,26-27];牛circFUT10通过吸附miR-133a抑制牛成肌细胞增殖[28];鸡circRBFOX2和circPTPN4分别通过竞争性结合miR-206和miR-499-3p促进鸡成肌细胞增殖[29-30];牛circSVIL通过抑制STAT1的磷酸化促进牛成肌细胞的增殖等[31]。本研究从牛不同发育时期背最长肌环状RNA测序结果中筛选出显著差异表达的环状RNA circMYH8,通过一系列生物学手段鉴定其为环状RNA;成功构建合成了circMYH8的过表达载体及干扰片段,以牛肌原代细胞为细胞模型,转染细胞后,利用分子试验技术证实circMYH8可以显著抑制牛肌原代细胞的增殖,circMYH8可作为肉牛转基因育种的重要候选分子。

