中药抗药源性肝损伤评价模型及作用机制研究进展
王存萍,罗秋林#,沙玉茹,谭 睿,顾 健*,龚普阳*
中药抗药源性肝损伤评价模型及作用机制研究进展
王存萍1,罗秋林1#,沙玉茹1,谭 睿2,顾 健1*,龚普阳1*
1. 西南民族大学药学院,四川 成都 610200 2. 西南交通大学生命科学与工程学院,四川 成都 610031
肝脏是药物在机体内代谢的主要场所。药源性肝损伤(drug-induced liver injury,DILI)是药物过量或不当使用导致的机体不良反应之一。非甾体类抗炎药、抗菌药等均可能引起DILI。DILI发生机制主要与细胞色素P450酶、线粒体功能障碍、药物代谢反应、氧化应激、炎症反应等密切相关。中药可通过抑制氧化应激、炎症反应、减少细胞凋亡与影响细胞色素P450酶系统等发挥治疗肝损伤作用。通过对DILI发生机制、动物模型建立方法及中药干预机制等方面进行总结归纳,为DILI动物模型的合理选择及中药防治机制研究提供参考。
药源性肝损伤;动物模型;中药;对乙酰氨基酚;异烟肼;利福平;雷公藤多苷
药源性肝损伤(drug-induced liver injury,DILI)是常见的药物临床不良反应之一,化学药、生物制剂、中药、保健品及其代谢物和辅料等均可能导致DILI的发生[1-2]。DILI的诱发机制复杂多样且患者个体差异大,使得多数DILI并无特效解毒剂。目前,DILI临床治疗的首要原则为停止使用致肝损伤的可疑药物,但可能带来原有疾病进展的风险。尽管糖皮质激素、水飞蓟素、熊去氧胆酸、异甘草酸镁等药物用于DILI治疗取得了一定效果,但这些药物的标准化和规范化使用仍欠缺,并且缺少多中心、大样本和前瞻性的对照研究证据[3]。因此,探寻DILI的发生机制及特异性治疗药物具有重要意义。
近年来,具有肝保护作用的中药及复方在改善DILI方面研究日益增多,为DILI的预防和治疗提供了有效路径。本文以肝毒性、DILI、动物模型及中药等为关键词,通过检索中国知网、万方、维普、PubMed、ScienceDirect、Web of Science等数据平台近20年的相关文献,综述了DILI的发生机制、动物模型及中药干预机制研究现状,为相关动物模型的合理选择和优化及中药作为保肝辅助药物的开发提供一定的科学依据。
1 DILI的诱因及发生机制
随着各种新药的广泛应用及联合用药的增多,DILI的发生率明显增高,根据其发病机制可分为:(1)药物及其代谢物直接造成的可预测的肝损伤;(2)药物特异质反应所致的不可预测的肝损伤[4-6]。常见的可能引发DILI的药物类型主要涉及非甾体类抗炎药、抗肿瘤药、抗菌药、中药及某些免疫抑制剂等[7]。
非甾体类抗炎药如对乙酰氨基酚(acetaminophen,APAP)、水杨酸类、双氯芬酸等,长期或过量服用可能会导致严重的肝损伤甚至肝衰竭。过量的APAP导致肝损伤的发生机制可能与其在细胞色素P450酶(cytochrome P450,CYP450)的作用下引起线粒体功能障碍和氧化应激等系列生化反应有关[8-9]。机体在遭受DILI带来的氧化应激时,产生的无菌性炎症反应往往会与过氧化反应共同介导并加重肝损伤[10]。水杨酸类导致肝损伤的机制则可能与引发线粒体功能障碍、ATP含量降低及CYP2E1介导的脂质过氧化有关[11]。双氯芬酸诱导的肝损伤机制则被认为是CYP2E1和CYP2C9代谢激活和活性氧形成,导致线粒体/溶酶体氧化应激损伤和谷胱甘肽耗竭从而引起的肝脏损伤[12]。
抗肿瘤药如烷化剂环磷酰胺、抗代谢药甲氨蝶呤或紫杉类多西紫杉醇(docetaxel,DTX)等对肿瘤细胞和正常细胞均有一定的损害[13-15]。在肝脏中,CYP450将环磷酰胺转化为其活性代谢物丙烯醛,丙烯醛进一步导致活性氧的产生,破坏线粒体功能,增加氧化应激和肝细胞凋亡[16]。甲氨蝶呤作为叶酸类似物则可能通过叶酸途径抑制二氢叶酸还原、减少DNA合成与细胞增殖,促进肝细胞凋亡导致肝损伤[17-18]。DTX是一类复杂的二萜类分子,对肝细胞具有直接的毒性作用,其引起肝损伤的作用机制为通过抑制RNA的合成、干扰细胞增殖过程中纺锤体的形成和抑制有丝分裂等过程,导致细胞坏死,从而引起一系列肝功能损害[15]。
易引起DILI的抗菌药物主要有头孢菌素类、大环内酯类、抗结核药物和磺胺类药物等[19-20]。其中,抗结核药物异烟肼在肝脏代谢过程中产生的乙酰肼被认为与其诱导的肝损伤有关[21-23]。然而,乙酰肼在酰胺酶的作用下水解成异烟酸和肼,肼和乙酰肼经CYP2E1氧化代谢引起氧化应激,消耗肝脏内谷胱甘肽等抗氧化物,导致肝损伤。利福平作为治疗结核病的一线药物,其本身即可引起胆汁淤积性肝损伤,与异烟肼联合用药时,可促进异烟肼代谢,使毒性代谢物在肝脏中累积,进一步加重肝脏损伤程度。
在准确的临床辨证基础上,中药在治疗剂量下通常是安全有效的。然而,中药炮制不规范或剂量过大则可能导致不良反应。何首乌可能通过促进胆汁酸肝肠循环改变胆汁酸组成,抑制胆固醇7α-羟化酶从而导致肝损伤。雷公藤的肝毒性可能与其抑制CYP450活性、促进肝脏内活性氧的产生、引起机体氧化应激及促进细胞凋亡有关[24-25]。
从不同层面的机制研究来看,DILI的发生是多重因素作用的结果,发生机制涉及药物的直接肝毒性、特异质肝毒性、线粒体功能损伤、炎症反应等多个方面,如非甾体类抗炎药所致肝损伤的发生机制主要包括内在肝毒性和特异质反应。内在的肝毒性主要为药物的直接肝毒性,与服药剂量相关。但特异质反应依赖于个体的易感因素与暴露于一定剂量的药物或其毒性代谢产物的协同作用,发生率低且难以预测[26]。此外,大量的基础和临床研究表明,抗肿瘤药物所致的肝毒性具有特质性,其发生机制主要涉及免疫介导和代谢异常引起的肝损害,多为轻度肝损伤。至于抗结核药物,研究表明其代谢产物异烟肼和肼被认为与异烟肼肝毒性有关[27]。
中药引发的肝损伤一直是影响中医药疗效和阻碍中医药发展的障碍之一。然而,由于中药多成分、多靶点、多通路调控的特点,导致其引起的肝损伤发生机制更为复杂,如干扰炎症信号通路、代谢紊乱、线粒体功能障碍和氧化应激等。综上,通过归纳上述临床常见药物引起肝损伤的诱因及机制,为临床合理安全用药及相关药物肝损伤的发生机制研究提供一定参考。
2 DILI动物模型的建立方法研究现状
依据DILI发生机制与特点,其模型的建立往往可以通过一次或多次给予动物大剂量的肝毒性药物诱导肝脏损伤。对近年来模型建立方法进行总结,分析各方法的异同点,为深入研究DILI机制及抗DILI药物筛选提供依据。
APAP诱导的肝损伤模型是近年来常用的经典DILI模型之一,其产生的肝毒性具有剂量相关性且成模较稳定[28-29]。Wang等[30]对8~10周龄C57BL/6雄性小鼠一次性ip APAP 600 mg/kg,肝脏病理结果显示模型组小鼠肝脏出现明显的桥接坏死与融合性坏死,天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)相较于空白组显著升高,肝损伤模型建立成功。Minsart等[31]对8周龄C57BL/6J野生型雌性小鼠一次性ip APAP 500 mg/kg,造模12 h后通过测定血浆AST、ALT和乳酸脱氢酶(lactic dehydrogenase,LDH)的水平评估肝毒性,结果显示APAP可成功诱导小鼠严重的肝损伤。Choi等[32]采用对雄性BALB/c小鼠一次性ip APAP 300 mg/kg,12 h后,测得小鼠血清AST、ALT显著升高,且肝脏有明显的病理改变。Kim等[33]采用7周龄C57BL/6小鼠,给药剂量为250 mg/kg成功建立了DILI模型,且肝功能指标较空白组有显著性差异。张云等[34]用不同浓度的APAP分别处理受精后72 h的斑马鱼幼鱼,免疫荧光结果显示幼鱼肝组织荧光强度显著下降,肝脏明显萎缩退化。
抗结核药物异烟肼、利福平也越来多地被应用于建立DILI模型。Chowdhury等[35]采用异烟肼50 mg/kg与利福平100 mg/kg联用的方式,对8~10周龄BALB/c雄性小鼠一次性ip,根据肝损伤标志物AST、ALT等指标判断模型建立成功。Ci等[36]同样采用异烟肼及利福平联用的方式,剂量均为100 mg/kg,对ICR小鼠连续ig 14 d,结果显示小鼠肝功能指标显著升高,肝脏有明显病变。Enriquez-Cortina等[37]ig利福平150 mg/kg和异烟肼75 mg/kg于BALB/c小鼠,贾云鹏等[38]连续4 d ig异烟肼90 mg/kg、利福平135 mg/kg、吡嗪酰胺315 mg/kg于昆明小鼠,均成功建立抗结核药物诱导的肝损伤小鼠模型。
中药雷公藤所含雷公藤多苷(tripterygium glycosides,TG)及雷公藤甲素(triptolide,TP)既是其抗风湿性关节炎的有效成分又是导致DILI的主要成分。因此,TG及TP也常用于DILI动物模型建立。彭勃等[39]以不同剂量、不同干预时间为变量,初步探讨了TG对昆明小鼠肝脏的影响,发现TG给药剂量为20倍成人剂量即300 mg/kg,作用18 h时肝脏的损伤程度最为明显。李媛媛等[40]以37.5 mg/kg的剂量连续5周ig TG于大鼠,肝脏病理切片结果显示大鼠肝脏细胞明显坏死且呈现炎性细胞浸润。王君明等[41]一次性ig TG 270 mg/kg于昆明小鼠,成功建立小鼠急性肝损伤模型,肝脏病理表现为肝脏细胞肿胀及明显坏死。付晓春等[42]以不同浓度的TG处理斑马鱼48 h,斑马鱼肝脏病理切片结果显示组织结构紊乱、细胞质变大、细胞核皱缩。吴豪等[43]采用不同浓度的补骨脂提取物对斑马鱼成鱼给药24 h后冰浴处死,进行苏木精-伊红染色发现斑马鱼肝脏受到不同程度的病变,主要表现为肝脂变。
抗肿瘤药物环磷酰胺及甲氨蝶呤诱导的DILI模型也较为稳定。Cengiz等[44]一次性ip环磷酰胺200 mg/kg于大鼠,20 h后肝细胞胞浆浑浊、胞内模糊、细胞核呈深色、不规则收缩状、细胞核边界及细胞质中嗜酸性粒细胞增多。Salama等[45]通过ip环磷酰胺200 mg/kg诱导大鼠肝损伤,其病理切片显示肝脏结构紊乱、中央静脉和门静脉充血、肝细胞广泛空泡化、细胞核固缩。Chen等[46]通过ip甲氨蝶呤20 mg/kg于大鼠,成功诱导大鼠肝脏受损,肝组织损伤表现为炎症细胞浸润、空泡变性、肿胀、细胞质光染、排列紊乱、导管增生、门脉区结缔组织增生等。
随着DILI的发生和机制的不断揭示,其生物学模型的建立方式也多种多样,常见DILI动物模型的建立方法总结见表1。APAP所诱导的肝损伤具有明显的剂量相关性,且具有经济、简便且代谢机制符合临床特点等优势。因此,该模型成为近年来研究过量服用解热镇痛药导致急性肝损伤的经典动物模型,但该模型造模时因药物溶解度低等因素限制了造模的成功率。异烟肼-利福平诱导的肝损伤模型具有稳定性强,可复制率高等优点,有利于研究抗结核药物的潜在肝毒性机制。但联合用药诱导时其比例仍需系统筛选和评价。此外,在中药致肝损伤模型中,TG诱导的肝损伤模型具有造价成本低、造模后死亡率低等特点。但由于其中包含化合物多样及含量不稳定,其所诱导的模型稳定性仍需进一步考察。抗肿瘤药物环磷酰胺诱导的肝损伤模型也具有简便及剂量可控等优点,可用于化疗辅助治疗药物的筛选研究,但该类药物通常引发多器官多组织毒性反应,个体差异较大。此外,一些以肝损伤为主要不良反应的药物也可能成为肝损伤动物模型潜在的诱导剂,如抗癫痫药物苯妥英钠、抗菌药阿莫西林及白鲜皮、何首乌、补骨脂等。
表1 常见的DILI动物模型的建立
Table 1 Establishment of common animal models of DILI
造模剂研究对象造模方法主要结果文献 APAP8~10周龄C57BL/6雄性小鼠一次性ip 600 mg·kg−1肝脏病理小鼠肝脏出现桥接坏死与融合性坏死,AST及ALT升高30 8周龄C57BL/6J野生型雌性小鼠一次性ip 500 mg·kg−1AST及ALT升高31 雄性BALB/c小鼠一次性ip 300 mg·kg−1AST及ALT升高32 7周龄C57BL/6小鼠一次性ip 250 mg·kg−1AST及ALT升高33 斑马鱼含不同浓度APAP的胚胎培养液处理肝脏形态异常、肝脏颜色明显变暗、肝组织萎缩34 异烟肼-利福平8~10周龄BALB/c雄性小鼠一次性ip异烟肼50 mg·kg−1、利福平100 mg·kg−1AST及ALT升高35 ICR小鼠连续14 d ig异烟肼100 mg·kg−1、利福平100 mg·kg−1AST及ALT升高36 BALB/c小鼠连续7 d ig异烟肼150 mg·kg−1、利福平75 mg·kg−1AST及ALT升高37 昆明小鼠连续4 d ig异烟肼90 mg·kg−1、利福平135 mg·kg−1、吡嗪酰胺315 mg·kg−1AST及ALT升高38 TG昆明小鼠TG不同给药剂量、不同干预时间发现20倍临床成人剂量作用18 h,肝脏损伤程度明显,AST及ALT升高39 大鼠连续5周ig 37.5 mg·kg−1大鼠肝脏细胞坏死且呈现炎性细胞浸润40 斑马鱼不同浓度的TG处理斑马鱼48 h组织结构紊乱,细胞质变大42 昆明小鼠一次性ig 270 mg·kg−1肝脏细胞肿胀及明显坏死41 环磷酰胺 大鼠一次性ig 200 mg·kg−120 h后大鼠肝脏结构严重受损,肝细胞胞浆浑浊、胞内模糊、细胞核呈深色、不规则收缩状、细胞核边界及细胞质中嗜酸性粒细胞增多44 大鼠一次性ip 200 mg·kg−1肝脏细胞出现损伤、结构紊乱、中央静脉和门静脉充血、肝细胞广泛空泡化、细胞核固缩45 甲氨蝶呤大鼠一次性ip 20 mg·kg−1肝组织损伤增加,炎症细胞浸润、空泡变性、肿胀46 补骨脂提取物斑马鱼含不同浓度补骨脂提取物在受精卵形成后第2~8天给药AST及ALT升高,肝细胞发生轻微脂变43
3 中药及活性成分改善DILI的作用机制
近年来,中药及天然药物在改善DILI方面的研究较为广泛,其作用机制主要与抗氧化应激、抑制炎症反应、影响CYP450系统及抗细胞凋亡等相关。
3.1 抗氧化应激
氧化损伤是DILI的重要病理过程,部分中药可通过调节氧化应激相关通路发挥抗DILI作用。Lin等[47]从中药铁皮石斛中分离出多糖成分,并发现其可以通过抑制氧化应激和激活核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)/ Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)信号通路,即诱导Nrf2从Nrf2/Keap1复合物中解离、促进Nrf2核转位、谷氨酰半胱氨酸连接酶催化亚基(recombinant glutamate cysteine ligase catalytic,GCLC)、谷氨酰半胱氨酸连接酶修饰亚基(glutamate-cysteine ligase modifier subunit gene,GCLM)、血红素氧合酶-1(heme oxygenase-1,HO-1)、醌氧化还原酶1(quinine oxidoreductase1,NQO1)基因转录发挥对APAP诱导的小鼠DILI产生保护作用。Nrf2是可以调节众多抗氧化酶表达的因子,在机体进行抗氧化防御时,于胞浆中与Keap1解离并转移至细胞核,通过激活GCLC、GCLM、HO-1与NQO1等抗氧化基因的转录来调节多种抗氧化酶的表达,促使谷胱甘肽等趋于正常水平[48-49]。Lu等[50]研究发现传统藏药长果婆婆纳的醋酸乙酯部位在体内通过降低肝毒性、抑制脂质过氧化和提高抗氧化能力等途径对APAP诱导的小鼠肝损伤有明显的改善作用,其作用机制与选择性自噬接头蛋白p62(sequestosome-1,p62)/ Keap1/Nrf2信号通路即激活Nrf2、促进、mRNA和p62表达和GCLM)有关。此外该活性部位通过参与p62/Nrf2轴的激活诱导p62和Nrf2的表达,预防APAP引起的肝损伤[51]。Wang等[52]研究发现慈菇多糖可通过激活Nrf2信号通路改善异烟肼-利福平诱导的肝损伤。Tan等[53]通过研究甘草酸的保肝作用机制,发现其可通过作用于Nrf2信号通路并激活靶基因尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate glucuronosyltransferase,UGT1A)、胆盐输出泵(bile salt export pump,BSEP)、多药耐药相关蛋白2(multidrug resistance- associated protein 2,MRP2)在肝脏中的表达,从而改善TP诱导的大鼠肝损伤。此外,Wu等[54]研发现存在于辣椒、可可树和枸杞等植物中的天然活性产物-反式-咖啡酰多巴胺对异烟肼-利福平诱导的肝损伤具有保护作用,并发现其可以通过调节CYP2E1表达,抑制机体脂质过氧化。Zhou等[55]通过研究牛蒡子苷类成分对TP诱导的小鼠肝损伤的影响,发现其可以改善DILI,并促进抗氧化相关蛋白Nrf2和基因、的表达,其机制可能与牛蒡子苷的抗氧化应激作用有关。
3.2 抑制炎症反应
柠檬苦素类化合物可抑制细胞凋亡、上调沉默信息调节因子1(silence information regulator 1,Sirt1),激活Nrf2抗氧化通路,抑制核因子-κB(nuclear factor-κB,NF-κB)的活化,从而抑制炎症进程[56]。Sirt1被认为是DNA损伤修复中的重要调节因子,其在抗细胞凋亡、能量代谢、线粒体功能保护方面具有重要作用。此外,Sirt1可以通过下游靶点Nrf2显著保护细胞免受氧化应激损伤,增加对氧化损伤的抵抗力。同时研究表明Sirt1下调与炎症反应密切相关,并通过抑制NF-κB活化调节炎症反应。NF-κB是一种典型的促炎因子,其中NF-κB p65主要被促炎信号如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)激活[57]。Nrf2与NF-κB p65是调节细胞氧化还原平衡及应激和炎症反应的关键因子,二者间存在功能性串扰与联系[58-59]。Shu等[60]发现γ-谷维素可通过2种不同的机制抑制NF-κB,即抑制NF-κB p65亚基的核易位,并激活Nrf2来降低NF-κB的表达,有利于机体抵抗APAP导致的肝脏损伤。
NF-κB p65还会被微生物产物靶向激活的Toll样受体4(Toll-like receptor 4,TLR4)激活[61]。组织损伤时释放的高迁移率组蛋白B1(high-mobility group box 1 protein B1,HMGB1)或某些内源性配体如热休克蛋白和染色质成分可能会激活TLR4,从而促进信号转导因子NF-κB p65在炎症通路的传导,使机体肝脏遭受严重的炎症反应[62]。Du等[63]通过研究赶黄草黄酮类成分山柰酚对抗APAP致肝损伤的作用机制,发现其主要通过抑制HMGB1/ TLR4/NF-κB信号通路和加重无菌性炎症损伤的炎症小体NOD样受体热蛋白结构域相关蛋白3(NOD- like receptor thermal protein domain associated protein 3,NLRP3)的激活,从而保护肝免受APAP导致的炎症反应和细胞凋亡。辣椒素可以显著改善APAP诱导的肝损伤,抑制氧化应激,其可能是通过抑制HMGB1/TLR4/NF-κB通路下调促炎因子TNF-α、白细胞介素-1β(interleukin-1β,IL-1β)及IL-6的表达发挥作用,并通过抑制B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)和cleaved Caspase-3的表达来减轻肝细胞凋亡[64]。
3.3 其他途径
Wang等[65]通过研究栀子苷对TG诱导的肝损伤的影响,发现栀子苷可以促进由转化生长因子-β1(transforming growth factor-β1,TGF-β1)介导的组织修复与再生,这种机制在抵抗肝损伤方面尤为重要。Zhou等[66]对含有没食子酸、异槲皮素的天然药物刺参乙醇提取物进行研究,发现其可有效抵抗APAP诱导的DILI,其作用机制与细胞色素酶的调节密切相关。刺参乙醇提取物中没食子酸、异槲皮素等有效成分可直接灭活核受体孕X受体(nuclear receptor pregnane X receptor,PXR),从而影响和基因的表达,并且该有效成分可间接抑制APAP激活的c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)的表达。此外,Ci等[36]通过建立异烟肼-利福平诱导的小鼠肝损伤模型,研究石斛中石斛碱对肝脏的影响,发现与脂质累积相关的微小RNA-295-5p(microRNA-295-5p,),并进一步验证了是石斛碱的作用靶点之一。
目前,中药干预DILI的作用机制研究大多仍停留在药效评价层面,其分子机制研究仍需深入探讨。此外,部分中药或有效成分在治疗DILI时并未考虑到本身是否会引起肝脏的损伤。笔者认为,未来可从以下几个方面开展:(1)基于临床用药特点开展中药防治DILI的基础研究,明确其有效性及对肝损伤的改善机制,指导中药临床合理组方配伍用药;(2)针对本身会引起肝损伤的药物应进行毒理研究及易感人群特征分析,提高中药的使用安全性和精准性;(3)基于网络药理学、代谢组学、蛋白质组学和脂质组学等系统生物学研究手段整合分析,探讨中药诱发肝损伤的生物学特征,并深入研究中药抗DILI的物质基础,从而为更多治疗DILI的创新药物提供科学依据。
中药及天然药物改善DILI的作用机制见表2。
表2 中药及天然药物改善DILI的作用机制
Table 2 Mechanism of traditional Chinese medicine and natural medicine in improving DILI
作用机制中药及有效成分造模剂给药剂量/(mg·kg−1)检测指标作用机制文献 氧化应激铁皮石斛APAP50、100、200AST、ALT、丙二醛、髓过氧化物酶、活性氧、Keap1 ↓,谷胱甘肽、CAT、T-AOC、Nrf2、GCLC、GCLM、HO-1、NQO1↑调节Nrf2/Keap1信号通路47 长果婆婆纳醋酸乙酯提取物APAP300、600、900AST、ALT、T-AOC、活性氧↓,Nrf2、p62、GCLC、GCLM、HO-1、NQO1 ↑激活p62/Keap1/Nrf2信号通路50 慈菇多糖异烟肼-利福平200、400、800AST、ALT、丙二醛↓,谷胱甘肽、SOD、CAT、Nrf2、HO-1 ↑激活Nrf2信号通路52 甘草根提取物TP120、240、480AST、ALT、丙二醛↓,UGT1A、SOD、Nrf2、BSEP、MRP2、GSH-Px ↑作用于Nrf2通路并激活BSEP、UGT1A、MRP2表达53 牛蒡子TP500AST、ALT、活性氧↓,HO-1、NQO1、Nrf2↑降低Nrf2通路相关蛋白HO-1、NQO1和Nrf2的表达55 炎症反应γ-谷维素APAP7、14AST、ALT、LDH、丙二醛、IL-1β、IL-6、TNF-α、一氧化氮、Bax、Bcl-2、NF-κB p65、环氧合酶-2、iNOS ↓,Nrf2、T-SOD、谷胱甘肽、T-AOC、HO-1、NQO1 ↑抑制NF-κB p65亚基的核易位,并激活Nrf2降低NF-κB的表达60 柠檬苦素APAP40、80AST、ALT、TNF-α、NF-κB p65、iNOS、COX2、Caspase-3、Bcl-2、Bax ↓,谷胱甘肽、Sirt1、Nrf2 ↑上调Sirt1,激活Nrf2抗氧化通路,抑制NF-κB的活化,抑制炎症反应56 赶黄草APAP30、60AST、ALT、丙二醛、TNF-α、IL-1β、IL-6、Bax、Bcl-2、TLR4、NF-κB p65、HMGB1、NLRP3 ↓,HO-1、谷胱甘肽、SOD、NQO1 ↑抑制HMGB1/TLR4/NF-κB信号通路和NLRP3炎症小体激活63
续表2
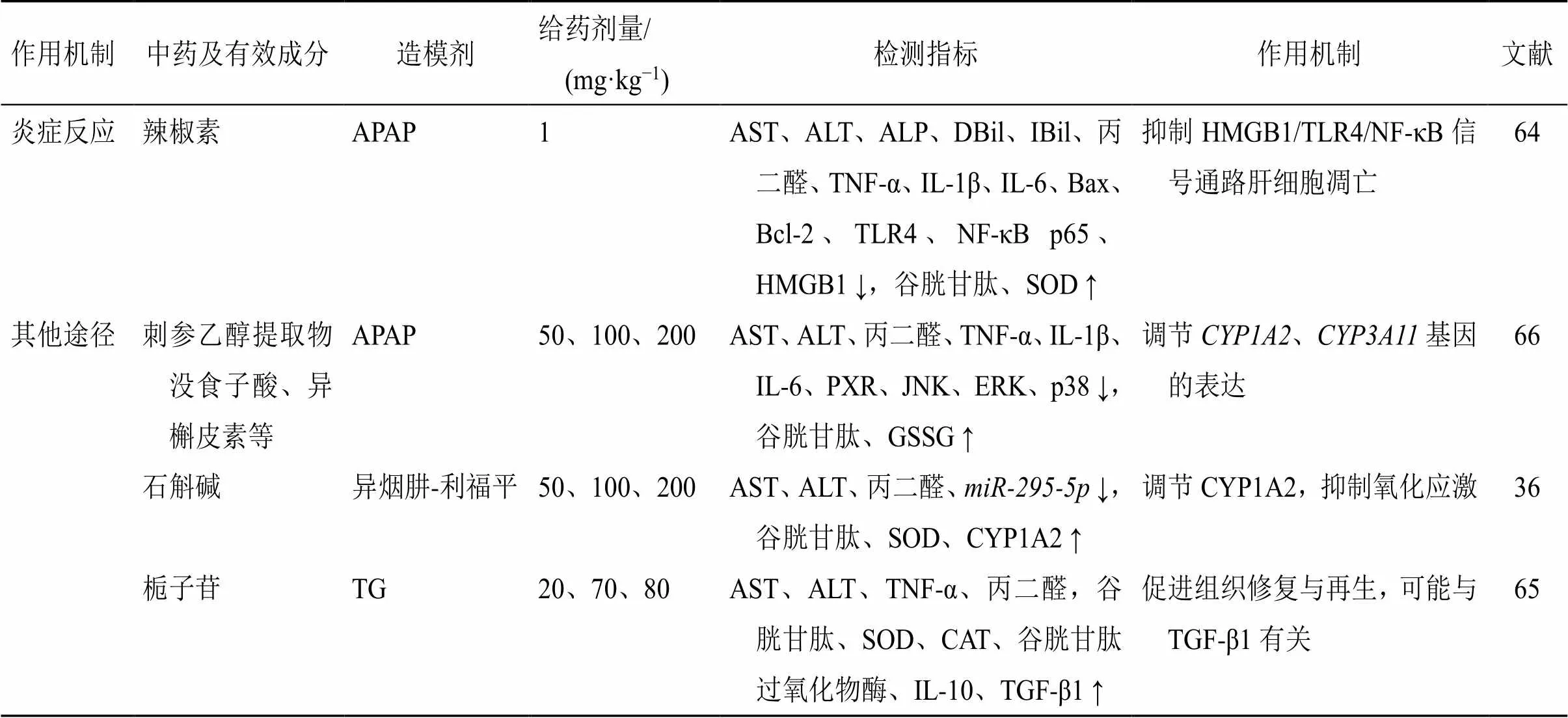
作用机制中药及有效成分造模剂给药剂量/(mg·kg−1)检测指标作用机制文献 炎症反应辣椒素APAP1AST、ALT、ALP、DBil、IBil、丙二醛、TNF-α、IL-1β、IL-6、Bax、Bcl-2、TLR4、NF-κB p65、HMGB1 ↓,谷胱甘肽、SOD ↑抑制HMGB1/TLR4/NF-κB信号通路肝细胞凋亡64 其他途径刺参乙醇提取物没食子酸、异槲皮素等APAP50、100、200AST、ALT、丙二醛、TNF-α、IL-1β、IL-6、PXR、JNK、ERK、p38 ↓,谷胱甘肽、GSSG ↑调节CYP1A2、CYP3A11基因的表达66 石斛碱异烟肼-利福平50、100、200AST、ALT、丙二醛、miR-295-5p ↓,谷胱甘肽、SOD、CYP1A2 ↑调节CYP1A2,抑制氧化应激36 栀子苷TG20、70、80AST、ALT、TNF-α、丙二醛,谷胱甘肽、SOD、CAT、谷胱甘肽过氧化物酶、IL-10、TGF-β1 ↑促进组织修复与再生,可能与TGF-β1有关65
↑-升高 ↓-降低 CAT-过氧化氢酶 T-AOC-总抗氧化能力 SOD-超氧化物歧化酶 iNOS-诱导型一氧化氮合酶
↑-increase ↓-decrease CAT-catalase T-AOC-total antioxidant capacity SOD-superoxide dismutase iNOS-induced nitric oxide synthase
4 结语与展望
随着我国医药卫生事业的发展及医疗资源的不断增加,更多的新药在用于疾病治疗的同时,可能引发的药源性疾病也随之增加。因此,预防药源性疾病的发生是保障临床用药安全环节之一[67]。DILI是药源性疾病中的常见类型,也是临床上导致急性肝衰竭的重要因素之一。建立和选择适宜动物模型是DILI发病机制和药物研究的关键。目前,DILI动物模型的建立方法主要通过给予相应诱导药物,常见的有APAP、异烟肼联合利福平、化疗药物及TG等。其中,由于方法简便和剂量相关性明显等优势,APAP诱导的DILI模型最为常用。TG等中药组分作为诱导剂仍存在化学组成不稳定和导致肝损伤机制不清等问题[68]。已有文献针对DILI的发生机制开展了多角度分析和探讨,但其生物标记物鉴定分析及分子机制阐明尚不全面,这为相关改善药物的功能评价和机制分析带来一定困难。未来仍需根据药物诱发肝损伤的临床证据,从诱导剂的给药剂量、给药方式、给药时间及肝损伤评价指标等方面开展DILI动物模型的系统优化。
中药在疾病预防、治疗和健康维护方面发挥重要的作用。然而,某些中药的滥用和误用常引起肝损伤。因此,加强中药引起的肝损伤及防治措施研究对于促进中医药现代化和国际化尤为必要。(1)应加强对于具有肝毒性中药的本草考证,厘清该类药物的传统加工炮制及配伍方法,分析该类药物产生肝毒性的可能因素;(2)基于临床大数据分析和统计手段,归纳总结相关中药引发肝损伤的患者临床证型与指证,进而开展易感人群的精准标定;(3)基于合适的生物学评价模型,构建中药化合物的“效-毒”关系,为中药潜在肝毒性发现和预测提供基础;(4)结合生物信息学技术对中药改善特定药物导致的肝损伤的机制展开分析,促进中西医有机结合,从而保障中药临床用药的安全性和有效性。
目前,多种中药及其有效成分被证实具有改善DILI作用,其药效机制大多涉及调节氧化应激及抑制炎症反应,且多种信号通过被证实介导了中药的保肝作用。鉴于不同诱因下的DILI的发病机制存在差异,应利用不同的DILI生物学模型系统研究中药相应的治疗机制特征,以便为临床的精准用药提供参考。此外,中药具有多成分多途径的整合作用特点,未来应基于多种信号途径的交互串扰开展中药及成分抗DILI的机制研究。再者,中药抗DILI的“量-效”关系及用法仍需关注,观察其不同剂量及不同给药途径下对相关肝损伤的保护作用亦是保障中药临床用药安全性的重要依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Li M, Luo Q, Tao Y Y,. Pharmacotherapies for drug-induced liver injury: A current literature review [J]., 2021, 12: 806249.
[2] Miguel A, Azevedo L F, Araújo M,. Frequency of adverse drug reactions in hospitalized patients: A systematic review and Meta-analysis [J]., 2012, 21(11): 1139-1154.
[3] 陈帅, 杨长青. 药物性肝损伤治疗的进展与困惑 [J]. 临床肝胆病杂志, 2021, 37(11): 2505-2509.
[4] 苏怡菁, 江振洲, 张云, 等. 药源性特异质肝损伤及其发生机制的研究进展 [J]. 药学进展, 2012, 36(12): 546-551.
[5] 夏继伟, 付联群. 药源性肝损伤的研究进展 [J]. 世界最新医学信息文摘, 2017, 17(7): 33-34.
[6] 黄精俸, 江振洲, 王涛, 等. 药源性肝损伤的研究概述 [J]. 药学进展, 2008, 32(8): 357-362.
[7] 杜敏, 江振洲, 张陆勇. 常用免疫抑制剂致肝损伤的研究进展[J]. 药物评价研究, 2022, 45(5): 982-988.
[8] Kaplowitz N, Than T A, Win S. Acetaminophen hepatotoxicity: Strong offense and weakened defense [J]., 2020, 71(5): 1530-1532.
[9] Lee W M. Acetaminophen (APAP) hepatotoxicity-Isn’t it time for APAP to go away? [J]., 2017, 67(6): 1324-1331.
[10] Woolbright B L, Jaeschke H. Role of the inflammasome in acetaminophen-induced liver injury and acute liver failure [J]., 2017, 66(4): 836-848.
[11] Doi H, Horie T. Salicylic acid-induced hepatotoxicity triggered by oxidative stress [J]., 2010, 183(3): 363-368.
[12] 李红颖, 杨翠平, 靳洪涛. 常用药物肝损伤发生机制研究进展 [J]. 中国药物警戒, 2019, 16(12): 750-756.
[13] Huang S M, Liu M B, Fu F M,. High serum estradiol reduces acute hepatotoxicity risk induced by epirubicin plus cyclophosphamide chemotherapy in premenopausal women with breast cancer [J]., 2020, 11: 572444.
[14] Ricart A D. Drug-induced liver injury in oncology [J]., 2017, 28(8): 2013-2020.
[15] Emadi A, Jones R J, Brodsky R A. Cyclophosphamide and cancer: Golden anniversary [J]., 2009, 6(11): 638-647.
[16] Bahirwani R, Reddy K R. Drug-induced liver injury due to cancer chemotherapeutic agents [J]., 2014, 34(2): 162-171.
[17] Bath R K, Brar N K, Forouhar F A,. A review of methotrexate-associated hepatotoxicity [J]., 2014, 15(10): 517-524.
[18] Inoue K, Yuasa H. Molecular basis for pharmacokinetics and pharmacodynamics of methotrexate in rheumatoid arthritis therapy [J]., 2014, 29(1): 12-19.
[19] Björnsson E S. Drug-induced liver injury due to antibiotics [J]., 2017, 52(6/7): 617-623.
[20] Hoofnagle J H, Björnsson E S. Drug-induced liver injury- types and phenotypes [J]., 2019, 381(3): 264-273.
[21] Yew W W, Chang K C, Chan D P. Oxidative stress and first-line antituberculosis drug-induced hepatotoxicity [J]., 2018, 62(8): e02637-e02617.
[22] Metushi I, Uetrecht J, Phillips E. Mechanism of isoniazid- induced hepatotoxicity: Then and now [J]., 2016, 81(6): 1030-1036.
[23] Mitchell J R, Zimmerman H J, Ishak K G,. Isoniazid liver injury: Clinical spectrum, pathology, and probable pathogenesis [J]., 1976, 84(2): 181-192.
[24] Jin C H, Wu Z J, Wang L L,. CYP450s-activity relations of celastrol to interact with triptolide reveal the reasons of hepatotoxicity of[J]., 2019, 24(11): 2162.
[25] Ru Y, Luo Y, Zhou Y Q,. Adverse events associated with treatment ofhook F: A quantitative evidence synthesis [J]., 2019, 10: 1250.
[26] 司继刚, 赵群, 曹原. 对乙酰氨基酚肝毒性评价分析 [J]. 医学综述, 2015, 21(19): 3537-3539.
[27] 张丽娜, 郭卫东. 抗肿瘤药物引起的肝损伤 [J]. 世界最新医学信息文摘, 2016, 16(39): 29-30.
[28] Kuna L, Bozic I, Kizivat T,. Models of drug induced liver injury (DILI)-current issues and future perspectives [J]., 2018, 19(10): 830-838.
[29] McGill M R, Jaeschke H. Animal models of drug-induced liver injury [J]., 2019, 1865(5): 1031-1039.
[30] Wang M, Liu C Y, Wang T,. (+)-clausenamide protects against drug-induced liver injury by inhibiting hepatocyte ferroptosis [J]., 2020, 11(9): 781.
[31] Minsart C, Rorive S, Lemmers A,.-acetylcysteine and glycyrrhizin combination: Benefit outcome in a murine model of acetaminophen-induced liver failure [J]., 2020, 12(9): 596-618.
[32] Choi J, Park K H, Kim S Z,. The ameliorative effects of-2-oxothiazolidine-4-carboxylate on acetaminophen- induced hepatotoxicity in mice [J]., 2013, 18(3): 3467-3478.
[33] Kim M W, Kang J H, Jung H J,. Allyl isothiocyanate protects acetaminophen-induced liver injury via Nrf2 activation by decreasing spontaneous degradation in hepatocyte [J]., 2020, 12(11): 3585.
[34] 张云, 彭维兵, 王希敏, 等. 采用斑马鱼模型评价对乙酰氨基酚的肝脏毒性 [J]. 药物评价研究, 2013, 36(5): 351-354.
[35] Chowdhury A, Santra A, Bhattacharjee K,. Mitochondrial oxidative stress and permeability transition in isoniazid and rifampicin induced liver injury in mice [J]., 2006, 45(1): 117-126.
[36] Ci R, Zhang K, Zhu A,. Dendrobine attenuates isoniazid- and rifampicin-induced liver injury by inhibiting[J]., 2020, 39(12): 1671-1680.
[37] Enriquez-Cortina C, Almonte-Becerril M, Clavijo- Cornejo D,. Hepatocyte growth factor protects against isoniazid/rifampicin-induced oxidative liver damage [J]., 2013, 135(1): 26-36.
[38] 贾云鹏, 徐杰, 马玉, 等. EZH2对抗结核药物性肝损伤小鼠Nrf2-ARE通路的影响 [J]. 安徽医科大学学报, 2021, 56(2): 233-238.
[39] 彭勃, 苗明三, 王宇亮. 雷公藤多甙片致小鼠急性肝损伤的初步探讨 [J]. 中国中药杂志, 2003, 28(11): 1067-1070.
[40] 李媛媛, 王一旭, 王浩, 等. 逍遥散防治雷公藤多苷致肝损伤的作用机制 [J]. 中国实验方剂学杂志, 2020, 26(23): 76-82.
[41] 王君明, 刘菊, 崔瑛, 等. 金钱草提取物对雷公藤多苷致肝损伤的保护作用及机制研究 [J]. 中国药学杂志, 2013, 48(1): 30-34.
[42] 付晓春, 沈小莉, 李红群, 等. 雷公藤多苷促进斑马鱼肝脏损伤和氧化应激的实验研究 [J]. 医学信息, 2019, 32(5): 79-82.
[43] 吴豪, 宋捷, 仲青香, 等. 基于斑马鱼模型研究补骨脂肝损伤效应及作用机制 [J]. 南京中医药大学学报, 2017, 33(3): 263-267.
[44] Cengiz M, Cetik Yildiz S, Demir C,. Hepato- preventive and anti-apoptotic role of boric acid against liver injury induced by cyclophosphamide [J]., 2019, 53: 1-7.
[45] Salama R M, Mohamed A M, Hamed N S,. Alogliptin: A novel approach against cyclophosphamide- induced hepatic injury via modulating SIRT1/FoxO1 pathway [J]., 2020, 9(4): 561-568.
[46] Chen C, Liu Y H, Cheng S B,. The hepatoprotective effects of XCHD and MgIG against methotrexate-induced liver injury and inflammation in rats through suppressing the activation of AIM2 inflammasomes [J]., 2020, 216(4): 152875.
[47] Lin G S, Luo D D, Liu J J,. Hepatoprotective effect of polysaccharides isolated fromagainst acetaminophen-induced liver injury in mice via regulation of the Nrf2-Keap1 signaling pathway [J]., 2018, 2018: 6962439.
[48] Bellezza I, Giambanco I, Minelli A,. Nrf2-Keap1 signaling in oxidative and reductive stress [J]., 2018, 1865(5): 721-733.
[49] Sies H, Berndt C, Jones D P. Oxidative stress [J]., 2017, 86: 715-748.
[50] Lu Q X, Tan S C, Gu W Q,. Phytochemical composition, isolation and hepatoprotective activity of active fraction fromagainst acetaminophen-induced acute liver injury via p62-Keap1- Nrf2 signaling pathway [J]., 2019, 243: 112089.
[51] Chao X J, Wang H, Jaeschke H,. Role and mechanisms of autophagy in acetaminophen-induced liver injury [J]., 2018, 38(8): 1363-1374.
[52] Wang J, Luo W Z, Li B,.polysaccharide protects against isoniazid- and rifampicin- induced hepatic injury via activation of nuclear factor E2-related factor 2 signaling in mice [J]., 2018, 227: 237-245.
[53] Tan Q Y, Hu Q, Zhu S N,. Licorice root extract and magnesium isoglycyrrhizinate protect against triptolide- induced hepatotoxicity via up-regulation of the Nrf2 pathway [J]., 2018, 25(1): 1213-1223.
[54] Wu Z R, Bai Z T, Sun Y,. Protective effects of the bioactive natural product-trans-caffeoyldopamine on hepatotoxicity induced by isoniazid and rifampicin [J]., 2015, 25(22): 5424-5426.
[55] Zhou Y Y, Xia L, Yao W Q,. Arctiin antagonizes triptolide-induced hepatotoxicity via activation of Nrf2 pathway [J]., 2020, 2020: 2508952.
[56] Yang R Y, Song C Q, Chen J X,. Limonin ameliorates acetaminophen-induced hepatotoxicity by activating Nrf2 antioxidative pathway and inhibiting NF-κB inflammatory response via upregulating Sirt1 [J]., 2020, 69: 153211.
[57] Lawrence T. The nuclear factor NF-kappaB pathway in inflammation [J]., 2009, 1(6): a001651.
[58] Wardyn J D, Ponsford A H, Sanderson C M. Dissecting molecular cross-talk between Nrf2 and NF-κB response pathways [J]., 2015, 43(4): 621-626.
[59] Yu M, Li H, Liu Q M,. Nuclear factor p65 interacts with Keap1 to repress the Nrf2-ARE pathway [J]., 2011, 23(5): 883-892.
[60] Shu G W, Qiu Y H, Hao J,. γ-Oryzanol alleviates acetaminophen-induced liver injury: Roles of modulating AMPK/GSK3β/Nrf2 and NF-κB signaling pathways [J]., 2019, 10(10): 6858-6872.
[61] Oeckinghaus A, Hayden M S, Ghosh S. Crosstalk in NF-κB signaling pathways [J]., 2011, 12(8): 695-708.
[62] Karin M, Lawrence T, Nizet V. Innate immunity gone awry: Linking microbial infections to chronic inflammation and cancer [J]., 2006, 124(4): 823-835.
[63] Du Y C, Lai L, Zhang H,. Kaempferol frompursh suppresses HMGB1/TLR4/ NF-κB signaling and NLRP3 inflammasome activation in acetaminophen-induced hepatotoxicity [J]., 2020, 11(9): 7925-7934.
[64] Zhan X, Zhang J Q, Chen H,. Capsaicin alleviates acetaminophen-induced acute liver injury in mice [J]., 2020, 220: 108578.
[65] Wang J M, Miao M S, Qu L B,. Protective effects of geniposide againstglycosides (TG)-induced liver injury and its mechanisms [J]., 2016, 41(1): 165-173.
[66] Zhou Z X, Qi J, Zhao J,.ameliorates acetaminophen-induced acute liver injury in mice [J]., 2021, 265: 113392.
[67] 吴育, 周浓, 梅春梅. 基于FXR-SULT1E1通路探究盐补骨脂致小鼠胆汁淤积性肝损伤的性别差异 [J]. 中草药, 2023, 54(9): 2802-2811.
[68] 蔡琼, 杨星月, 李芝奇, 等. 基于机体状态和功能因素探讨药物诱导肝损伤的研究进展 [J]. 中草药, 2022, 53(17): 5523-5530.
[69] 肖小河. 药源性疾病及其风险防控 [J]. 药学进展, 2018, 42(3): 161-163.
Research progress on evaluation model and action mechanisms of traditional Chinese medicine against drug-induced liver injury
WANG Cun-ping1, LUO Qiu-lin1, SHA Yu-ru1,TAN Rui2, GU Jian1, GONG Pu-yang1
1. School of College of Pharmacy, Southwest Minzu University, Chengdu 610200, China 2. School of College of Life Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China
The liver is the main organ of drug metabolism. Drug-induced liver injury (DILI) is one of the adverse reactions that is caused by drug overdose or improper use. Nonsteroidal anti-inflammatory drugs and antibacterial drugs may induce liver injury. The mechanism of DILI is mainly related to cytochrome P450 (CYP450), mitochondrial dysfunction, drug metabolic response, oxidative stress, inflammatory response and other biochemical reactions. The traditional Chinese medicine (TCM) has anti-liver injury effects via inhibiting oxidative stress and inflammation, reducing hepatocyte apoptosis and affecting the CYP450 enzyme system. The review summarizes the mechanisms of DILI development, the methods of establishing DILI animal models and the mechanism of TCM intervention, aiming to provide reference for the rational selection of animal models of DILI and the study of TCM prevention and treatment mechanism.
drug-induced liver injury; animal model; traditional Chinese medicine; acetaminophen; isoniazid; rifampicin; tripterygium glycosides
R285
A
0253 - 2670(2023)17 - 5796 - 10
10.7501/j.issn.0253-2670.2023.17.032
2023-03-25
国家自然科学基金资助项目(82174083);国家自然科学基金青年科学基金项目(82004069);四川省中医药管理局重大项目(2023ZD05)
王存萍,硕士研究生,研究方向为中药药理学。E-mail: wangcunping97@163.com
顾 健(1967—),教授,博士,从事中药及民族药创新药物研究与开发。E-mail: gujiancd@163.com
龚普阳(1990—),副教授,博士,从事中药药效物质基础研究。E-mail: gongpuyang1990@163.com
#共同第一作者:罗秋林,硕士研究生,研究方向为中药药理学。E-mail: qiulin1104@163.com
[责任编辑 赵慧亮]

