子宫内膜癌组织中整合素α5、转移相关基因2 的表达及与预后的相关性
陈湧彧 吕承宇
(1 福建省漳浦县医院 漳浦 363200;2 福建省妇幼保健院 漳浦 350001)
子宫内膜癌是妇科常见的恶性肿瘤之一,发病率占全部妇科肿瘤的20%~30%。子宫内膜癌临床以阴道异常出血为主要表现,疾病早期的异常出血量相对较少,部分可出现阴道异常排液与恶臭脓血样的液体,且会合并下腹部隐痛,而至病情晚期则可触及下腹部增大子宫,部分合并积脓的患者可有明显的触痛感[1]。已有研究表明[2],子宫内膜癌的早期症状相对明显,且癌细胞生长略微缓慢,大部分患者在就诊时病灶相对局限,预后较好、生存率较高。故尽早分析子宫内膜癌的发病机制可提高早期诊断率,制定治疗方案并改善子宫内膜癌患者预后。目前,临床已有大量研究证明,原癌与抑癌基因在子宫内膜癌、子宫内膜癌等多种癌症中异常表达,但对于具体的分子机制尚未完全明确[3~4]。转移相关基因2(MTA2)是近年发现的重要核受体调节因子,在核酸、族蛋白、生物胺、族蛋白及蛋白质甲基化过程中作为合成多胺与谷胱甘肽的主要甲基供体,故推测调节MAT2 表达可影响细胞生长、分化与功能[5]。整合素α5(ITGα5)在诸多肿瘤细胞中呈高水平表达,可对肿瘤细胞的增殖、侵袭等生物行为均有一定的调节作用[6]。目前,两者在子宫内膜癌组织的表达已有诸多研究证实,但对于两者与预后之间关系的报道鲜有。本研究将分析子宫内膜癌组织中ITGα5、MTA2 表达及与预后的相关性。现报道如下:
1 资料与方法
1.1 一般资料 前瞻性选取2019年1月至2020年1月医院收治的98 例子宫内膜癌患者为研究对象。年龄40~73 岁,平均年龄(48.37±5.68)岁;肿瘤直径1.3~7.8 cm,平均肿瘤直径(4.48±1.37)cm;体质量指数(BMI)19.8~29.4 kg/m2,平均BMI(22.65±2.73)kg/m2;宫颈癌国际妇产科联盟(FIGO)分期:Ⅰ期67 例,Ⅱ期31 例;病理分级:低/中分化59 例,高分化39 例;子宫内膜癌类型:内膜样癌86 例,非内膜样癌12 例;浸润情况:较浅肌层受侵69 例,深肌层受侵29 例。本研究经医院医学伦理委员会审核批准通过。
1.2 入组标准 纳入标准:(1)符合《子宫内膜癌诊断与治疗指南(第四版)》[7]中子宫内膜癌相关诊断标准,且经组织病理学检查确诊;(2)癌旁组织均为诊刮、宫腔镜或手术所收集的组织;(3)入组前均未接受过放化疗、激素治疗等;(4)均签署知情同意书。排除标准:(1)合并其他恶性肿瘤者;(2)合并多脏器功能不全者;(3)合并严重自身免疫系统、凝血功能障碍者;(4)伴认知及精神功能障碍者。
1.3 研究方法
1.3.1 ITGα5、MTA2 检测方法 收集所有患者子宫内膜癌组织与癌旁组织标本,制作组织匀浆,以2900 r/min 离心20 min(半径为10 cm),分离上清液,存于-80℃的环境中待检。采用免疫组织化学法(SP)检测ITGα5、MTA2 的表达。MTA2:采用Trizol法提取组织中总RNA,将总RNA 逆转录试剂盒按照说明书相关操作步骤反转录为cDNA,反转录的条件为35℃环境下30 min,75℃环境下10 min;以U 6 为 内 参 ,U 6 上 游 序 列 :5′-CTCGCTTCGGCAGCACA-3′,下游序列:5′-CGCTTCACGAATTTGCGT-3′。MTA2 上游序列:5′-TGTACCGGGTGGGAGATTAC-3′,下游序列:5′-TGAGGCTACTYAGAAATGTCCCTG-3′。反应条件如下:95℃预变性10 min,95℃变性15 s,60℃退火30 s,72℃下延伸30 s,连续进行40 个循环。ITGα5 采用实时荧光定量聚合酶链反应(qRT-PCR)检测ITGα5 的表达,提取总RNA,逆转录为cDNA,进行PCR 的扩增,U 6 正向序列:5′-GGCTACAGCAACAGGGTA-3′,反向序列:5′-TTTGGTTGAGCACAGGGT-3′ ;ITGα5 正向序列:5′-AACGCTGGCTCCGAAAACTT-3′,反向序列:5′-CCTAAGGCGGTAAAATGCC-3′。在扩增后构建溶解曲线,ITGα5、MTA2 均以2-△△CT法计算表达量。
1.3.2 预后 对所有患者进行3年的随访,以死亡为终点事件,统计生存率。
1.4 统计学方法 采用SPSS23.0 软件处理数据,计量资料以(±s)表示,采用t检验;计数资料以%表示,采用χ2检验;采用线性回归分析检验ITGα5、MTA2 表达与预后的相关性;绘制受试者工作特征(ROC)曲线分析ITGα5、MTA2 表达量与子宫内膜癌患者预后的预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1 预后 随访3年,98 例患者死亡23 例(23.47%),生存75 例(76.53%),分别纳入生存组与死亡组。
2.2 子宫内膜癌中ITGα5、MTA2 表达情况 子宫内膜癌癌组织中ITGα5、MTA2 表达均较癌旁组织高(P<0.05)。见表1。
表1 子宫内膜癌中ITGα5、MTA2 表达情况对比(±s)
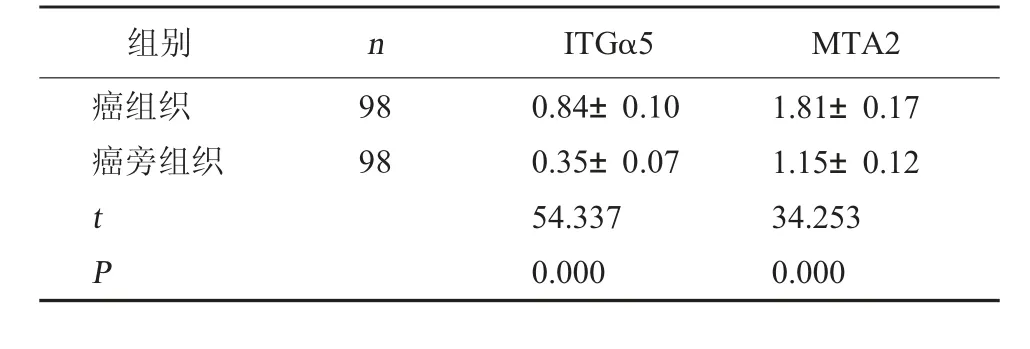
表1 子宫内膜癌中ITGα5、MTA2 表达情况对比(±s)
组别nITGα5MTA2癌组织癌旁组织9898 t P 0.84±0.100.35±0.0754.3370.0001.81±0.171.15±0.1234.2530.000
2.3 生存组与死亡组ITGα5、MTA2 表达情况 死亡组的ITGα5、MTA2 表达均较生存组高(P<0.05)。见表2。
表2 生存组与死亡组ITGα5、MTA2 表达情况对比(±s)
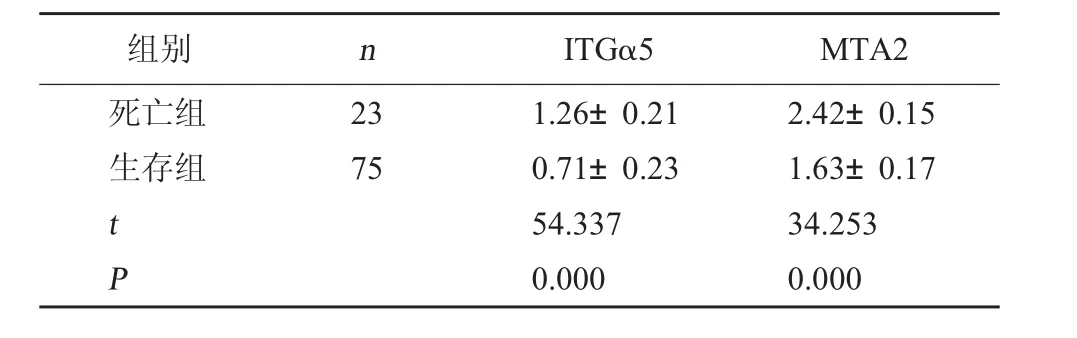
表2 生存组与死亡组ITGα5、MTA2 表达情况对比(±s)
组别nITGα5MTA2死亡组生存组2375 t P 1.26±0.210.71±0.2354.3370.0002.42±0.151.63±0.1734.2530.000
2.4 ITGα5、MTA2 表达与子宫内膜癌预后的相关性分析 线性回归分析显示,ITGα5、MTA2 均与子宫内膜癌预后死亡的发生相关(P<0.05)。见表3。
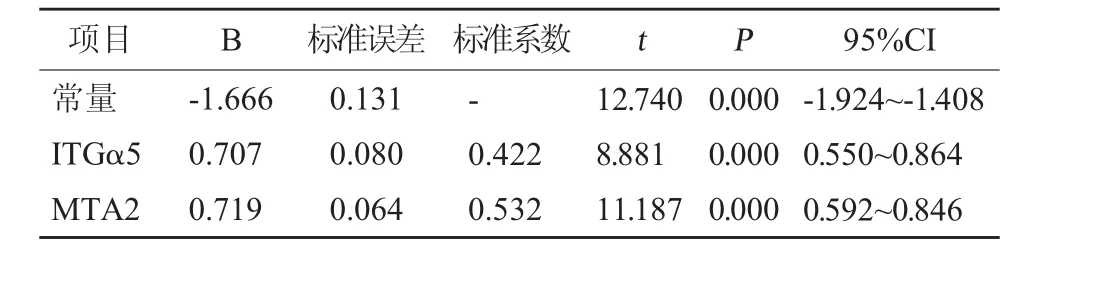
表3 ITGα5、MTA2 表达与子宫内膜癌预后的相关性分析
2.5 ITGα5、MTA2 及联合对子宫内膜预后的预测值分析 将ITGα5、MTA2 及联合作为检验变量,将预后作为状态变量(1=死亡,0=生存),绘制ROC曲线(见图1),结果显示,ITGα5、MTA2 及联合预测子宫内膜预后的曲线下面积(AUC)分别为0.852(0.790~0.913)、0.851(0.790~0.912)、0.948(0.917~0.980),具有一定预测价值。见表4、图1。

图1 ITGα5、MTA2 及联合对子宫内膜预后预测价值
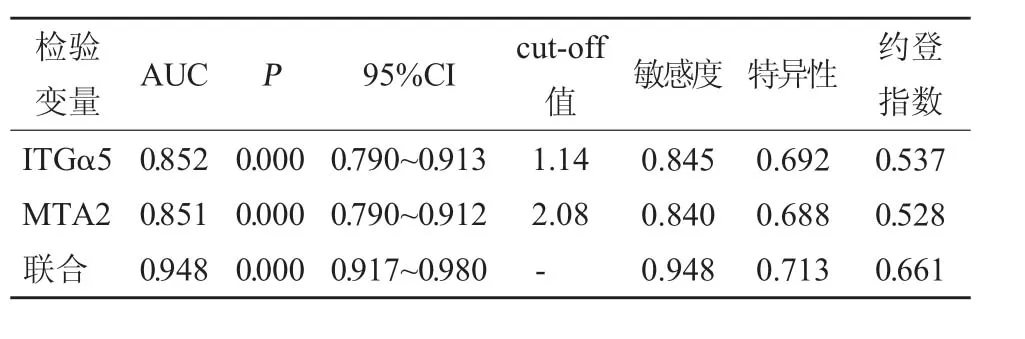
表4 ITGα5、MTA2 及联合对子宫内膜预后的预测价值分析
3 讨论
子宫内膜癌属于生殖内分泌失调性疾病,临床多认为是由于雌激素对子宫内膜造成过度刺激而引发该病,另外高血压、糖尿病、肥胖、遗传等因素均被认为是诱发该病的高危因素。近年来,子宫内膜癌的发病率有逐渐升高的趋势,且呈年轻化发展,但由于疾病早期往往无明显的相关阳性体征表现,故提高早期子宫内膜癌的诊断率具有重要意义。目前,临床针对子宫内膜癌的诊断以影像学、血清肿瘤标志物、组织病理学检查等为主要方式,虽组织病理学检查是目前诊断的金标准,但因属于有创检查无法成为临床首选。子宫内膜癌尚无特异敏感的肿瘤标志物,而影像学诊断仅可作为辅助诊断方式。因此,寻找一种新的标志物对评估患者预后具有重要意义。有研究表明[8],肿瘤在发生与发展过程中会伴随多个癌基因、抑癌基因异常表达,在不同因素的共同影响下相互作用,从而促进子宫内膜癌的发生、发展与预后。
ITGα5 作为整合素家族的重要成员之一,在染色体上位于12q11~q13 编码纤维连接受体体蛋白ITGα5,具有细胞黏附于信号通路受体功能,在癌细胞增殖、凋亡、侵袭等生物学功能中扮演重要角色[9]。相关研究表明[10~11],ITGα5 可通过与细胞外结构与基质蛋白相结合,在胶质瘤、乳腺癌等肿瘤疾病的侵袭预后中存在一定关系。肿瘤的远处转移过程相对复杂,多涉及相关基因与多个通路的调节,但子宫内膜癌的相关基因机制尚未完全明确。Liu G 等[12]研究发现,通过对ITGα5 调节FAK/ERK 通路的抑制,可有效阻滞胃癌的转移,并诱导自噬细胞的死亡,可提示ITGα5 参与癌症的转移过程,下调ITGα5 表达可抑制癌症的转移。
子宫内膜癌细胞的扩散可能与多种途径共同作用密切相关,其中转移相关蛋白为转移调节因子,在临床卵巢癌、乳腺癌、子宫内膜癌中均有异常表达。MTA2 属于MTA 蛋白家族的成员,在核小体重构与组蛋白脱乙酰基的作用密切相关,通过上述途径可进行调节转录。Zhang H 等[13]研究发现,MTA2 出发的R 环反式调节BDH1 介导的β-羟丁酰化可增强肝细胞癌的增殖,均证实MTA2 可参与癌细胞的发生与发展。本研究结果显示,子宫内膜癌癌组织中ITGα5、MTA2 的表达均较癌旁组织高,提示ITGα5、MTA2 在子宫内膜癌中呈高水平表达。进一步研究发现,死亡组的ITGα5、MTA2 表达均较生存组高,经线性回归分析结果显示,ITGα5、MTA2 均与子宫内膜癌预后死亡的发生相关。分析原因可能如下:(1)MTA2 可通过整体基因表达的调控与Rho信号途径激活细胞骨架的重组;MTA2 在BAH 与ELM 结构域中的突变相对集中,可能会引起突变体与蛋白质的结合能力;MTA2 通过上调参与癌症的发生与转移等途径。(2)ITGα5:ITGα5 可介导肿瘤细胞与细胞外基质的黏附,从而增强肿瘤的侵袭能力;ITGα5 在结合相关配体后可介导诸多(FAK/Ras/MAPK、FAK/STAT 等)信号通路,促进肿瘤细胞的侵袭、转移、生长等能力[14]。Zou B 等[15]相关研究表明,ITGα5 可作为头颈部临床细胞癌的潜在生物标志物,且ITGα5 被鉴定为中枢基因并被证实与患者的总生存率存在显著的相关性。本研究进一步绘制ROC 曲线发现,ITGα5、MTA2 及联合预测子宫内膜预后的AUC 分别为0.852(0.790~0.913)、0.851(0.790~0.912)、0.948(0.917~0.980),具有一定预测价值。这提示ITGα5、MTA2 可提高子宫内膜癌的预后预测价值,临床可加强两者指标的监测,以评价患者的预后情况。综上所述,ITGα5、MTA2 在子宫内膜癌组织中呈高表达,且与患者不良预后具有一定关系,临床可加强对上述指标的监测,以评估患者预后。

