重复经颅磁刺激在治疗孤独症谱系障碍儿童康复中的应用
王红梅 吴晓静 李彩云 李功举
(漯河医学高等专科学校第三附属医院 河南 漯河 462000)
孤独症谱系障碍(ASD)也有自闭症之称,属于一种十分复杂的神经发育障碍性疾病,主要特征包括交流障碍、社交困难及行为刻板、局限等,在儿童群体中相对多发[1]。近年来,随着临床上对ASD 研究的逐渐深入,诸多研究指出大部分患儿同时存在躯体、精神症状,包括异常行为、胃肠道问题、睡眠障碍及焦虑症状等[2~3]。常规康复训练是近年来临床上治疗ASD 的常用手段,可通过语言、听觉及触觉等方面的功能训练来促进患儿神经功能恢复,减轻临床症状,但部分患儿疗效不佳[4]。重复经颅磁刺激(rTMS)属于一种无创且无痛的新型神经调控技术,可借助脉冲磁场对大脑皮质产生刺激作用,从而增强脑电波、神经递质之间的传递,有效调控异常脑功能,近年来在脑部疾病治疗中的应用较多,且取得了良好疗效[5~6]。鉴于此,本研究在常规康复训练基础上增加rTMS 治疗ASD,探讨其应用价值。现报道如下:
1 资料与方法
1.1 一般资料 按信封法将2021年1月至2022年12月漯河医学高等专科学校第三附属医院诊治的82 例ASD 患儿分为对照组与研究组,各41 例。对照组男25 例,女16 例;年龄4~12 岁,平均(5.63±1.40)岁;病程2~18 个月,平均(12.53±4.12)个月;病情严重程度:轻度23 例,中度14 例,重度4例。研究组男23 例,女18 例;年龄3~12 岁,平均(5.58±1.31)岁;病程3~20 个月,平均(12.66±3.70)个月;病情严重程度:轻度21 例,中度15 例,重度5例。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。本研究已通过漯河医学高等专科学校第三附属医院医学伦理委员会审核(伦理号:202000166)。
1.2 入组标准(1)纳入标准:符合ASD 诊断标准[7],并通过相关检查得以确诊;伴不同程度的性格孤僻、喊叫不回应及语言、行为刻板等症状;年龄3~12 岁;患儿家长知情且自愿签署相关同意书。(2)排除标准:有相关治疗史者;伴有其他类型精神器质性疾病者;合并先天性心脏病者;合并遗传代谢性疾病者;伴有颅内高压症状者;有癫痫发作史者;正接受相关药物治疗者;治疗依从性不佳者;磁刺激靶区周围有电子耳蜗或是医疗泵等植入体者。
1.3 治疗方法 对照组给予常规康复训练:康复治疗师以一对一的康复指导方式,借助游戏、情景再现等多种方法对患儿开展语言训练,若患儿还未具备语言能力,可先开展发声训练;通过使用软毛刷对患儿皮肤进行轻擦开展触觉训练,力度需控制为由轻到重,接着再改为触觉球、平衡触觉板及大笼球等方法;通过指导患儿进行趴地推球、袋鼠跳、蹦蹦床及阳光隧道滚筒等游戏开展本体感觉训练;同时,还需开展听觉训练、集体小组游戏训练及行为分析训练等。单次训练时间控制在30 min 左右,1 次/d,每周开展5 d。研究组在对照组基础上给予rTMS(经颅磁刺激仪型号为NK-IA04J,由河南弘亿康医疗器械有限公司生产)治疗:治疗前指导患儿保持坐位,佩戴好定位帽后,以单脉冲模式对患儿左侧拇指运动皮质区进行刺激,在此过程中连续微调磁刺激量和部位,将10 次连续性刺激中≥5 次可促使拇短展肌运动诱发电位波幅超过50 μV 的最小刺激强度作为静息运动阈值(RMT)。完成上述操作后,嘱咐患儿继续保持坐位,佩戴好定位帽,将左侧背外侧前额叶皮质区作为刺激靶区,设置磁刺激频率、强度分别为1 Hz、80%RMT,将各序列刺激时间设置为10 s,各序列刺激完成后的间隔时间设置为5 s,控制磁脉冲总量在1200 次左右,单次治疗时间控制在30 min 左右,1 次/d,每周治疗5 d。两组均治疗8 周。
1.4 观察指标 (1)核心症状改善情况:对比两组核心症状,包括社交障碍、刻板兴趣行为的改善情况,以改善1 项或2 项症状作为改善标准。(2)情绪识别能力:使用28 张表情图片,并于背面标记相应情绪,以下半张面孔、上半张面孔、倒置及正立顺序给予准确率评估。(3)孤独症行为:治疗前及治疗8周后采用孤独症行为检查量表(ABC)评估,涉及语言、感觉、交往、生活自理及躯体活动能力5 个方面,57 个项目,总分158 分。评分越高提示相关行为越多、越明显。(4)孤独症严重程度:治疗前及治疗8 周后采用儿童孤独症量表(CARS)评估,包括模仿、情感反应及人际关系等15 项,各项均以1~4 级评分法评分,总分60 分,评分越高提示孤独症越严重。(5)睡眠状况:治疗前及治疗8 周后采用儿童睡眠习惯问卷表(CSHQ)评估,包括就寝习惯、睡眠时间及异态睡眠等8 个方面,总评分99 分,评分越高提示睡眠状况越差。(6)认知功能相关指标:治疗前及治疗8 周后采集两组清晨空腹静脉血5 ml,抗凝处理后以荧光偏振免疫法检测两组同型半胱氨酸(Hcy)水平,以酶联免疫吸附试验检测两组脑源性神经营养因子(BDNF)水平。
1.5 统计学方法 采用SPSS25.0 软件处理相关数据。ABC 评分、CARS 评分、CSHQ 评分及认知功能相关指标等计量资料以(±s)表示,采用t检验;核心症状改善率、情绪识别能力准确率等计数资料以%表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组孤独症行为比较 治疗前,两组ABC 量表各项评分相比,差异无统计学意义(P>0.05);治疗8 周后,两组ABC 量表各项评分均下降,且研究组更低,差异有统计学意义(P<0.05)。见表1。
表1 两组ABC 量表评分比较(分,±s)
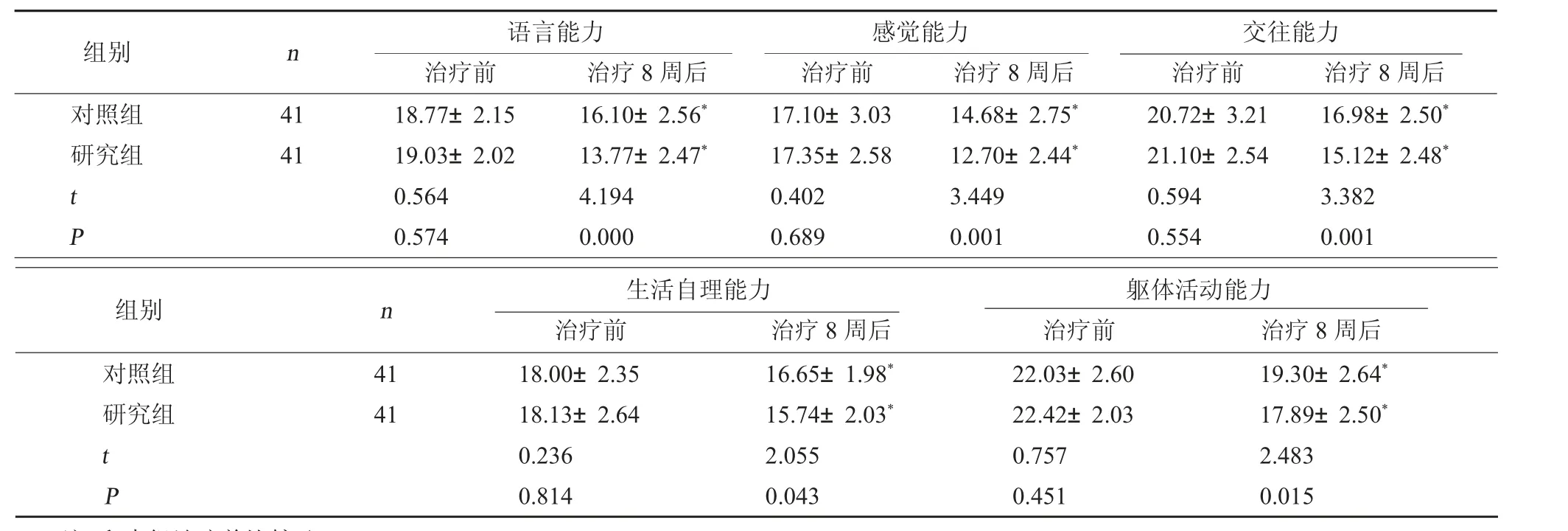
表1 两组ABC 量表评分比较(分,±s)
注:和本组治疗前比较,*P<0.05。
交往能力治疗前治疗8 周后对照组研究组组别n语言能力治疗前治疗8 周后感觉能力治疗前治疗8 周后4141 t P 18.77±2.1519.03±2.020.5640.57416.10±2.56*13.77±2.47*4.1940.00017.10±3.0317.35±2.580.4020.68914.68±2.75*12.70±2.44*3.4490.00120.72±3.2121.10±2.540.5940.55416.98±2.50*15.12±2.48*3.3820.001躯体活动能力治疗前治疗8 周后对照组研究组组别n生活自理能力治疗前治疗8 周后4141 t P 18.00±2.3518.13±2.640.2360.81416.65±1.98*15.74±2.03*2.0550.04322.03±2.6022.42±2.030.7570.45119.30±2.64*17.89±2.50*2.4830.015
2.2 两组核心症状改善情况比较 研究组核心症状改善率(95.12%)高于对照组(78.05%),差异有统计学意义(P<0.05)。见表2。
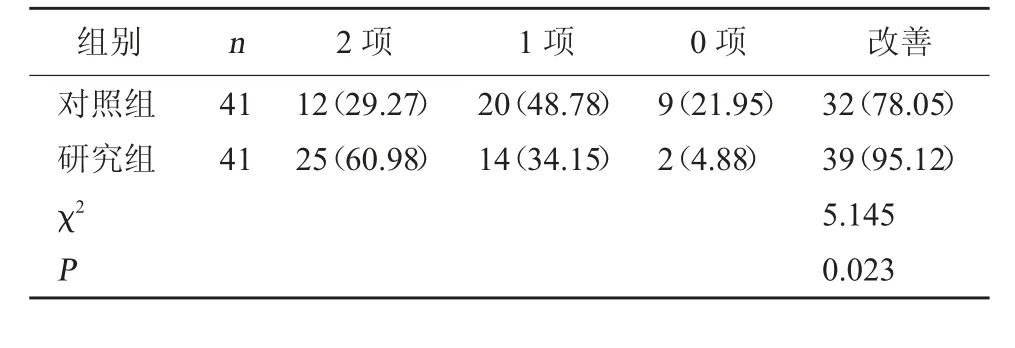
表2 两组核心症状改善情况比较[例(%)]
2.3 两组情绪识别能力比较 研究组对下半张面孔、上半张面孔、倒置及正立表情的情绪识别能力准确率均高于对照组,差异有统计学意义(P<0.05)。见表3。
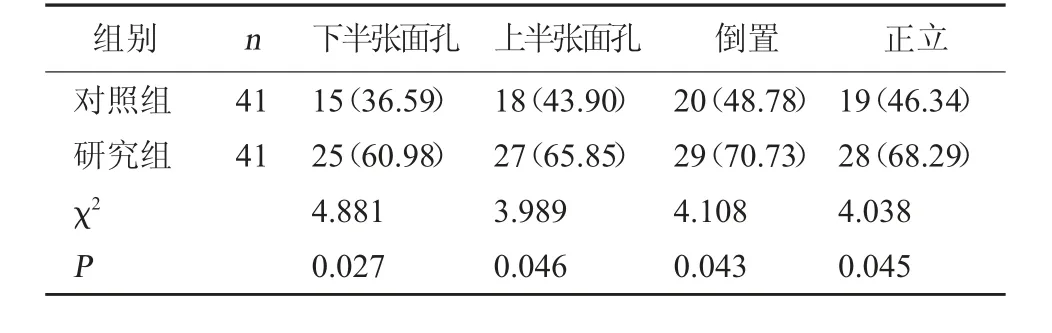
表3 两组情绪识别能力准确率比较[例(%)]
2.4 两组孤独症严重程度比较 治疗前,两组CARS 评分相比,差异无统计学意义(P>0.05);治疗8 周后,两组CARS 评分均下降,且研究组更低,差异有统计学意义(P<0.05)。见表4。
表4 两组CARS 评分比较(分,±s)
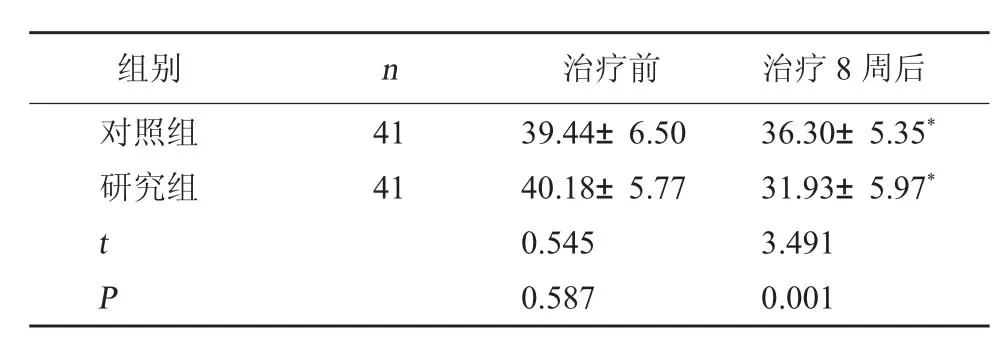
表4 两组CARS 评分比较(分,±s)
注:和本组治疗前比较,*P<0.05。
组别n治疗前治疗8 周后对照组研究组4141 t P 39.44±6.5040.18±5.770.5450.58736.30±5.35*31.93±5.97*3.4910.001
2.5 两组睡眠状况比较 治疗前,两组CSHQ 评分相比,差异无统计学意义(P>0.05);治疗8 周后,两组CSHQ 评分均下降,且研究组更低,差异有统计学意义(P<0.05)。见表5。
表5 两组CSHQ 评分比较(分,±s)

表5 两组CSHQ 评分比较(分,±s)
注:和本组治疗前比较,*P<0.05。
组别n治疗前治疗8 周后对照组研究组4141 t P 45.30±7.2746.75±6.300.9650.33737.65±7.10*32.76±6.80*3.1850.002
2.6 两组认知功能相关指标比较 治疗前,两组Hcy、BDNF 水平相比,差异无统计学意义(P>0.05);治疗8 周后,两组Hcy 水平均下降,BDNF 水平均上升,且研究组Hcy 水平更低,BDNF 水平更高,差异有统计学意义(P<0.05)。见表6。
表6 两组Hcy、BDNF 水平比较(±s)
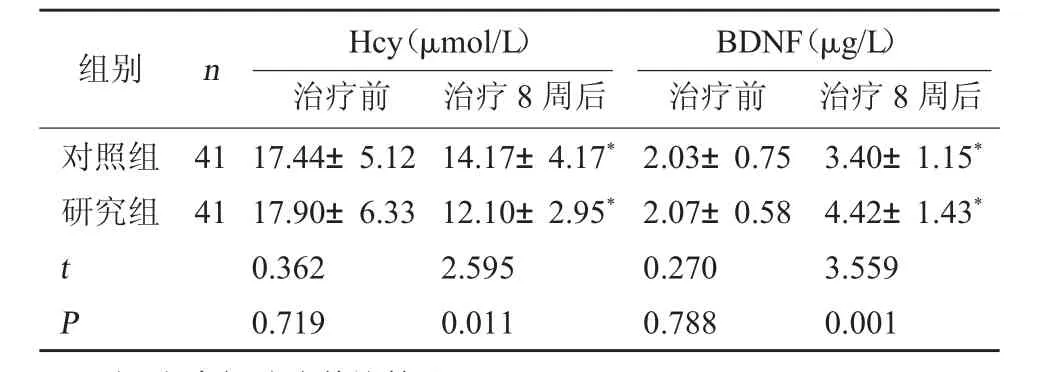
表6 两组Hcy、BDNF 水平比较(±s)
注:和本组治疗前比较,*P<0.05。
BDNF(μg/L)治疗前治疗8 周后对照组研究组组别nHcy(μmol/L)治疗前治疗8 周后4141 t P 17.44±5.1217.90±6.330.3620.71914.17±4.17*12.10±2.95*2.5950.0112.03±0.752.07±0.580.2700.7883.40±1.15*4.42±1.43*3.5590.001
3 讨论
ASD 是一种先天性精神疾病,目前对其具体病因还未完全明确,只认为主要与遗传、自身免疫等因素有关。轻中度ASD 患儿除存在刻板语言、行为等症状,还常伴沟通障碍、社会规则感知障碍等,如未及时治疗,随着病程延长,患儿症状将持续加重,严重降低其生活质量[8~9]。目前,临床上常用语言、听觉、触觉及本体感觉等康复训练来刺激患儿的神经元,以影响其情绪、动作等,并以重复的正确语言和行为来逐步弱化患儿既往的异常语言及行为状态,促进其症状缓解[10]。但近年来诸多研究发现,单用康复训练治疗ASD 的效果存在较大提升空间[11~12]。因此,如何进一步提高ASD 的疗效,促进患儿病情康复成为近年来临床研究的热点之一。
rTMS 可通过对局部中枢神经系统产生作用来改变皮质神经细胞的膜电位,发挥改善脑神经电活动和大脑代谢状态的作用。本研究结果显示,研究组核心症状改善率(95.12%)高于对照组(78.05%);治疗8 周后研究组ABC 评分、CARS 评分均低于对照组。与窦云龙等[13]研究结果具有一致性。提示在常规康复训练基础上增加rTMS 治疗ASD 有助于缓解患儿核心症状,促进行为改善。分析原因:rTMS 可通过不同频率的磁刺激形成磁场来刺激大脑皮层,从而形成局部感应电流,发挥改善患儿脑功能、缓解症状的作用;同时,该疗法的多次实施存在一定累积效应,可进一步促进患儿脑功能恢复,达到控制病情、改善行为的目的[14]。同时,本研究结果显示,研究组对下半张面孔、上半张面孔、倒置及正立表情的情绪识别能力准确率均高于对照组。提示在常规康复训练基础上增加rTMS 治疗ASD 有助于提升患儿对不同情绪的识别能力。究其原因在于rTMS 可借助脑电波超慢波的频率与大脑神经递质存在的对应性关系,并通过磁场于脑内形成的感应电流来调控诸多神经递质的电活动状态,从而有效影响患儿脑组织功能;同时,该调控并不会对神经细胞产生直接作用,促使动作电位的生成,而是借助放大、平衡等作用来强化原动作电位的功能,进而改善患儿脑组织功能,提高情绪识别能力[15]。
本研究结果还显示,治疗8 周后研究组CSHQ评分低于对照组。这提示在常规康复训练基础上增加rTMS 治疗ASD 有助于改善患儿睡眠状况。吴文华等[16]研究通过纳入合并睡眠障碍的199 例ASD患儿展开对照研究,结果发现,在睡眠行为教育与治疗基础上增加rTMS 可有效改善患儿的睡眠状况。与本研究结果趋同。这可能是由于rTMS 可通过促进患儿大脑神经细胞超极化,从而长时间抑制脑皮质的过度兴奋,发挥缓解患儿高觉醒状态的作用;同时,其还可在一定程度上平衡睡眠-觉醒相关激素和神经递质水平,进而促进睡眠-觉醒周期复常与维持。
Hcy 是蛋氨酸与半胱氨酸代谢过程中产生的重要中间产物,一般情况下,其在体内可被分解代谢,浓度维持于较低水平,一旦水平异常上升将会促进四氢生物蝶呤合成,影响神经功能,降低认知水平;作为一种具有神经营养作用的蛋白质,BDNF 及其受体在人体中枢神经系统内广泛表达,可通过促进神经细胞因子再生,进而有效改善神经功能,提高认知水平。本研究结果显示,治疗8 周后研究组Hcy水平低于对照组,BDNF 水平高于对照组。提示在常规康复训练基础上增加rTMS 治疗ASD 有助于改善患儿认知功能。这可能是由于rTMS 可通过局部电流刺激患儿大脑皮层来改善其神经功能,促进认知功能恢复。
综上所述,对ASD 患儿进行rTMS 治疗可显著缓解其核心症状,提高情绪识别能力,减轻病情,改善睡眠状况及认知功能。

