桑树磷脂酶MaPLA1-2D亚型4个基因的克隆与胁迫应答分析
郝博文,李瑞卿,夏 宇,尚姝婷,李文强,张敏娟*
(1 西北农林科技大学 生命科学学院,陕西杨凌 712100;2 西北农林科技大学 动物科技学院,陕西杨凌 712100)
磷脂酶(phospholipases)是一类能够水解磷脂的酶类,根据其水解磷脂位点的不同可将其分为磷脂酶A1(phospholipases A1,PLAl)、磷脂酶A2(PLA2)、磷脂酶C(PLC)和磷脂酶D(PLD),它们特异地作用于磷脂分子内部的各个酯键,形成不同的产物[1]。
磷脂酶A2大量存在于动物胰脏和植物组织中,催化水解磷脂的sn-2位酰基,磷脂酶A1广泛分布在动物细胞的溶酶体内,此外蛇毒及某些微生物中亦有,催化水解膜磷脂sn-1酰基,二者催化磷脂水解产生游离脂肪酸和溶血磷脂[2]。大量研究表明,PLC和PLD在植物生长发育、生物胁迫及非生物胁迫中起重要的调控作用[3-4]。
截至目前,有关植物磷脂酶A1的研究较为缺乏,已有报道集中在植物PLA1基因家族的序列分析和表达分析上,如亚麻芥(Camelinasativa)[5]、玉米(Zeamays)[6]、油菜(Brassicanapus)[7]、百合(Liliumbrownii)[8]、水稻(Oryzasativa)[9]等。
研究表明,植物花药不开裂基因(DAD1,defective in anther dehiscence1)产物具有磷脂酶A1活性,对其功能的解析相对深入。拟南芥AtDAD基因通过参与JA合成调节花药开裂[2]。辣椒(Capsicumfrutescens)CaPLA1在拟南芥中促进转基因植株生长[10]。麻疯树(Jatrophacurcas)JcDAD1通过参与JA合成途径调节花和果实的发育[11]。
因此,充分了解各磷脂酶的生化特性、时空表达关系以及脂质分子之间的转化关系将有利于深入解析植物磷脂酶的生物学功能,并促进磷脂酶基因在植物育种中的应用。
桑树(MorusalbaL.)属桑科桑属,自然类型多、分布区域广泛、在中国栽培历史悠久。桑树具有抗寒、抗旱、耐水湿特性,其果实、叶片、根等部分可食用、药用、饲用、观赏用,兼具经济效益和生态价值[12-14]。
近年来,桑树作为修复植物已广泛用于脆弱环境的生态治理[15-17]。本研究克隆桑树磷脂酶A1-2D亚家族基因,分析其亚细胞定位、时空表达及胁迫诱导表达模式,以进一步深入解析磷脂酶的生物学功能,促进磷脂酶基因在植物育种中的应用。
1 材料与方法
1.1 试验材料及干旱胁迫处理方法
成龄桑树‘红果2号’在周至桑树种质资源圃种植;本氏烟草和桑树幼苗在本实验室种植。
选取生长健壮、长势一致的40 d苗龄桑树幼苗,进行干旱胁迫实验,每个处理3株幼苗,干旱处理:桑树幼苗浇透水后断水模拟土壤自然干旱过程,对照组正常浇水。用土壤水分测量仪(TRIME-PICO 64/32 TDR,北京易科泰生态技术有限公司)测定土壤水分,从而评估土壤干旱程度。当土壤含水量为0时,即视为干旱胁迫第1天,于处理第4天取样。脱落酸(ABA)处理:以5 mL 0.1 mmol/L ABA溶液喷施幼苗,处理24 h后取样;高盐胁迫:采用100 mL 300 mmol/L NaCl溶液浇灌处理盆栽幼苗,处理第3天取样;低温胁迫:将幼苗置于4 ℃条件下处理24 h后取样。以上处理结束后,采集第三叶位(自上而下)叶片,经液氮速冻后转移至-80 ℃冰箱保存备用。
1.2 目的基因RT-PCR扩增及克隆
从NCBI基因组数据库获得桑树磷脂酶基因序列和氨基酸序列,并用在线软件Conserved Domain Search Service (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析候选序列的磷脂酶结构域。
以桑树‘红果2号’叶片为材料,参照试剂盒说明书提取总RNA(MiniBEST Universal RNA Extraction Kit,TaKaRa)并反转录成cDNA(PrimeScriptTMRT reagent Kit,TaKaRa)。以cDNA作为模板扩增目的基因,引物序列见表1。

表1 MaPLA1-2D基因克隆所用引物序列
PCR反应程序为94 ℃预变性10 min;94 ℃变性30 s;55 ℃退火45 s;72 ℃延伸1 min,35个循环;72 ℃反应10 min。
PCR产物用1%琼脂糖凝胶电泳(130 V,200 mA)检测,回收目的DNA片段并克隆至pMD18-T载体(TaKaRa,Dalian),转化大肠杆菌DH5α后进行测序验证。
1.3 生物信息学分析
蛋白分子量、等电点(pI)等蛋白质理化性质预测采用ExPasy数据库(https://web.expasy.org/protparam/);氨基酸序列比对分析使用在线软件PRALINE(https://www.ibi.vu.nl/programs/pralinewww/);保守结构域分析使用Conserved Domain Search Service数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi);基因结构分析使用Gene Structure Display Server 2.0软件(http://gsds.cbi.pku.edu.cn/);系统进化树构建利用软件MEGA 7.0,采用邻接法(Neighbor-Joining);启动子分析用Plantcare数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/);蛋白信号肽和跨膜区预测利用SignalP-5.0(https://services.healthtech.dtu.dk/services/SignalP-5.0/)和TMHMM(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)。
1.4 蛋白亚细胞定位
回收4个MaPLA1-2D基因序列的双酶切目的基因片段和表达载体p35S-GFP(pCAMIBA1301骨架)进行连接后获得p35S∷MaPLA1-2Ds-GFP融合表达载体,电击法转化重组质粒至农杆菌GV3101后作为蛋白亚细胞定位载体;分别将含有空载p35S-GFP和p35S∷MaPLA1-2Ds-GFP重组质粒的农杆菌在YEP培养基中培养至D600为1.0,然后注射本氏烟草叶片(20 d苗龄),每株注射2~3片,3个重复。
暗培养1 d后正常光照培养2 d,然后取叶片下表皮在激光共聚焦显微镜(ST8,Lecia)下观察GFP荧光信号。
1.5 qRT-PCR基因表达
根据桑树4个MaPLA1-2D基因序列设计qRT-PCR引物(表2),利用实时荧光定量RT-PCR检测4个MaPLA1-2D基因在桑树不同组织或各种非生物胁迫下的基因表达量。

表2 qRT-PCR引物序列
荧光定量PCR使用Bio-Rad CFX96 Touch荧光定量PCR仪,qRT-PCR反应体系和扩增程序按照PrimeScriptTMRT reagent Kit(Takara)试剂盒说明书操作,每个基因设置3个生物学重复和3个技术重复,以桑树Actin基因为内参,采用2-ΔΔCT法分析基因相对表达量。
2 结果与分析
2.1 MaPLA1-2D基因克隆与序列分析
以植物PLA1典型结构域序列搜索桑树基因组数据库(NCBI:txid981085)获得MaPLA1-2D基因序列,设计引物(表1)进行PCR扩增,得到4个MaPLA1-2D基因(图1,A),命名为MaPLA1-2D.1~MaPLA1-2D.4,其编码蛋白介于399~443个氨基酸,蛋白质分子量介于45~50 kD。MaPLA1-2D.1蛋白等电点为8.81,MaPLA1-2D.2~4等电点分别为5.62、5.95和5.38,均为不稳定蛋白和亲水蛋白(表3),且4个MaPLA1-2D蛋白序列中均不含有信号肽和跨膜区。
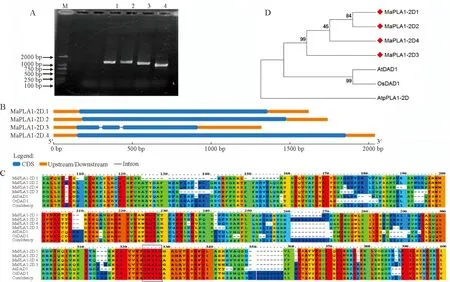
A. 桑树MaPLA1-2D.1/2/3/4基因的PCR克隆, M. DL2000;泳道1~4分别为MaPLA1-2D.1/2/3/4基因PCR产物;B. 桑树MaPLA1-2D.1/2/3/4基因结构分析;C. MaPLA1-2D.1/2/3/4基因与拟南芥AtDAD1、水稻OsDAD1氨基酸序列比对,以方框标示酯酶盒基序GHSLG;D. MaPLA1-2D.1/2/3/4基因进化分析。图1 MaPLA1-2D.1/2/3/4基因克隆及序列分析A. PCR cloning of MaPLA1-2D.1/2/3/4. M. DL2000; Lanes 1-4 are the PCR products of MaPLA1-2D.1/2/3/4, respectively; B. Gene structure analysis of MaPLA1-2D.1/2/3/4 genes; C. Alignment of amino acid sequences of MaPLA1-2D.1/2/3/4 and AtDAD1 and OsDAD1, box indicate motif GHSLG; D. Phylogenetic analysis of MaPLA1-2D.1/2/3/4.Fig.1 MaPLA1-2D.1/2/3/4 gene cloning and sequence analysis

表3 桑树MaPLA1-2D蛋白理化性质
基因结构分析显示,MaPLA1-2D.3基因序列有2个内含子,其余3个成员基因序列中均没有内含子序列(图1,B)。蛋白保守结构域分析表明MaPLA1-2D 4个成员蛋白质序列都含有三酰甘油脂酶结构域(PLN02454)。蛋白质多序列比对结果表明,MaPLA1-2D 4个成员与拟南芥AtDAD1和水稻OsDAD1具有相似性,且均含有酯酶盒GHSLG结构域(图1,C)。
序列进化分析表明,MaPLA1-2D 4个成员明显聚类在一起(图1D),表明其进化关系非常密切;MaPLA1-2D与拟南芥AtpPLA1-2D和AtDAD1以及水稻OsDAD1位于不同分支(图1,D),表明木本植物桑树和拟南芥、水稻的磷脂酶A1在序列上有明显的分化。
2.2 MaPLA1-2D基因启动子区功能元件分析
以MaPLA1-2D基因4个成员的核酸序列搜索桑树基因组数据库,找到每个基因编码区所在的川桑基因组序列叠连群contig,获取起始密码子上游2 500 bp的核酸序列用于下一步元件分析。经Plantcare数据库分析MaPLA1-2D基因上游2 500 bp DNA序列,结果表明MaPLA1-2D基因4个成员的启动子区含有多种生物胁迫和非生物胁迫响应相关顺式作用元件,如低温响应元件LTR、防御及胁迫响应元件(TC-rich repeats)、厌氧诱导元件ARE等(表4)。

表4 MaPLA1-2D基因启动子区序列顺式作用元件分布
如表4所示,除MaPLA1-2D.3外,另外几个成员的基因启动子区均含有干旱诱导响应元件(MBS);各成员的启动子区均含有激素响应元件,如脱落酸响应元件(ABA responsive element)、水杨酸应答元件(SA responsive element)、茉莉酸响应元件(MeJA responsive element);MaPLA1-2D.2和MaPLA1-2D.4基因启动子还含有赤霉素应答元件(GA responsive element),MaPLA1-2D.1/3基因启动子还含有乙烯应答元件(Ethylene responsive element, ERE),MaPLA1-2D.1基因启动子含有生长素应答元件TGA-element。
2.3 MaPLA1-2D蛋白的亚细胞定位
为了分析MaPLA1-2D.1~ MaPLA1-2D.4蛋白亚细胞定位,构建了p35S∷MaPLA1-2Ds-GFP融合表达载体,农杆菌侵染法转化烟草后观察绿色荧光信号。
结果表明,在转化p35S-GFP空载的烟草叶表皮细胞中,GFP荧光分布于细胞核、细胞质和细胞膜中(图2)。

绿色是GFP蛋白激发的荧光;红色是叶绿体自发荧光。图2 桑树PLA1-2D.1/2/3/4亚细胞定位结果Green indicates the fluorescence excited by GFP protein; red is the chloroplast autofluorescence.Fig.2 Subcellular localization of mulberry PLA1-2D.1/2/3/4
在分别注射含4个p35S∷MaPLA1-2Ds-GFP重组质粒的农杆菌后,烟草叶表皮细胞中绿色荧光信号明显与叶绿体自发红色荧光信号相重叠(图2),说明MaPLA1-2D.1~ MaPLA1-2D.4蛋白均定位于叶绿体。
2.4 MaPLA1-2D基因的组织表达模式和胁迫应答分析
qRT-PCR结果表明4个MaPLA1-2D基因在桑树冬芽、叶、根、雄花(staminate flower)和雌花(pistillate flower)中均有表达,但在叶和根中表达水平较高,其中MaPLA1-2D.1在根中表达水平最高(图3,A)。进一步利用qRT-PCR分析MaPLA1-2D基因4个成员在干旱、脱落酸(ABA)、高盐和低温胁迫处理后基因表达情况(图3,B)。结果显示,4个MaPLA1-2D基因的表达均受干旱、ABA、高盐和低温胁迫诱导,其中干旱和ABA处理导致4个MaPLA1-2D基因的表达均剧烈上调,盐胁迫处理对MaPLA1-2D.2基因表达的诱导作用相对明显。

图中误差线表示标准误,不同字母表示P<0.05水平具有显著性差异。图3 桑树PLA1-2D基因在5个不同组织中的表达模式和非生物胁迫表达模式Data is mean±standard error (SE) and different letters in a column indicate significant difference at P< 0.05 level.Fig.3 Expression model of MaPLA1-2D genes in 5 tissues and under abiotic stresses
3 讨 论
磷脂酶是催化磷脂水解释放游离脂肪酸的一类复杂而重要的酶,在植物体内分布广泛。磷脂酶几乎参与植物体所有的生命阶段,尤其在响应外界环境刺激中起着重要的作用[1,4]。植物磷脂酶A分为3个家族,PLA1、PLA2和patatin-related PLA(pPLA),它们分别催化膜甘油磷脂在sn-1、sn-2以及sn-1和sn-2位上的酰基水解。每个家族都由结构、催化和生理特性不同的多种磷脂酶亚型组成。与磷脂酶PLC和PLD相比,有关植物PLA基因功能的研究极为缺乏。
本研究克隆了桑树磷脂酶PLA1其中1个亚型PLA1-2D,该亚型包括4个基因,分别命名为MaPLA1-2D.1~MaPLA1-2D.4。蛋白序列分析发现,MaPLA1-2D亚型4个蛋白的分子量介于45~50 kD之间,4个蛋白均为亲水蛋白且不稳定。MaPLA1-2D与拟南芥花药不开裂基因(DAD1,defective in anther dehiscence1)的序列具有相似性。同拟南芥DAD1类似,MaPLA1-2D各成员均具有酯酶盒GHSLG和PLA1保守结构域(PLN02408),且蛋白定位在叶绿体,推测MaPLA1-2D与DAD1可能在功能上具有一些相似性[18]。本研究表明,桑树MaPLA1-2D成员在冬芽、叶片、根、雌雄花中都有表达,其中叶片和根的表达量显著高于其他组织,暗示MaPLA1-2D可能在桑树营养生长发育中发挥功能。
研究表明,植物PLA1基因启动子区含有多种胁迫应答顺式元件且受生物或非生物胁迫诱导,如油菜(Brassicanapus)[2,7,19]、亚麻芥(Camelinasativa)[5]、玉米(Zeamays)[6]、百合(Liliumbrownii)[8]、水稻(Oryzasativa)[9,20]、大豆(Glycinemax)[21]和茄子(Solanummelongena)[22]等。对MaPLA1-2D各成员的启动子区序列进行分析发现,各成员启动子区含有干旱响应元件、低温响应元件及ABA、水杨酸(SA)、茉莉酸(JA)或乙烯(Ethylene)、赤霉素(GA)的响应元件等与胁迫应答相关的顺式元件,表明MaPLA1-2D基因可能在桑树应答非生物胁迫中发挥广泛作用。本研究表明,桑树MaPLA1-2D各成员基因表达均在干旱和ABA处理后剧烈上调,MaPLA1-2D.2还受高盐处理显著诱导,表明MaPLA1-2D基因在这些非生物胁迫中发挥功能。
磷脂酶A1参与的α-亚麻酸合成过程是茉莉酸和茉莉酸甲酯合成途径中的第一步[19,23-25]。拟南芥AtDAD基因通过参与JA合成调节花药开裂。AtDAD基因编码1个磷脂酶A1,主要在叶片、根和花药中表达,AtDAD1的T-DNA插入突变植株表现为雄性不育,其花药不能正常开裂[18]。dad1突变体花蕾内茉莉酸(JA)及其甲酯(MeJA)含量只有野生型的22%,外源施用适量JA或JA合成前体亚麻酸可使突变体花粉发育恢复正常水平[18]。辣椒(Capsicumfrutescens)CaPLA1基因在拟南芥中过表达后,转基因植株比野生型植物生长得更快,表现出较长的根、叶、叶柄和花序[10]。麻疯树(Jatrophacurcas)JcDAD1基因通过参与JA合成途径调节花和果实的发育[11]。有关植物PLA1或DAD基因在应答干旱和其他胁迫中的功能鲜见报道。由于桑树的遗传转化非常困难,下一步构建MaPLA1-2D异源表达转基因植株将有助于进一步明确MaPLA1-2D在胁迫应答中的功能。此外,ABA、Ethylene、SA和JA被视为胁迫响应激素,植物通过灵活调节激素水平和信号来适应多种生物或非生物胁迫[19,25-26]。植物已经进化出多种策略来整合外源胁迫信号和内源发育信号,从而优化生长和胁迫反应之间的平衡,除了在正常条件下调控植物生长发育,还介导了各种环境胁迫反应的应答,从而调节植物的生长适应性。桑树MaPLA1-2D基因启动子区有多个ABA响应元件、JA响应元件和SA响应元件,其在激素介导的非生物胁迫适应性中的功能还需要进一步研究阐明。

