不同种源防风种子的萌发特性与鉴别
张郡月, 韩 祥, 杨 帆, 王英平, 刘双利
(吉林农业大学/人参新品种选育与开发国家地方联合工程研究中心, 长春 130118)
中药防风来源于伞形科植物防风[Saposhnikoviadivaricata(Turcz.) Schischk]未抽花茎的干燥根,具有解表祛风,胜湿止痛,止痉等功效[1],临床上主要用于治疗风寒感冒、发热头痛、风湿、关节肿痛等症。近年来对防风的研究主要集中于栽培技术,化学成分,药理作用等方面,而关于防风种子鉴别方面的研究鲜有报道。目前市场上防风种子种源混杂、种质混乱,以栽培种子混淆野生种源的现象十分严重。显微鉴别是中药材鉴定的常用方法之一[2],植物种子的油管、维管束等微形态结构研究,为植物种子分子系统学研究提供了重要的形态学支撑[3-6]。
种子萌发是植物生命的开端,是植物种群延续的重要环节,也是植物发育的重要阶段[7]。目前关于防风种子萌发的研究主要集中于如何利用外源因素打破其休眠[8]以及萌发期间生理生化的变化[9]方面,而对于防风种子萌发过程中内部形态结构变化的研究未见报道。因此,为了分析野生及栽培防风种子萌发过程中种胚的不同变化特征,摸索不同种源防风种胚发育过程的变化,确定其发育过程中胚形态的特征,本实验采用徒手解剖观察法,对不同种源萌发过程中的防风种子进行解剖,并在体式显微镜下透光观测,观察其种胚的变化。将已发芽的不同种源的防风种子在体式显微镜下进行跟踪观测,观察其胚轴的变化。探明萌发过程中种子形态结构的变化,旨在为防风种子萌发特性研究提供基础数据。
1 材 料
1.1 材料与试剂
药材样品为国内防风主产区实地基地采集(购),具体来源见表1,采集时间为2020年9月—2021年9月,经吉林农业大学刘双利副教授鉴定为伞形科植物防风的种子。番红O-固绿染色液(上海索莱宝,G375),FAA固定液(北京酷莱博,sl16222),无水乙醇(天津鑫铂特,20201018),二甲苯(天津鑫铂特,20200616),中性树胶(上海索莱宝,G8590)。

表1 防风种子采集信息Table 1 Collection information of Saposhnikovia divaricata (Turcz.) Schischk seeds
1.2 仪 器
体式显微镜(德国徕卡,Leica S9D),游标卡尺(哈尔滨量具集团责任有限公司,CD-10AX),电子分析天平(北京赛多利斯科学仪器有限公司,BSA-224S-CW),恒温水浴槽(杭州米欧仪器有限公司,WT100-3),研究级正置荧光显微镜(德国徕卡,LEICA DM6B),电热鼓风干燥箱(上海一恒科学仪器有限公司,DHG-9145A)、全密闭自动脱水机(德国徕卡,LEICA ASP300S),组织包埋机(德国徕卡,LEICA HistoCore Arcadia H),全自动轮转式半薄切片机(德国徕卡,LEICA RM2265),全自动染封工作站(德国徕卡,LEICA CV5030)。
2 方 法
2.1 石蜡切片的制作
2.1.1取材固定
选择健康饱满的防风种子,浸泡过夜,种子两端削去一截后浸于FAA固定液中,滴加10%的甘油,固定时间24 h以上。
2.1.2脱水透明
分别配制35%,50%,70%,85%,95%的乙醇,将防风种子依次在不同浓度乙醇的脱水缸中浸泡2 h,再浸入无水乙醇中2次,每次1 h。配制二甲苯和酒精体积比为1∶3的溶液,将脱水后的样品在该溶液中浸泡1 h,再在二甲苯和酒精体积比为1∶1的溶液中浸泡1 h,最后放入纯二甲苯溶液中2次,每次1 h,直至透明。
2.1.3浸蜡包埋
将透明后的样品放入二甲苯和石蜡体积比为1∶1的溶液中,放入40 ℃烘箱烘12 h,在纯石蜡中浸泡后再放入40 ℃烘箱中烘12 h,重复2次(因种子较硬,可适当延长浸蜡时间)。将包埋机温度调至65 ℃左右,包埋盒底膜放置工作台上,注入一层薄蜡,种子样品直立放入薄蜡中央,再将包埋盒底膜放置冷台上,当蜡成半凝固状态时,在顶部盖上白色包埋盒,再注入蜡液至其漫过白色包埋盒底部,然后转移至冷凝台,充分冷凝后取下蜡块,备用。
2.1.4切片展片
先将适当蒸馏水加入展片机,加热至38 ℃并保持恒温状态。将蜡块整修后固定在样本夹上进行修片,统一从种子的二分之一处横切面切片,并不断调节摇动转柄的速度,当出现完整质量较好的切片时,将其放入展片机中。当蜡片完全摊平,用载玻片将蜡片捞出,擦干表面水分,置于38 ℃的烘片机上,烤片12 h以上。
2.1.5脱蜡染色
将烘好的片子放入纯二甲苯溶液中10 min,重复2次,然后配制体积比为1∶1的二甲苯和无水乙醇溶液,将片子放入该溶液中5 min,再将其取出依次放入100%,95%,85%,70%,50%的乙醇溶液中,每次5 min。将样品放入番红溶液1~2 h后取出,再依次放入70%,85%无水乙醇中,放置5 min。然后将样品放入固绿溶液中,放置30 s,再将固绿溶液洗净。接着将样品依次放入95%,100%,100%,100%乙醇溶液中,每次5 min,再配制体积比为1∶1的二甲苯和无水乙醇溶液,放入该溶液中静置5 min,再置于二甲苯溶液中5 min,重复2次。最后将在二甲苯溶液中透明完成的载玻片取出,在样品中央滴入中性树胶,盖上盖玻片,待树胶凝固后,写好标签,完成封片。
2.2 防风种子萌发过程中油管变化的解剖观测方法
发芽试验用四分法,在每组供检样品中抽取50粒大小一致的种子,3次重复。将种子在3%的次氯酸钠溶液中浸泡20 min进行消毒,然后用蒸馏水冲洗掉残留的溶液。将蒸馏水、培养皿、滤纸及镊子等灭菌后使用,再将消毒后的种子在蒸馏水中浸泡24 h。将浸湿后的脱脂棉和滤纸(2 mm)置于培养皿上,并将浸泡后的种子整齐地排列于滤纸上,每个培养皿中放置50粒种子,重复3次。将培养皿编号后,放入25 ℃、12 h光照的恒温培养箱中培养。发芽过程中每隔1 d取一次样,最后将种子放入固定液中进行石蜡切片相关实验,石蜡切片方法同2.1。
2.3 防风种子萌发过程中种胚变化的解剖观测方法
防风种子萌发过程中种胚的观测方法是将野生、栽培防风种子进行发芽试验,发芽过程中每天取样,直至种子发芽。由于防风种子较小,胚与胚乳不易分离,剥离后种胚极易破碎,因此不将种胚进行剥离,而是用手术刀片对种子进行纵切,在体式显微镜下进行透光观察,并拍照记录。用游标卡尺测量种胚及胚乳的纵长并计算胚率。
胚率/%=(种胚纵长/胚乳纵长)×100%。
2.4 防风种子萌发过程中胚轴变化的观测
将发芽后的种子继续培养,在体式显微镜下拍照并记录,每天取样,用数字游标卡尺测量同一种子胚轴的长度,直至其子叶突破种皮为止。
2.5 数据处理
石蜡切片的图像用LAS X和Photoscape软件进行处理;油管的面积、周长及饱满度用ImageJ软件测量;所有数据用SPSS26软件进行显著性差异分析。
3 结果与分析
3.1 显微性状鉴别结果
防风种子横切面由外果皮、中果皮、内果皮、胚、油管、初生维管束以及种脊维管束构成(图1)。外果皮为不规则的椭圆形,且外壁有不规则凸起。中果皮为较为平坦的椭圆形,其外部有5个果棱,棱内有初生维管束,初生维管束旁具有荧光物质的圆状粗管,每2个间隔棱槽内有1个油管称为背生面油管,接合面两侧有2个合生面油管,多数防风种子有6个油管。内果皮与中果皮形状相似,内果皮与中果皮之间有一稍延长的细胞。内果皮内为种胚,含有丰富的胚乳细胞。种脊维管束位于接合面中央与内果皮相间处,多数种脊维管束向外凸起。

注:1为外果皮;2为中果皮;3为内果皮;4为胚;5为油管;6为初生维管束;7为种脊维管束;①为油管1;②为油管2;③为油管3;④为油管4;⑤为油管5;⑥为油管6。图1 防风种子显微性状特征与横切面油管分布Fig.1 Microscopic character characteristics of Saposhnikovia divaricata (Turcz.) Schischk seeds and distribution of tubing in cross section
通过对防风种子的横切面进行观察,可知栽培防风种子横切面呈椭圆形,多数种子果棱突起不明显,棱顶部圆滑,初生维管束较大,伴生粗管较小,种脊维管束向外凸起不明显,合生面有2个油管,背生面有4个油管。野生防风种子横切面呈近五边形,果棱突起明显,棱顶部钝圆,初生维管束较小,伴生粗管较大,种脊维管束向外凸起明显,合生面有2个油管,背生面有4个油管。
3.2 防风种子萌发过程中油管变化的解剖观测
防风种子萌发过程中油管的变化情况见图2。防风种子从培养到萌芽历经7 d,从第1天到第7天,油管内的油滴及红色荧光物质由多变少,油管逐渐变得易破碎,油管管腔变得越来越空洞,油管的面积逐渐变小。

注:a、b、c、d分别为萌发过程的第1,3,5,7天;1,2,3,4,5,6分别代表油管1~6。图2 防风种子萌发过程中油管面积的变化Fig.2 Changes in tubing area during Saposhnikovia divaricata (Turcz.) Schischk seed germination
根据防风种子萌发过程中油管的面积数据,对油管1、油管2及油管3的数据进行分析(表2),培养1 d种子油管的面积均极显著大于3 d;培养3 d种子的油管面积均极显著大于5 d;培养5 d种子的油管面积均极显著大于7 d。从油管4的数据来看,培养1 d种子的油管面积极显著大于其他天数种子的油管面积;培养7 d的种子也就是发芽当天种子的油管面积极显著小于其他天数种子的油管面积。对油管5的数据进行分析可知,种子培养1 d、3 d的油管面积极显著大于其他天数种子的油管面积;培养7 d种子的油管面积极显著小于其他天数种子的油管面积。分析油管6的数据可知,培养3 d种子的油管面积极显著大于其他天数的种子油管面积;培养7 d种子的油管面积极显著小于其他萌发天数种子的油管面积。将6个油管面积的平均数进行比较,可知种子培养1 d的油管面积极显著大于3 d;培养3 d种子的油管面积极显著大于5 d;培养5 d种子的油管面积极显著大于7 d。总体分析表明,种子萌发过程中油管的面积不断变小。

表2 防风种子萌发过程中油管的面积变化Table 2 Area changes of tubing during seed germination of Saposhnikovia divaricata (Turcz.) Schischk
防风种子萌发过程中油管的周长数据见表3,对油管1的数据进行分析可知,种子培养1 d、3 d油管的周长极显著大于其他培养天数的油管周长;培养7 d种子油管周长极显著小于其他培养天数的油管周长。从油管2的数据来看,培养1 d种子的油管周长极显著大于其他天数的油管周长;培养7 d种子的油管周长极显著小于其他培养天数种子的油管周长。分析油管3的数据可知,培养7 d种子的周长极显著小于其他培养天数种子的油管周长。从油管4的数据来看,培养1 d时种子的油管周长极显著大于其他培养天数种子的油管周长;培养7 d种子的油管周长极显著小于其他培养天数种子的油管周长。分析油管5的数据可知,培养1 d、3 d种子的油管周长极显著大于5 d、7 d种子的油管周长。对油管6的数据进行分析可知,培养1 d种子的油管周长极显著大于其他培养天数种子的油管周长;培养7 d种子的油管周长极显著小于除5 d外的其他天数种子油管周长。将6个油管周长的平均数进行比较,可知培养1 d种子的油管周长显著大于其他培养天数的油管周长,极显著大于除3 d外的其他培养天数的种子周长;培养7 d种子的油管周长极显著小于其他培养天数种子的油管周长。以上分析表明,种子萌发过程中油管的周长不断变小。

表3 防风种子萌发过程中油管的周长变化Table 3 Changes in tubing perimeter during seed germination of Saposhnikovia divaricata (Turcz.) Schischk
防风种子萌发过程中油管的饱满度数据见表4,从油管1的数据可知,种子培养1 d和3 d的饱满度极显著大于5 d和7 d种子的饱满度。对油管2的数据进行分析可知,种子培养5 d油管的饱满度显著小于其他培养天数种子的饱满度。从油管3数据来看,培养7 d种子的油管饱满度极显著大于其他培养天数种子的油管饱满度,培养5 d种子的饱满度极显著小于其他培养天数种子的饱满度。从油管4的数据可知,培养7 d种子的饱满度显著大于培养3 d种子的油管饱满度。从油管5数据来看,培养7 d种子的油管饱满度显著大于其他培养天数种子的饱满度。对油管6的数据进行分析可知,培养7 d种子的油管饱满度极显著小于其他培养天数。将6个油管饱满度的平均数进行比较,可知培养7 d种子的油管饱满度极显著大于其他培养天数种子的饱满度,培养1 d、3 d、5 d种子油管的饱满度之间无明显差异,油管饱满度1 d>3 d>5 d。以上分析表明,除培养7 d油管的饱满度最大外,种子萌发前期油管的饱满度逐渐变小。
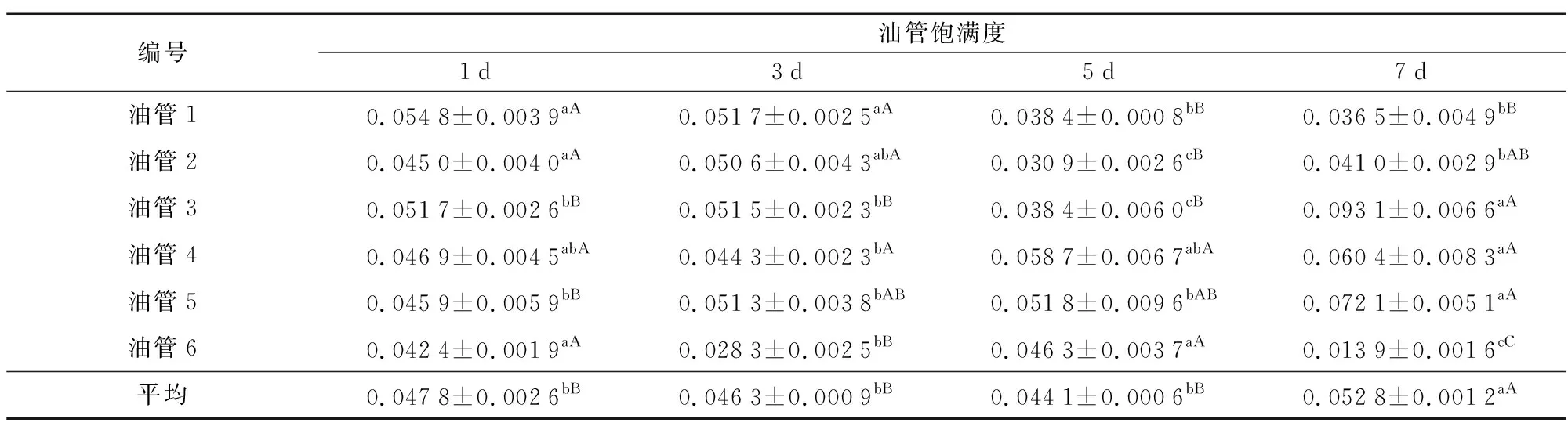
表4 防风种子萌发过程中油管的饱满度变化Table 4 Changes in tubing fullness during seed germination of Saposhnikovia divaricata (Turcz.) Schischk
3.3 防风种子萌发过程中种胚变化的解剖观测
观察栽培防风种子萌发过程中胚形态的变化(图3),发现种子在萌发过程中1 d处于球形胚阶段,2 d、3 d、4 d种胚逐步分化至心形胚阶段,随着子叶原基进一步分化伸展,5 d、6 d种胚过渡到鱼雷形胚阶段,7~11 d胚柄开始逐渐退化缩短形成子叶胚,12 d种子开始发芽。
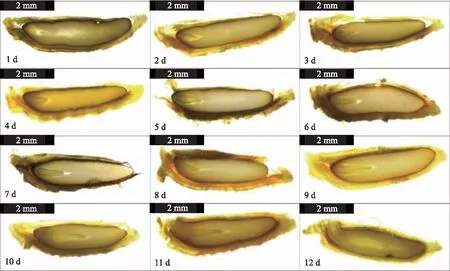
图3 栽培防风种子萌发过程中胚形态的变化Fig.3 Changes in embryo morphology during seed germination of cultivated Saposhnikovia divaricata (Turcz.) Schischk seeds
观察野生防风种子萌发过程中胚形态的变化(图4),用数字游标卡尺测量同一种子胚轴的长度,看到野生防风种子萌发过程中1 d处于球形胚阶段,2 d、3 d、4 d子叶原基伸长处于心形胚阶段,随着子叶原基进一步伸长,5 d、6 d、7 d种胚过渡至鱼雷形胚阶段,子叶原基的伸长伴随着胚柄的退化,8~12 d处于子叶胚阶段,14 d种子开始发芽。

图4 野生防风种子萌发过程中胚形态的变化Fig.4 Changes in embryo morphology during seed germination of wild Saposhnikovia divaricata (Turcz.) Schischk
球形胚时期胚乳几乎占满整个种子,种胚很小(表5),栽培防风该时期种胚的长度为0.461 mm,胚率为9.85%;野生防风该时期种胚的长度为0.353 mm,胚率为10.75%;随着胚的分化逐渐可以看到子叶原基形状呈心形,处于心形胚阶段,该阶段栽培防风种子胚的平均长度为0.790 mm,平均胚率为19.10%;野生防风该时期种胚的平均长度为0.670 mm,平均胚率为15.22%;随着子叶逐渐伸长,种胚发育到鱼雷形胚时期,该时期栽培防风种胚的平均长度为1.027 mm,种胚占胚乳的25.35%;野生防风该时期种胚的平均长度为0.966 mm,平均胚率为24.34%;随着子叶的进一步伸长以及胚乳的分解,种胚发育逐渐成熟,胚根开始萌动,种胚的发育进入子叶胚阶段,该阶段栽培防风种子的种胚平均长度达1.495 mm,平均胚率为38.42%;野生防风该阶段种胚的平均长度为1.301 mm,平均胚率为33.89%;栽培防风种子从培养到萌芽历经12 d,发芽日种胚长度达3.126 mm,胚率达74.34%;野生防风种子从培养到萌芽历经14 d,发芽日种胚长度达2.486 mm,胚率达62.07%。以上分析表明,栽培防风种子发芽速度大于野生防风种子,且栽培防风种子各时期的胚率大于野生防风种子。
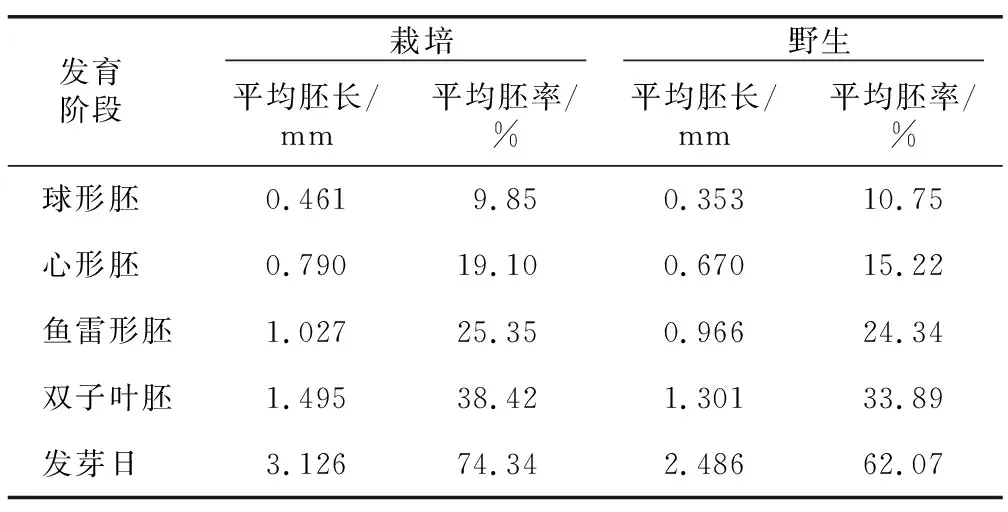
表5 野生及栽培防风种子萌发过程中种胚平均胚长及胚率Table 5 The average length and percentage of seed embryos during germination of wild and cultivated Saposhnikovia divaricata (Turcz.) Schischk seeds
3.4 防风种子萌发过程中胚轴变化的观测
从图5可以看出,栽培防风种子发芽后1 d胚轴长度为1.048 mm,2 d胚轴长度为2.244 mm,3 d为4.321 mm,4 d为10.072 mm,5 d为15.879 mm。种子发芽后历经5 d子叶突破种皮。从图6可以看出,野生防风种子发芽后1 d胚轴长度为0.780 mm,2 d胚轴长度为1.921 mm,3 d为2.169 mm,4 d为6.717 mm,5 d、6 d、7 d胚轴长度分别为10.521 mm、14.119 mm和14.494 mm,种子发芽后历经7 d子叶突破种皮。

图5 栽培防风种子萌发过程中胚轴的变化Fig.5 Changes in hypocotyls during seed germination of cultivated Saposhnikovia divaricata (Turcz.) Schischk

图6 野生防风种子萌发过程中胚轴的变化Fig.6 Changes in the hypocotyl during seed germination of wild Saposhnikovia divaricata (Turcz.) Schischk
经分析对比可知,栽培防风种子发芽后子叶突破种皮用时较短,胚轴长度最长。野生防风种子发芽后突破种皮用时次之,胚轴长度次之。
4 讨 论
显微鉴别是中药材鉴定常用的方法[10],通过显微鉴别对防风种子进行形态学分析,可为中药材的鉴定提供科学依据[11]。相比于现代化学和分子鉴定等方法,显微性状鉴别操作简便且成本较低,实际应用价值相对较高[12]。市场上防风种子种源混淆现象严重,其果实特征是伞形科植物分类的重要依据,且油管特征是显微鉴定伞形科植物的重要依据[13-14]。本研究对防风种子萌发过程进行动态解剖观测,研究表明,防风种子从培养到萌芽共历经7 d,从第1天到第7天,油管内的油滴及红色荧光物质由多变少,油管逐渐变得易破碎,油管管腔变得越来越空洞,油管的面积逐渐变小,周长也在不断变小,除培养7 d的油管饱满度最大外,种子萌发前期油管的饱满度也在逐渐变小。伞形科植物芫荽[15]种子在成熟过程中合生面油管也被逐渐压扁,果壁油管消失转变成大空腔。七叶一枝花种子[16]在萌发过程中其种子内的有效成分含量逐渐减少,防风种子内含有挥发油[17],由于油管内充斥着丰富的油类物质,因此种子萌发过程中油管面积及周长逐渐变小,推断可能是种子在萌发过程中挥发油的含量减少造成的[18]。但还需展开相关实验进行验证。
种子的萌发是植物生命周期中具有重要农艺和生态意义的关键组成部分[19]。本实验首次对防风种子萌发过程中种胚的变化进行相关分析,发现防风种子在萌发过程中依次经历了球形胚阶段、心形胚阶段、子叶胚阶段。有研究发现,黄连、老山芹等[20-22]种子的种胚也经历了同样的阶段。通过观察野生及栽培防风种子萌发过程中种胚的变化,发现其中栽培防风种子发芽速度及各时期胚率均大于野生防风种子。观测野生及栽培防风种子发芽后胚轴的变化,发现栽培防风种子发芽后子叶突破种皮用时较短,胚轴长度最长,均大于野生防风种子。市场上的防风种子种源混杂、种质混乱,以栽培种子冒充野生种源的现象时有发生,因此本实验为探明种子萌发过程中内部结构变化的机制提供基础数据,并为野生及栽培防风的鉴别以及不同产地防风的鉴别提供技术参考,为筛选优良的防风种源及提升道地药材防风的质量提供保障。

