不同温度和外源物质处理对耳叶牛皮消种子萌发的影响
刘方方, 黄进婵, 段 彤, 沈 敏, 洪 键,孙 淼, 张言周, 吴承东, 康贻军
(1.盐城师范学院海洋与生物工程学院,盐城市滨海白首乌生物工程技术研究中心, 江苏 盐城 224007;2.江苏省盐土生物资源研究重点实验室, 江苏 盐城 224007;3.盐城市新洋农业试验站, 江苏 盐城 224049)
耳叶牛皮消(Cynanchumauriculatum)是萝藦科鹅绒藤属植物,其块根与同属的隔山牛皮消(Cynanchumwilfordii)和戟叶牛皮消(Cynanchumbungei)的块根被并称为白首乌,是一种传统滋补中药材。耳叶牛皮消的块根富含C21甾苷类、多糖类、苯酮类等天然活性成分,具有抗肿瘤、抗氧化、保肝护肝、调节免疫及降脂减肥等多重药理功效[1-4]。此外,耳叶牛皮消块根中粗蛋白、粗脂肪、淀粉和氨基酸的含量较丰富,还含有多种维生素及锌、锰、铁、钙等人体必需微量元素[5-6],具有较高的食用价值。耳叶牛皮消作为一种药食同源的植物,开发利用价值较高,市场前景广阔。目前,市场上白首乌产品的来源主要为滨海白首乌(耳叶牛皮消)和泰山白首乌(戟叶牛皮消)[4],全国95%的耳叶牛皮消产自江苏省盐城市滨海县[7-8]。作为地产道地药材,滨海白首乌被认定为中国国家地理标志产品,并建立了首个国家级白首乌标准化种植示范区[9]。
耳叶牛皮消的繁殖可采用多种方式,包括块根繁殖、种子繁殖、藤蔓扦插和组织培养等,规模化人工栽培主要采用块根繁殖[10]。块根无性繁殖的幼苗较健壮、成活率高,但成本较高,出苗周期长,且后期易发生侵染性病害,导致种性退化,影响白首乌的产量和品质[11-12]。耳叶牛皮消种子繁殖的出苗整齐度不高,出苗速度和苗期生长较缓慢,但后期生长迅速,块根粗大,产量有保障[13]。目前,规模化栽培中采用耳叶牛皮消种子繁殖的比例不高,通过种子萌发进行耳叶牛皮消有性繁殖的研究也鲜有报道。本实验通过研究温度、激素和化学试剂对耳叶牛皮消种子萌发的影响,优化种子萌发条件,以期为耳叶牛皮消良种繁育、种质资源保护与利用以及产业可持续发展提供参考。
1 材料与方法
1.1 实验材料
耳叶牛皮消种子于2021年11月初采自江苏省盐城市滨海县滨海港镇,果实未开裂时摘取,风干后果实裂开,取出种子,去杂,去种毛,干燥贮藏。
1.2 种子形态特征观察与测量
采用目测法观测种子基本形态。随机选取10粒种子,用游标卡尺测量种子长度、宽度和厚度。千粒重参照国标规程(GB/T3543—1995),采用百粒法,随机选取100粒种子,用万分之一电子天平称量,计算千粒重,重复4次。
1.3 种子预处理
选用大小均匀、饱满、无破损、无病斑的种子。先用75%乙醇消毒5 min,无菌蒸馏水冲洗2次,再用3%次氯酸钠消毒1 min,无菌蒸馏水冲洗4次后备用。
1.4 实验设计
1.4.1发芽实验
将处理后的种子转入含有无菌纸质发芽床的培养皿中,每皿25粒种子,每个重复50粒,每个处理重复3次。在恒温光照培养箱内,于光照时间12 h/d、光照度20%、相对湿度(RH)80%的条件下进行发芽实验。实验过程中,根据培养皿内失水情况补充无菌水,以保持发芽床湿润。
1.4.2种子萌发条件的优化
发芽温度:将预处理后的种子分别在15,25,35 ℃的光照培养箱中进行发芽实验,以确定最佳发芽温度。
浸种温度:将预处理后的种子浸泡在无菌水中,分别于5,25,35 ℃水浴浸种24 h,然后在最佳发芽温度的光照培养箱中进行发芽实验,以确定最佳浸种温度。
激素处理:采用3种激素,设置浓度分别为:赤霉素(GA3)100,200,400 mg/L;吲哚乙酸(IAA)5,10,20 mg/L;6-苄氨基嘌呤(6-BA)50,100,200 mg /L。以无菌水为对照,于最佳浸种温度下,将预处理后的种子在上述溶液中浸泡处理24 h,然后进行发芽实验。
化学试剂处理:采用3种化学试剂(无机盐),设置浓度分别为:氯化钙(CaCl2)0.5,1.0,2.0 g/L;硝酸钾(KNO3)2.0,4.0,6.0 g/L;氯化钠(NaCl)1.0,5.0,10.0 g/L。以无菌水为对照,于最佳浸种温度下,将预处理后的种子在上述溶液中浸泡处理24 h,然后进行发芽实验。
组合处理:从激素和化学试剂处理中筛选出效果好的激素和试剂,进行组合,采用混合溶液浸泡种子,以无菌水为对照进行发芽实验。
1.5 数据统计与分析
1.5.1种子发芽指标
将种子放入光照培养箱后,每天同一时间观察种子发芽情况,记录发芽种子数(露白,即胚根突破种皮1 mm为种子发芽标准),直至发芽结束,计算种子发芽率、发芽势和发芽指数等指标,具体计算方法如下:
发芽率/%=(发芽种子数/供试种子数)×100%;
发芽势/%=(前8 d内发芽种子数/供试种子数)×100%;
发芽指数=∑(Gt/Dt),式中:Gt为第t天的发芽种子数,Dt为对应的发芽天数。
1.5.2数据分析
采用Microsoft Excel软件对实验数据进行预处理和计算,采用SPSS软件进行方差分析和多重比较(α=0.05)。数据均为平均值±标准差,采用Excel和GraphPad Prism软件作图。
2 结果与分析
2.1 耳叶牛皮消种子形态特征
耳叶牛皮消结实率较高,种子扁卵状,种皮褐色,种子顶端有一簇白色绒毛(图1)。种子千粒重为(6.018±0.086)g,种子长度为(0.734±0.032)cm,种子宽度为(0.353±0.017)cm,种子厚度为(0.112±0.012)cm。

图1 耳叶牛皮消种子形态特征Fig.1 Seed morphological characteristics of Cynanchum auriculatum
2.2 温度对耳叶牛皮消种子萌发的影响
2.2.1培养温度对种子萌发的影响
不同培养温度下耳叶牛皮消种子的萌发进程(图2a)。结果显示,在15 ℃,25 ℃和35 ℃的条件下,种子起始萌发时间分别为第7天、第4天和第5天。15 ℃和25 ℃下,种子萌发进程中有较明显的高峰期,而35 ℃下,种子萌发进程相对平缓。不同培养温度下种子萌发相关指标见表1,25 ℃下种子的发芽率、发芽势和发芽指数均显著高于15 ℃和35 ℃。以上结果表明,耳叶牛皮消种子萌发对温度敏感,25 ℃为较佳的培养温度。

表1 培养温度对耳叶牛皮消种子萌发指标的影响Table 1 Effects of culture temperature on seed germination indexes of Cynanchum auriculatum

图2 温度对耳叶牛皮消种子萌发的影响Fig.2 Effects of temperature on seed germination of Cynanchum auriculatum
2.2.2浸种温度对种子萌发的影响
在不同温度下浸种处理后,耳叶牛皮消种子的萌发进程(图2b)。结果显示,在5 ℃,25 ℃和35 ℃的浸种条件下,种子起始萌发时间分别为第5天、第4天和第3天;3个浸种温度下,种子萌发进程中均有较明显的高峰期。种子萌发相关指标(表2),随着浸种温度的升高,种子发芽率、发芽势和发芽指数均逐渐提高,且35 ℃条件下的种子萌发指标均显著高于其他两个温度处理。以上结果表明,浸种温度能不同程度地改变耳叶牛皮消种子的萌发进程,其中,35 ℃浸种能显著促进种子萌发。

表2 浸种温度对耳叶牛皮消种子萌发指标的影响Table 2 Effects of soaking temperature on seed germination indexes of Cynanchum auriculatum
2.3 外源激素对耳叶牛皮消种子萌发的影响
不同种类及浓度的外源激素处理下,耳叶牛皮消种子的萌发进程见图3。与对照相比,3种浓度的GA3处理后,种子萌发的高峰期均更为明显,且有不同程度的提前;100 mg/L的GA3处理后,种子萌发起始时间比对照提前了1 d,200 mg/L和400 mg/L的GA3处理后,种子萌发起始时间与对照相同,但发芽终止时间明显提前,由原来的大于等于第15天提前至第12天左右(图3 a)。50 mg/L的6-BA处理后,种子萌发起始时间不变,萌发高峰期略有提前;100 mg/L的6-BA处理后,种子萌发起始时间提前了1 d,但萌发高峰期显著推迟;200 mg/L的6-BA处理后,种子萌发起始时间推迟了3 d,萌发高峰期不明显(图3 b)。5 mg/L的IAA处理后,种子萌发起始时间不变,但随着IAA浓度的提高,萌发起始时间逐渐推迟;3种浓度的IAA处理后,种子萌发高峰期均不明显(图3 c)。

图3 外源激素对耳叶牛皮消种子萌发的影响Fig.3 Effects of exogenous hormones on seed germination of Cynanchum auriculatum
如表3所示,GA3和IAA处理组,种子的发芽率、发芽势和发芽指数均随着激素浓度的增加呈下降趋势。在GA3处理组中,除400 mg/L浓度下的发芽率与对照无显著差异外,其他浓度下种子的发芽指标均显著高于对照,当GA3浓度为100 mg/L时,种子的发芽率、发芽势和发芽指数分别较对照提高了20.2%、48.3%和57.3%。在IAA处理组中,5 mg/L浓度下种子的发芽率和发芽指数与对照无显著差异,发芽势显著低于对照,10 mg/L和20 mg/L浓度下种子的发芽指标均显著低于对照。在6-BA处理组中,种子的发芽率和发芽指数均随着6-BA浓度增加呈先上升后下降的趋势,种子的发芽势随着激素浓度增加呈下降趋势;当6-BA浓度为100 mg/L时,种子的发芽率显著高于对照,但发芽指数与对照无显著差异,发芽势显著低于对照。以上结果表明,外源GA3能显著促进耳叶牛皮消种子萌发,且当GA3浓度为100 mg/L时,种子萌发效果最佳。
2.4 外源化学试剂对耳叶牛皮消种子萌发的影响
不同种类及浓度的化学试剂处理下,耳叶牛皮消种子的萌发进程见图4,与对照相比,CaCl2处理对种子萌发进程无显著影响,种子萌发起始时间与对照相同,均为第3天;种子萌发高峰期较明显,0.5 g/L和2 g/L浓度下萌发高峰期较对照提前了1 d,1 g/L浓度下萌发高峰期与对照相同(图4 a)。当KNO3浓度为6 g/L时,种子萌发起始时间较对照提前了1 d,萌发高峰期与对照相似;当KNO3浓度为2 g/L和4 g/L时,种子萌发起始时间与对照相同,2 g/L浓度下萌发高峰期较对照提前了1 d,4 g/L浓度下萌发高峰期不明显(图4 b)。NaCl处理对种子萌发进程有显著影响,3种浓度下种子萌发起始时间均较对照提前了1 d,种子萌发高峰期均较为明显,当NaCl浓度为1 g/L时,萌发高峰期较对照提前了3 d(图4 c)。

图4 化学试剂对耳叶牛皮消种子萌发的影响Fig.4 Effects of chemical reagents on seed germination of Cynanchum auriculatum
如表4所示,在CaCl2处理组中,种子的发芽率、发芽势和发芽指数均随CaCl2浓度增加呈先上升后下降的趋势,1 g/L浓度下种子发芽率与对照无显著差异,发芽势和发芽指数显著高于对照。在KNO3处理组中,种子发芽率随KNO3浓度增加呈上升趋势,发芽势和发芽指数随试剂浓度增加呈先下降后上升的趋势,当KNO3浓度为6 g/L时,种子的发芽率、发芽势和发芽指数均显著高于对照,分别较对照提高了22.5%,25%和44.1%。在NaCl处理组中,种子发芽率、发芽势和发芽指数均随NaCl浓度增加呈下降趋势,其中,1 g/L浓度下种子发芽率、发芽势和发芽指数均显著高于对照,分别较对照提高了12.4%,30%和37.4%;但随着NaCl浓度的增加,种子发芽相关指标下降明显,5 g/L和10 g/L浓度下,种子发芽率、发芽势和发芽指数均显著低于对照。以上结果表明,特定种类及浓度的外源化学试剂浸种能促进耳叶牛皮消种子萌发,其中,6 g/L 的KNO3和1 g/L 的NaCl对耳叶牛皮消种子萌发的促进效果较好。

表4 化学试剂对耳叶牛皮消种子萌发指标的影响Table 4 Effects of chemical reagents on seed germination indexes of Cynanchum auriculatum
2.5 激素和化学试剂组合处理对耳叶牛皮消种子萌发的影响
从上述实验中选取对种子萌发效果较好的特定浓度激素和试剂,包括100 mg/L 的GA3、6 g/L 的KNO3和1 g/L 的NaCl,对耳叶牛皮消种子进行组合处理,统计分析种子萌发相关指标。结果显示,各个组合处理下种子萌发起始时间和萌发高峰期均明显早于对照组(图5),种子发芽率、发芽势和发芽指数均显著高于对照组(表5);各个组合处理之间也存在一定差异,综合比较显示,GA3+KNO3+NaCl组合处理下,种子萌发效果最佳。该组合处理与对照相比,种子萌发起始时间和萌发高峰期均提前了2 d;种子发芽势由39.33%升高至62%,提高了57.6%;发芽率由58.67%升高至79.33%,提高了35.2%;发芽指数由4.43升高至8.62,提高了94.6%;发芽周期由原来的15 d以上缩短至12 d左右。
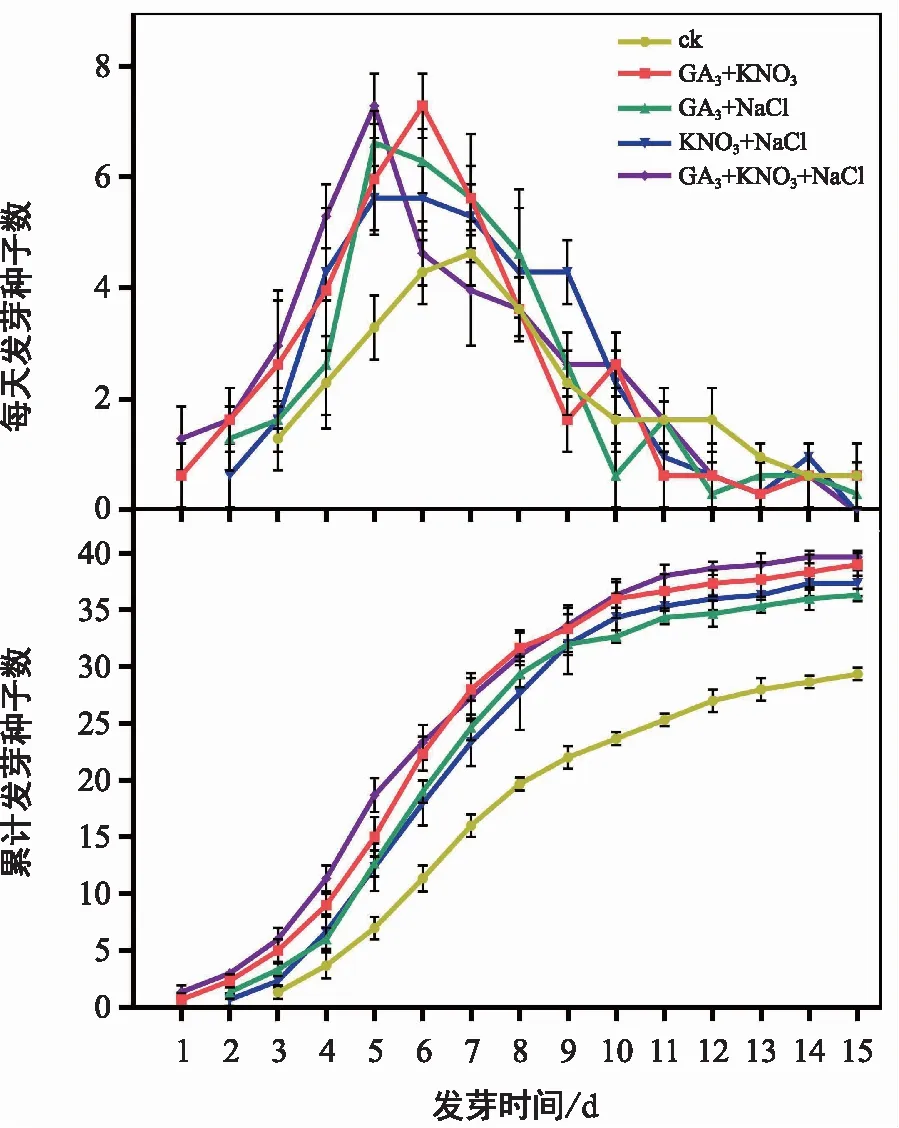
图5 激素和化学试剂组合处理对耳叶牛皮消种子萌发的影响Fig.5 Effects of combined treatment with hormone and chemical reagents on seed germination of Cynanchum auriculatum

表5 激素和化学试剂组合处理对耳叶牛皮消种子萌发指标的影响Table 5 Effects of combined treatment with hormone and chemical reagents on seed germination indexes of Cynanchum auriculatum
3 讨 论
在实际栽培种植中,由于耳叶牛皮消种子萌发比较缓慢,出苗整齐度欠佳且幼苗较瘦弱,因此较少采用播种的方式进行种植。但种子繁殖是优良种性保持和种质资源保护的必要手段,优化种子萌发条件进而提高种子萌发活力对耳叶牛皮消的良种繁育和产业发展具有重要意义。
温度是影响植物种子萌发的关键环境因子之一,本研究发现,不同培养温度对耳叶牛皮消种子萌发的影响存在显著差异,25 ℃下种子的发芽率、发芽势和发芽指数均显著高于15 ℃和35 ℃,表明耳叶牛皮消种子在萌发阶段对温度较敏感,过低或过高的温度均不利于其萌发。这与耳叶牛皮消实际栽培中的播种条件较一致,江苏滨海地区一般于每年4上中旬播种[10,14],此时环境温度为20~25 ℃,是耳叶牛皮消种子的最佳萌发温度。
浸种是生产中常用的种子催芽处理方法,温度是影响浸种效果的关键因素之一,不同植物种子的最适浸种温度不同。本研究结果表明,35 ℃浸种处理下耳叶牛皮消种子的萌发起始时间提早了1 d,种子发芽率、发芽势和发芽指数均显著高于5 ℃和25 ℃浸种,这与李玉石等[15]对泰山白首乌(戟叶牛皮消)繁育技术的报道一致。推测温水浸种能软化耳叶牛皮消种皮,增加其通透性,进而激活胚细胞活性,达到促进发芽的效果。
植物激素在种子萌发阶段发挥了重要的调控作用,外源施加植物生长调节剂能有效干预种子的萌发。本研究发现,不同种类的外源激素对耳叶牛皮消种子萌发的影响差异较大。GA3能显著促进耳叶牛皮消种子萌发,且100 mg/L的GA3对种子萌发的促进效果最佳,随着GA3浓度的升高,种子的发芽率、发芽势和发芽指数均呈下降趋势。植物内源赤霉素在种子萌发阶段能打破休眠,促进种子萌发[16]。本研究中外源施加的GA3能透过种皮进入种子内部,与内源激素协同促进耳叶牛皮消种子萌发,但外源GA3浓度不宜过高,否则可能扰乱种子内源激素动态平衡,抑制种子萌发。外源低浓度6-BA和IAA也能促进耳叶牛皮消种子萌发,但整体上不显著,随着处理浓度的升高,种子发芽指标显著降低,种子萌发受到抑制。这与何首乌[17]、多叶棘豆[18]、冰菜[19]和九龙山杜鹃[20]等植物种子萌发的研究结果相似,推测高浓度6-BA和IAA可能诱导细胞产生了抑制种子萌发的代谢产物(如乙烯),或是抑制了一些能促进种子萌发的酶的合成。
一定种类及浓度的化学试剂对耳叶牛皮消种子的萌发具有显著改善作用。本研究中使用的耳叶牛皮消种子采自江苏省滨海县近海滩涂地区,具有一定的耐盐性,吴承东等[21]研究发现,当NaCl浓度低于0.4%时,耳叶牛皮消种子的发芽指数和活力指数等指标与对照相比无显著差异,表明耳叶牛皮消种子萌发过程对盐胁迫有一定的耐受性。本研究发现,NaCl浓度为1 g/L时,耳叶牛皮消种子的发芽率、发芽势和发芽指数均显著高于对照,而当NaCl浓度高于5 g/L时,种子萌发受到了显著抑制,表明低浓度NaCl处理能促进耳叶牛皮消种子萌发,高浓度NaCl处理会对种子萌发形成胁迫。KNO3对耳叶牛皮消种子萌发的改善效果优于NaCl处理,本研究中2~6 g/L的KNO3处理均不同程度地促进了耳叶牛皮消种子萌发,其中,6 g/L的KNO3处理时,种子萌发效果最好。KNO3是使用较多的一种改善植物种子萌发的化学试剂,K+是植物细胞内多种酶的激活剂,同时还能诱导多种植物内源激素的合成并调控其活性[22],对植物种子萌发具有促进作用,这在曼陀罗[23]、甜椒[24]和燕麦[25]等多种植物种子萌发的研究中得到了证实。
本研究还发现,与单一因素处理相比,不同外源物质组合处理能进一步提升耳叶牛皮消种子萌发效果。100 mg/L GA3+6 g/L KNO3+1 g/L NaCl组合处理下,耳叶牛皮消种子萌发效果最佳,种子发芽率、发芽势和发芽指数分别较对照提高了35.2%,57.6%和94.6%,同时还缩短了发芽周期,提高了种子发芽整齐度。

