血筛传染病核酸混样检测与血清学实验并行检测流程的探索
张珺珂,杨洪岗
(云南昆明血液中心检验科,云南 昆明 650106)
核酸检测技术(Nucleic acid test,NAT)与酶联免疫检测技术(ELISA)的联合使用,使经血液传播传染病的发生率明显降低。目前在我国大部分血站使用的是混样核酸检测系统[1]。混样核酸检测流程大多采用血清学核酸顺序检测,但此模式检测流程耗时较长,且受血清学检测通量制约。若采用血清学与核酸并行检测可缩短检测流程耗时。血站技术操作规程(2019版)规定核酸检测流程可以使用血清学与核酸顺序检测及血清学与核酸并行检测两种流程[2],为探讨混样核酸检测模式,采用血清学与核酸并行检测流程是否可行进行本研究。现报道如下。
1 材料与方法
1.1 材料
本中心2018年12月-2019年5月血清学核酸顺序检测无偿献血者标本87048份及2019年12月-2020年5月血清学核酸并行检测的无偿献血者标本82618份。
1.2 设备
MICROLAB STAR全自动核酸混样提取系统,EZbead System-32全自动核酸提取仪、ABI 7500实时荧光扩增分析仪。
1.3 试剂
华益美乙型肝炎、丙型肝炎、人类免疫缺陷病毒(1+2)核酸检测试剂盒(批号:MA20190907;MA20191008;MA20191210)、科华乙型肝炎、丙型肝炎、人类免疫缺陷病毒核酸检测试剂盒(批号:20190812;20191101)、浩源乙型肝炎、丙型肝炎、人 类免疫缺陷病毒核酸检测试剂盒(批号:NF20190604;BA20200401)。
1.4 实验室信息管理系统
启奥SHINOW 9.0血站信息管理系统。
1.5 方法
2 结果
2.1 各检测系统并行检测、顺序检测混样阳性率、拆分阳性率、试剂损耗率对比,结果所示华益美系统乙型肝炎病毒脱氧核糖核酸(Hepatitis B virus-Deoxyribonucleic acid,HBV-DNA)、人类免疫缺陷病毒核糖核酸(Human immunodeficiency virus-ribonucleic acid,HIV-RNA)项目两种检测模式混样检测阳性率与拆分检测阳性率无统计学差异,丙型肝炎病毒核糖核酸(Hepatitis C virus-ribonucleic acid,HCV-RNA)项目混样检测阳性率存在统计学差异,试剂损耗率存在统计学差异。结果所示科华系统HBV-DNA项目两种检测模式混样检测阳性率与拆分检测阳性率无统计学差异;HIV-RNA项目混样检测阳性率存在统计学差异,拆分检测阳性率无统计学差异;试剂损耗率存在统计学差异。结果所示浩源系统HBV-DNA项目两种检测模式混样检测阳性率存在统计学差异,拆分检测阳性率无统计学差异,试剂损耗率存在统计学差异,见表1。
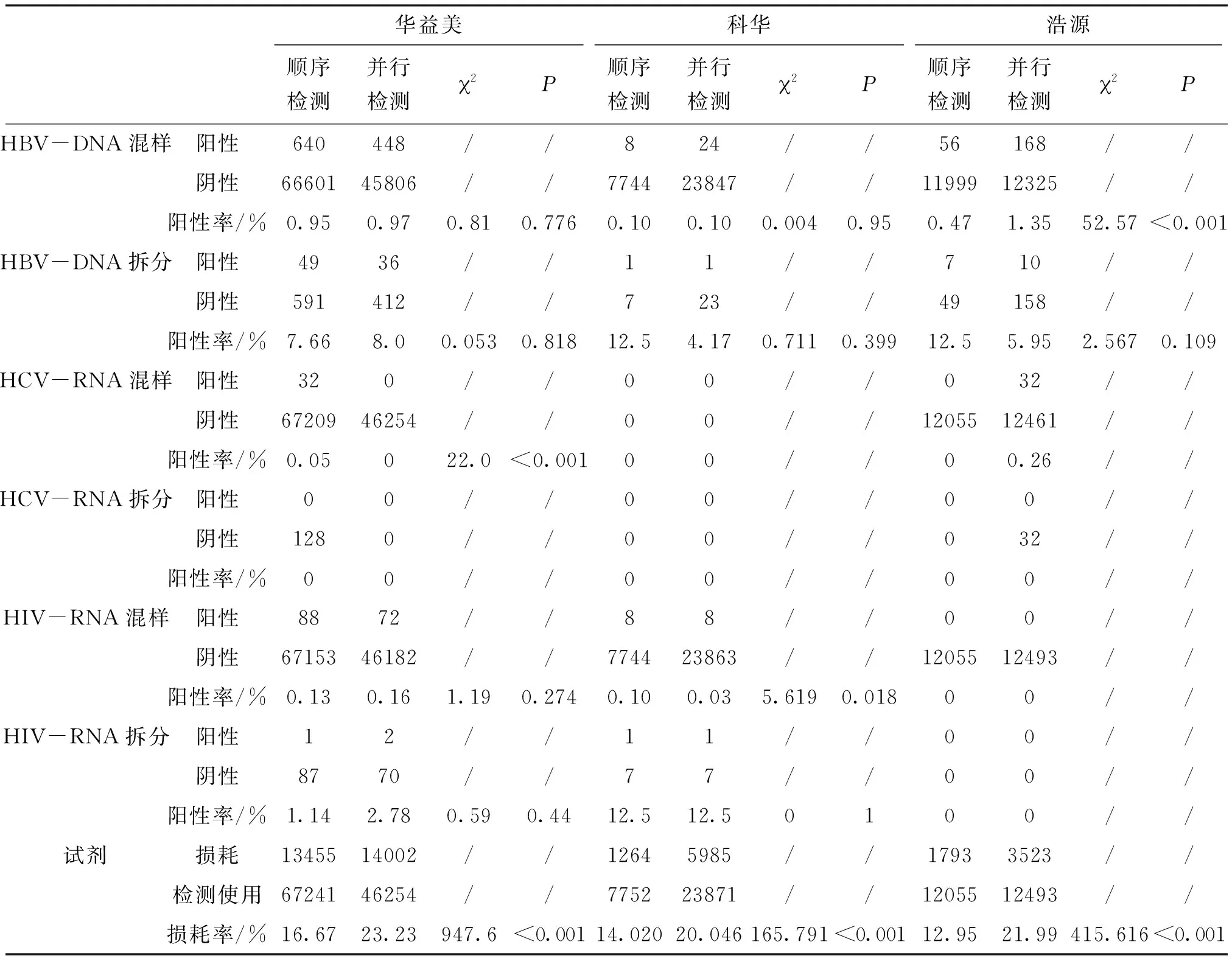
表1 华益美系统、科华系统、浩源系统顺序检测及并行检测情况
2.2 血清学核酸并行检测乙型肝炎病毒(Hepatitis B virus,HBV)、丙型肝炎病毒(Hepatitis C virus,HCV)、人类免疫缺陷病毒(Human immunodeficiency virus,HIV)血清学阳性率对比,结果所示以上三种病毒血清学阳性率存在统计学差异,见表2。
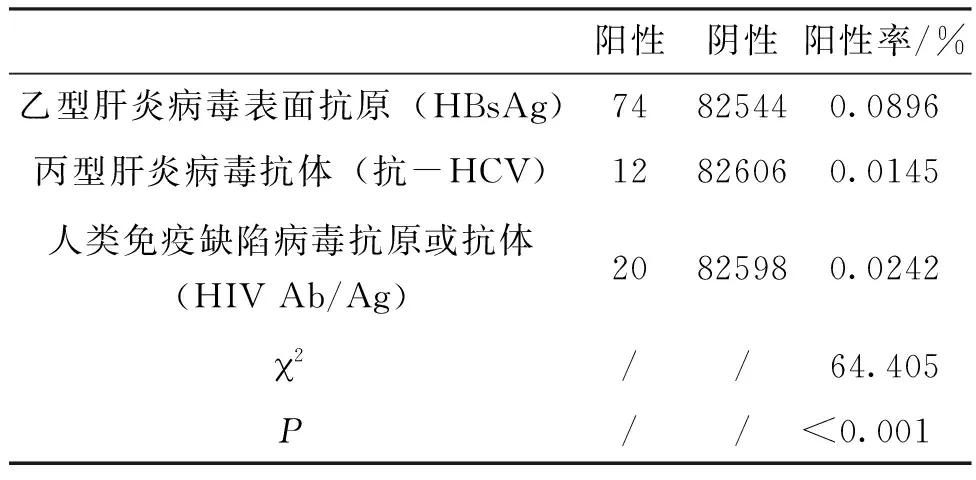
表2 血清学核酸并行检测HBV、HCV、HIV血清学阳性率对比表
3 讨论
核酸混样检测为多份样本汇集成一个标本池(Pool)后再进行提取和扩增,若Pool检测结果为有反应性则需进行拆分检测。因此使用混样核酸检测的实验室需先完成血清学检测,然后再对血清学无反应性标本进行核酸检测,以避免血清学阳性标本进入核酸检测,从而产生大量反应性Pool。此流程从标本接收到报告发布所需时间较长,而且血清学未检测的标本不能进行核酸检测,核酸检测通量受血清学检测通量的限制。采用血清学核酸并行检测流程可缩短标本接收到最终报告发布所需时间,且不受血清学检测通量的限制可发挥混样核酸检测高通量的优势。
由于HCV抗体、HIV抗原或抗体、HCV-RNA、HIV-RNA阳性率均较乙肝表面抗原(hepatitis B surface antigen,HBsAg)和HBV-DNA低[3,4],在统计样本量不大的情况下可能存在抽样误差,本文中仅对HBV-DNA项目的混样阳性率和拆分阳性率进行讨论。结果2.1所示,剔除血清学阳性标本造成的核酸混样阳性Pool后,统计各检测系统并行检测和顺序检测的HBV-DNA混样阳性率及拆分阳性率发现,华益美系统及科华系统HBV-DNA混样阳性率及拆分阳性率,并行检测与顺序检测无显著差异,但浩源系统HBV-DNA混样阳性率并行检测与顺序检测存在显著差异。华益美系统与科华系统均为磁力板下吸磁珠进行磁珠与液相分离,分离时磁珠始终保持在深孔板内,磁珠之间通过气溶胶污染的可能较小。而浩源系统为磁棒上吸磁珠进行磁珠液相分离,分离时磁珠吸附在磁棒上离开深孔板,检测强阳性标本时磁棒间磁珠可能通过气溶胶产生交叉污染。同时各系统试剂灵敏度、试剂特异性、防污染能力都存在差异,最终导致三个系统血清学核酸并行检测与顺序检测拆分阳性率和混样阳性率统计学结果的不同,但各系统无论并行检测还是顺序检测的NAT总阳性率以及拆分阳性率均在报道的范围内[1,5-7],由此可见,在做好实验室清洁消毒[8]和实验过程控制的前提下,实验室发生严重污染,而产生假阳性的可能较低,但需关注的是在实验室清洁消毒过程中,如高频次使用高浓度含氯消毒剂进行清洁消毒,有增加设备故障率的风险[9]。
本研究进行统计的试剂损耗率中,血清学核酸顺序检测试剂损耗率符合本中心之前的报道[10]及其他文献报道[11],但血清学核酸并行检测与血清学核酸顺序检测存在显著差异,并行检测试剂损耗率高于顺序检测试剂损耗率。这是由于并行检测在混样时存在血清学阳性标本,血清学阳性标本会导致混样阳性Pool的数量增加从而增加拆分检测的数量,同时大量血清学阳性标本进入核酸检测流程,也一定程度增加了核酸检测混样假阳性的发生率。而试剂损耗的增加会直接导致血站检测成本的上升。
从结果中2.2中可以看出,进行并行检测的82618份标本中所检测出的血清学阳性标本中乙肝占69.8%,显著高于丙肝的11.3%和艾滋的18.9%。若在采血前的初筛检测时使用高灵敏度的胶体金免疫层析试剂;并通过培训加强初筛检测人员的责任心和对胶体金法检测结果的正确判定,防止在采血人次较多、工作疲劳等情况下,因人为因素导致胶体金免疫层析试剂阳性标本漏检的情况,可以进一步减少血清学阳性标本。从而降低血清学核酸并行检测时乙肝血清学阳性对核酸检测的影响。
综上所述,核酸混样检测与血清学实验并行检测可以缩短整个检测流程所需时间,且不会因为大量血清学阳性标本进入核酸检测而产生大量的假阳性结果,但会增加试剂的损耗率,导致检测成本的增加和资源的浪费。因此混样核酸检测与血清学并行检测不宜作为常规的检测流程,但在自然灾害、传染病疫情等,检测时间紧或检测样本量大的突发特殊情况下可缩短检验科整个血液检测流程所需时间,是一种有效、可行的应急检测流程,也可为血站实验室建立应急检测方案的体系文件提供参考。

