主动脉夹层误诊为急性冠脉综合征行介入手术15例分析
苏 瑞,胡 勇,张荣华
(云南省阜外心血管病医院急诊科,云南 昆明 650102)
主动脉夹层(aortic dissection,AD)是各种原因导致主动脉内膜与中膜撕裂及分离,血液流入,主动脉腔被分隔为真腔和假腔[1],常见分型为Stanford分型:A、B型。一旦明确诊断AD,其24h内每小时死亡率增加1%~2%,未手术治疗的Stanford A型AD发病1周病死率超70%[2,3]。早期及时诊断出AD,至关重要。但由于AD撕裂的位置、范围、累及脏器各不相同,故常常导致误诊、漏诊率达30%~40%[4]。首位误诊的疾病为冠心病,尤其是急性冠脉综合征(acute coronary syndrome,ACS)与AD同为致命性急性胸痛疾病,但在治疗原则上却是“背道而驰”,尤其是急诊介入治疗,对AD预后极为不利,甚至加速患者死亡[5,6]。本文对云南省阜外心血管病医院2017年9月-2022年7月,收治的被误诊为ACS且行急诊介入手术的15例AD患者的病例资料,进行回顾性分析,旨在为临床医生对AD和ACS的甄别提供依据,降低误诊率。现报道如下。
1 对象与方法
1.1 一般资料
15例患者中男性10例,女性5例。年龄在39~77(59.1±11.4)岁。有高血压病史9例。因体力活动、劳累等因素诱发4例。
1.2 纳入标准
符合以下三条中两条以上即可诊断急性心肌梗死:(1)持续剧烈的胸痛大于三十分钟。(2)心电图呈ST-T动态改变。(3)伴有心肌酶学的增高。纳入患者符合急性心肌梗死诊断标准,并且行急诊介入手术,最终行主动脉CT血管成像(CT angiography,CTA)明确诊断为主动脉夹层。
1.3 排除标准
(1)来院即死亡者。(2)未行主动脉CTA证实AD诊断者。(3)明确AD诊断后,放弃进一步住院治疗者。
1.4 方法
收集统计患者病史资料、症状体征、辅助检查、治疗及预后情况。
2 结果
2.1 症状体征
15例患者中主要表现为前胸痛8例,后背痛10例,腰痛1例,伴面色苍白、出汗4例,伴晕厥意识丧失3例,伴呼吸困难1例。入院时收缩压>140mmHg 7例,收缩压<100mmHg 2例。
2.2 辅助检查
2.2.1 心电图表现及实验室检查,见表1。
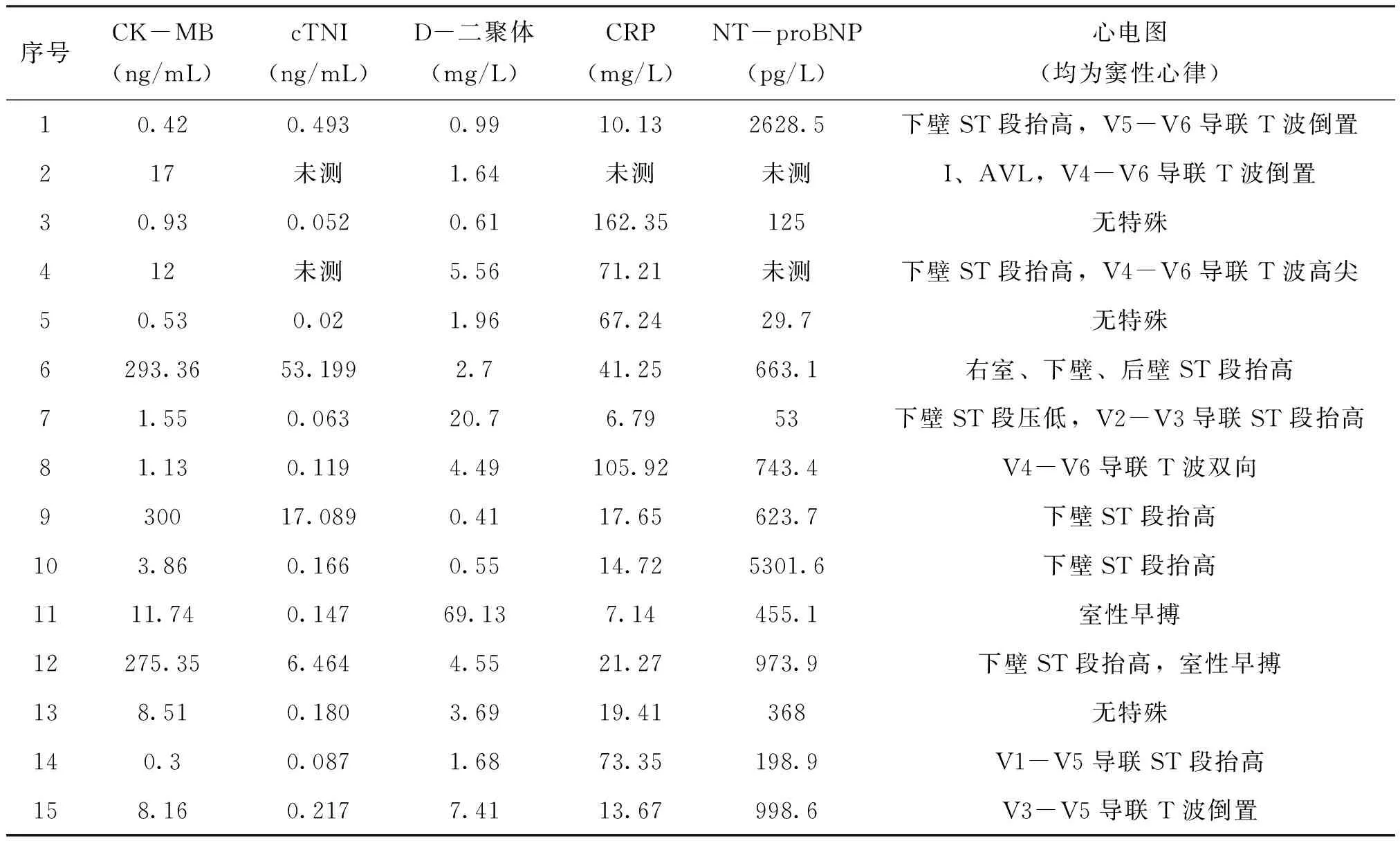
表1 15例AD患者主要实验室检查及心电图表现
2.2.2 影像学检查
13例行胸部X线检查:升主动脉扩张、主动脉弓增宽5例,心影增大2例,胸腔积液1例。15例行超声心动图检查:主动脉腔内有漂浮内膜片回声9例,主动脉影增宽3例,主动脉反流2例,室壁运动异常2例,室间隔增厚1例。15例行主动脉CTA检查,Stanford A型AD 12例,Stanford B型AD 3例。
2.2.3 冠脉造影及介入情况
15例冠脉造影结果示:三支重度病变3例,右冠脉开口闭塞2例,右冠脉开口重度狭窄1例,前降支近端重度狭窄2例,单支血管轻度斑块3例,正常冠脉4例。其中1例行支架植入术。
2.3 治疗及预后
15例患者术前均服用阿司匹林300mg+氯吡格雷300mg或替格瑞洛180mg抗血小板治疗,且加用普通肝素抗凝治疗。在明确AD诊断后,4例行保守治疗(控制血压和心率,同时予镇静、镇痛治疗)其中2例病情稳定后出院,2例等待手术过程中死亡。11例行外科手术治疗,其中1例术后1月死亡,1例因出血并发症转康复医院。9例术后好转出院。
3 讨论
3.1 诊断要点
3.1.1 临床表现及体征
本研究中疼痛是AD患者最为普遍的主诉。若AD累及冠脉开口或心脏瓣膜、心包等,可导致典型的ACS或急性心力衰竭,甚至心源性休克等心脏并发症的表现。若AD累及主动脉的其他重要分支血管,可导致相应脏器(如脑、肾、胃肠道、肝脾、下肢)缺血或灌注不良,常有晕厥、无尿、急腹症、下肢坏死等症状。AD常导致四肢血压差异大,有助于鉴别诊断。心脏的听诊、叩诊,腹部及神经系统的查体,亦有所提示,但缺乏特异性。
3.1.2 实验室检测
D-二聚体对AD鉴别诊断价值较高,其明显升高,AD诊断可能性增大。D-二聚体阴性有助于排除AD,但不能排除主动脉血肿及穿透性溃疡[1]。CRP反应炎性活动,其>15mg/dL是AD患者低氧及预后不良的指标,NT-proBNP反应心功能情况,有预测预后价值。
3.1.3 超声心动图及主动脉CTA
超声心动图能及时发现的心包积液、主动脉周围血肿等AD并发症,有助于评估患者的预后,若发现室壁运动异常则有助于ACS的鉴别。主动脉CTA是可疑AD病人的首选影像学检查方法,具有普及性广、敏感度和特异度高,分辨率高等优势[7]。可以对主动脉进行综合评价。有助于评估是否有手术条件及选择手术方式。
3.2 误诊原因分析
3.2.1 危险因素及临床表现相同
两种疾病具有相同的危险因素、发病年龄段、男女比例、甚至诱因都有相似之处。部分AD的胸痛不典型,如本研究中33.3%患者合并如出汗、呼吸困难等症状,与ACS难以鉴别。部分患者生命体征不稳定,甚至有20%出现意识丧失情况,无法清楚表达疼痛的部位、性质及特点。
3.2.2 查体不全面
急诊科医生工作繁忙,接诊病患量大,工作环境嘈乱,有可能未在第一时间及时监测患者双侧上肢血压,心脏听诊不仔细,其他系统查体不全面,导致遗漏有意义的阳性体征,从而延误了确诊。
3.2.3 心电图及心肌酶的误导
心肌缺血心电图合并cTNI升高,是导致误诊为ACS最直接的原因。本研究中80%患者心电图异常,66.7%患者cTNI升高。急诊科医生由于诊断思维定式,对于胸痛合并心肌酶及心电图异常者往往惯性的认为是ACS,忽视了部分AD可能累及冠状动脉,或有合并冠心病的情况。
3.2.4 盲目追求门-球时间
导致患者错误行急诊冠脉介入的因素是根据国内外急性心肌梗死治疗指南及胸痛中心要求的门-球时间,介入医生为尽快开通闭塞血管,常常有胸痛症状加心电图ST-T段抬高等缺血表现,就一键启动导管室。甚至院前急救120远程传输心电图后,即诊断患者为心肌梗死,转运途中服用抗血小板药物,甚至绕行急诊科,直接将患者送进介入导管室。所以往往等不到心肌酶结果,更不会选择超声心动图、MRI、CTA等特异性强但更加耗时的检查。过于激进的胸痛中心流程,的确可以尽快拯救万千心肌梗死患者,如是AD误诊,患者将面临灾难性的后果。
3.3 防范误诊措施
3.3.1 提高急救医务人员对AD的重视度
加强急救人员对AD的重视度,注重采集急性胸痛患者涉及AD的病史资料,掌握正确诊断和鉴别急性胸痛患者是ACS还是AD的充分依据。尤其是胸痛特点、高危因素应仔细询问。体格检查全面细致,胸痛患者应常规测量四肢血压,检查足背动脉搏动。
3.3.2 提高接诊医生对心电图改变及心肌酶异常的认识
针对不同病情的胸痛患者,善于利用检查鉴别诊断,必要时动态监测心电图和心肌酶的演变,同时结合血气分析、D-二聚体等化验综合分析。若疑似AD诊断,应进一步选择超声心动图及主动脉CTA排外诊断。
3.4 确诊为AD患者后的措施
国内研究显示Stanford A型AD的围术期手术死亡率在9%~10%[9],而本研究死亡及严重并发症发生率为26.7%,主要原因是误诊为ACS的AD患者在外科手术前已予双联抗血小板及抗凝治疗,此举增加了AD患者围术期出血的发生率,而术后发生出血是患者术后30天死亡率的预测因素之一[10]。并且本研究中有53.3%的患者合并冠脉血管严重狭窄情况,有研究指出Stanford A型AD合并冠状动脉低灌注或合并严重冠状动脉病变患者的院内死亡率超过50%[11]。
所以指南[3]特别对AD治疗所需的多学科团队配置、医疗机构条件、硬件设备及仪器均有详细要求。为提高患者生存率,一旦确诊为AD的患者,有条件的医院立即手术[12],无条件的医院应在充分评估转运风险的情况下,尽早转至有条件的医疗机构进行救治。
综上所述,对于胸痛合并心电图改变的患者,应详细询问病史,全面查体,结合D-二聚体、心肌酶、超声心动图等结果进行甄别,必要时行主动脉CTA等影像学检查明确诊断,可减少误诊。

