绿豆黄酮超声波辅助醇提及其在浓香型白酒中的感官特性研究
冯华芳,刘敏欣,舒邦金,杨 勇,刘青青,赵旭冬,刘小刚,温 馨,兰 余,李景明,曹晓念,2*
(1.泸州老窖股份有限公司,四川泸州 646000;2.国家固态酿造工程技术研究中心,四川泸州 646000;3.中国农业大学食品科学与营养工程学院,北京 100083)
绿豆(Vigna radiata(Linn.)Wilczek),又名青小豆,为豆科蝶花亚科豇豆属一年生草本植物[1],主要分布在热带、亚热带地区。绿豆是我国重要的粮食作物,在黄河流域、东北地区和长江中下游平原均有广泛种植[2]。绿豆富含多种营养,具有清凉解毒、止泻利尿、消肿下气、消热解暑等功效,是传统的药食同源原材料。相传绿豆入酒始创于三国时期,最初是作为原料和其他谷物一同混合发酵,明代时出现以绿豆为香源物质的露酒[3]。整果直接浸泡有效成分溶出率低、且易带来豆腥味,故对绿豆进行前处理,提取功能性成分后添加,可有效降低杂质带来的不良风味。同时,对提取物的感官特性进行研究,以指导生产调配,提高绿豆在生产中的应用质效。
绿豆中含有丰富的营养物质和功能因子,以牡荆素和异牡荆素为代表的多酚类黄酮化合物被认为是主要的功能因子,具有抗氧化、抗炎、护肝等功能[4]。目前绿豆黄酮类化合物常见提取方法主要有热浸提法[5]、溶剂萃取法[6]、加热回流法、超声辅助提取[7]等,超声辅助提取因其耗时短、效率高、温度低的优势受到越来越多的关注。超声辅助提取法利用超声传播时所产生的机械效应、空化效应和热效应,可以缩短提取时间,降低操作难度并且增加提取率。目前超声辅助提取已广泛应用于多酚[8]、多糖[9-10]、多肽[11]等功能性成分的提取中,能较好的保留提取物功能性。本实验选取超声辅助提取方法对绿豆黄酮进行提取,具有技术可行性和安全性。
本试验利用超声辅助乙醇法提取,得到纯度较高的绿豆黄酮提取物,并进一步将其应用到浓香型白酒酒基中,以探究其感官特征,明确其阈值、舒适阈和风味特性,对拓展绿豆黄酮在露酒中的添加和运用,具有较好的指导意义。
1 材料与方法
1.1 材料、试剂及仪器
材料:绿豆购买自赣州康瑞农产品有限公司;42 %vol 及52 %vol 浓香型白酒基酒由泸州老窖养生酒业有限责任公司提供。
试剂及耗材:牡荆素标准品、异牡荆素标准品、乙酸(色谱级)、无水甲醇(色谱级),上海麦克林生化科技有限公司;食品级乙醇,河南鑫河阳酒精有限公司。
仪器设备:JCS-21 型分析天平(0.01 g),上海然浩电子有限公司;ME204E/02 型电子天平(0.0001 g),梅特勒-托利多仪器(上海)有限公司;KQ-500DE 型超声清洗机,昆山市超声仪器有限公司;ZX-S24 型数显恒温水浴锅,上海知信实验仪器技术有限公司;PTYC-1 型恒温水浴震动摇床,常州普天仪器制造有限公司;R-100 型旋转蒸发仪,瑞士步琦有限公司;CF16RXⅠⅠ型离心机;FD-1A-50型真空冷冻干燥机,北京博医康实验仪器有限公司;气相色谱仪(Βruker GC456),德国布鲁克公司;高效液相色谱仪(岛津LC-20AT),岛津企业管理(中国)有限公司;Venusil ASΒ C18色谱柱(4.6 mm×250 mm,5µm),天津博纳艾杰尔科技有限公司。
1.2 实验方法
1.2.1 绿豆黄酮提取工艺
1.2.1.1 绿豆黄酮提取液的制备
工艺流程:整粒绿豆→去离子水浸泡10 h→超声波辅助乙醇提取→取上清液→高效液相色谱法测定上清液中黄酮含量。
提取方法:准确称取一定质量的绿豆,按照1∶6(g/mL)的料液比用去离子水浸泡10 h。准确称量一定质量浸泡过的绿豆,按预设的料液比加入一定体积分数的乙醇溶液,充分混合后,进行超声提取。提取结束后,取上清液,过0.22 μ m 的微孔滤膜,用高效液相色谱仪测定提取液中黄酮的含量(黄酮含量以牡荆素和异牡荆素的总和计)。
1.2.1.2 高效液相色谱法测定绿豆黄酮的含量
流动相:A-1 %乙酸水溶液,Β-甲醇;检测波长:254 nm;洗脱条件:0~10 min,10~35 %Β;11~25 min,35~42 %Β;26~35 min,42~75%Β;36~40 min,75 %Β;41~45 min,75~10 %Β;46~50 min,10 %Β;进样体积:10 μ L;流速:1 mL/min;柱温:35 ℃。以牡荆素、异牡荆素标准品溶液进行绿豆黄酮组分鉴定,根据峰面积进行外标法定量[12]。
1.2.1.3 单因素实验设计
分别以超声功率(200 W、250 W、300 W、350 W、400 W、450 W、500 W)、超声时间(10 min、20 min、30 min、40 min、50 min、60 min)、超声温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃)、料液比(1∶4 g/mL、1∶6 g/mL、1∶8 g/mL、1∶10 g/mL、1∶12 g/mL、1∶14 g/mL、1∶16 g/mL)、乙醇体积分数(30%、40%、50%、60%、70%、80%、90%)为影响因素,设置5个因素的不同水平,以确定相关因素对提取液中黄酮含量的影响。
1.2.1.4 响应面分析法对绿豆黄酮提取工艺的优化
在单因素试验的基础上,采用五因素三水平的中心组合试验优化提取条件。试验因素与水平设计见表1。

表1 中心组合试验设计各因素的水平及编码
1.2.1.5 绿豆黄酮提取液的纯化
利用微滤和超滤对绿豆黄酮进行纯化,浓缩冻干后得到绿豆黄酮提取物。
1.2.2 绿豆黄酮感官分析
1.2.2.1 感官品评员的训练和筛选
通过发放电子调查问卷的方式初选60 名志愿者,年龄介于18~45 岁间,参照相关国家标准和感官培训方法[13-15],对志愿者味觉灵敏度进行测试,正确率小于80%的志愿者被淘汰。对合格的志愿者进行培训,训练内容包括差别检验、描述检验等,每次训练时长为40 min,总时长不少于30 h。训练结束后,考核候选人的味觉灵敏度和判别能力,根据最终考核结果和训练时长对感官品评员进行筛选,共有30位评价员符合要求,组成感官品评小组。
1.2.2.2 绿豆黄酮提取物阈值与舒适范围的测定
采用Scheffe 成对比较检验,测定绿豆黄酮提取物在水、42%vol浓香型白酒及52%vol浓香型白酒中的味觉阈值和舒适浓度范围[16]。
1.2.2.3 绿豆提取物在白酒基中感官表现的测定
依据GΒ/T 33405—2016《白酒感官品评术语》[17]中的感官描述词作为品评员参考术语,由专家品评小组对样品感官特征描述词进行筛选提炼,最终以涩感、苦味以及其他异味作为主要口感感官特征描述词进行后续评价分析。
采用数字评估法[16,18]对感官强度进行评估,特征定量表达参考见表2。

表2 白酒感官强度定量评分标准
评价结果异常值判断:按照三倍标准差法(3σ),计算多人品评结果的算术平均值(X)与标准差(s),品评结果中≥+3 s 或≤-3 s 的值视为异常值,予以删除。
评价结果计算:将异常值予以删除,正常值求平均值。
1.2.3 数据分析和绘图
使用SPSS 23 进行显著性差异分析,最低显著水平p<0.05;采用R4.1.2绘制图片。
2 结果与分析
2.1 绿豆黄酮提取工艺
2.1.1 绿豆黄酮提取单因素实验
以超声功率、超声时间、超声温度、料液比、乙醇体积分数为影响因素,探究各因素对提取液中黄酮含量的影响。
在200~350 W 范围内,随着超声功率的增加,绿豆黄酮的提取量增加,超声功率为350 W 时,绿豆黄酮的提取量最高,此时若继续增加超声功率,绿豆黄酮的提取效果下降。在350 W 条件下,提取液各分子动能增加,超声波的空穴效应最强,使得黄酮的溶出速度加快,随着超声功率的继续增大,黄酮提取量又有所下降,这可能是因为超声功率过高,导致分子运动过于剧烈,加强了黄酮分子和其他成分之间的反应使黄酮遭到破坏,提取量下降[19]。故将350 W定为最佳超声功率进行后续试验。
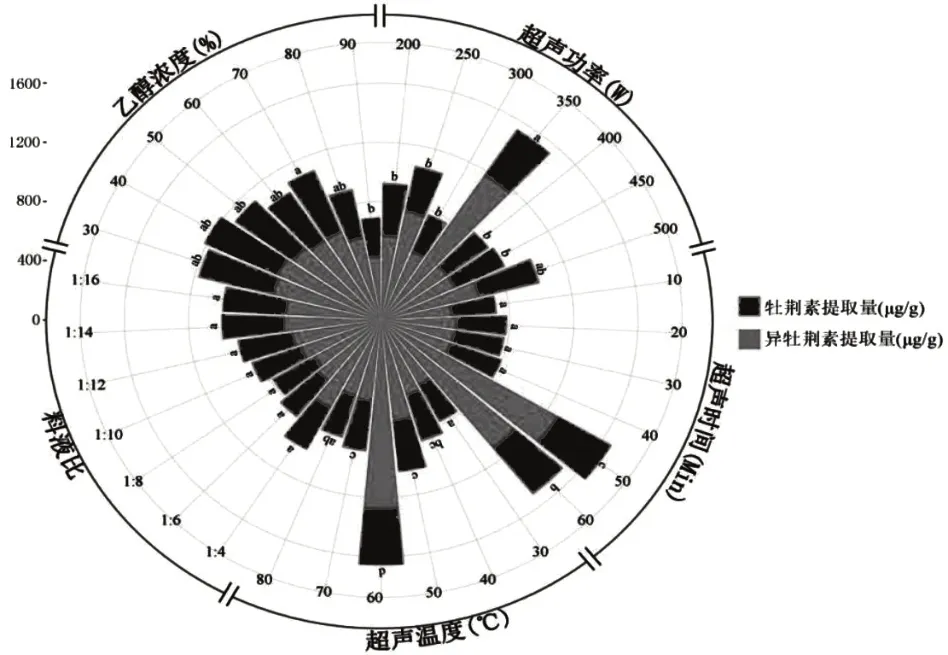
图1 各因素对绿豆黄酮提取量的影响
随着超声时间的延长,总黄酮的提取量呈现先升高后降低的趋势,这体现了提取量随时间延长的积累效应,过长时间的加热提取也会使黄酮遭到破坏。在50 min时提取量最大,故将50 min作为最佳超声时间。
随着超声温度的逐步升高,提取液中黄酮含量逐渐增加,60 ℃时黄酮提取量最大,可能是随着超声温度升高,分子动能增加、运动速度加快,渗透、扩散、溶解速度加快,使黄酮类化合物更易从细胞中转移到溶剂中。当温度继续升高,黄酮提取量又开始下降,这可能与黄酮类化合物在高温条件下被氧化破坏有关。因此,选择超声温度为60 ℃进行后续试验。
随着料液比的增大,黄酮提取量不断增加。但由于各组间结果并无显著性差异,考虑到节约溶剂的原则,故选取1∶4(g/mL)为最佳料液比进行后续试验。
当乙醇体积分数在30 %~80 %范围时,各组对绿豆黄酮的提取量无显著性差异,从节约溶剂的角度考虑,选取30 %体积分数的乙醇进行后续试验。
2.1.2 响应面优化绿豆黄酮提取方法
运用Design-Expert 8.0.6 软件,对绿豆总黄酮提取量的影响因素进行响应面分析,获得绿豆总黄酮提取量(Y)对编码自变量乙醇体积分数(A)、料液比(Β)、超声功率(C)、超声温度(D)和超声时间(E)的二次多项回归方程:
对上述回归模型方差分析结果如表3 所示,F检验显示回归模型具有较低的p 值(p<0.05),说明模型较显著。方程失拟项不显著(P>0.05),表明所建立的回归二次模型可以用来分析和预测超声波辅助乙醇提取绿豆黄酮的工艺条件。对回归模型的系数评估及显著性检验的结果表明一次项中Β 以及二次项对绿豆黄酮提取量具有显著影响,但交互项均不显著(P<0.05)。
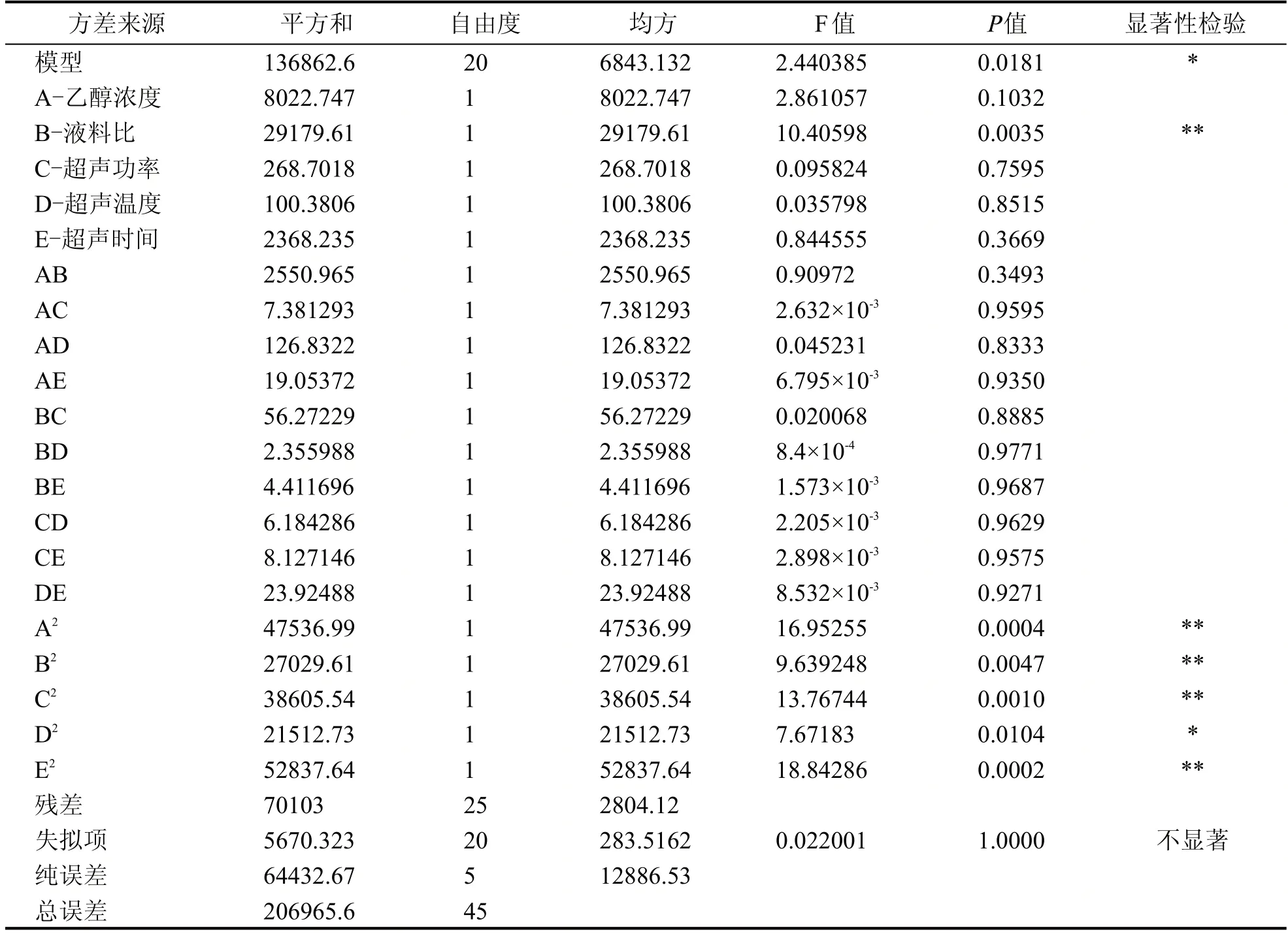
表3 多元回归模型方差分析、回归系数评估及其显著性检验
根据所建立的模型进行参数最优化分析,得到绿豆黄酮超声波辅助提取最佳工艺参数为:乙醇体积分数39.98%,料液比1∶3(g/mL),超声功率300 W,超声温度70 ℃,超声时间58.58 min,预测提取量为预测值1096.61 μ g/g。为方便实验将参数修改为:乙醇体积分数40%,料液比1∶3(g/mL),超声功率300 W,超声温度70 ℃,超声时间59 min。按照上述条件进行超声波辅助乙醇提取绿豆黄酮的验证实验,测得绿豆总黄酮提取量为1055.58 μ g/g,与预测值基本相符。表明该模型具有较好的预测性能,可用于指导生产实践。
2.2 绿豆黄酮提取液的纯化
利用微滤和超滤对绿豆黄酮进行纯化,纯化产物浓缩、冻干后作为绿豆黄酮提取物,纯度为31.00%。
2.3 绿豆黄酮提取物在水中的阈值与舒适阈
采用Scheffe 成对比较检验并加以改进,测定绿豆黄酮提取物在水相中的觉察阈值和舒适度,结果如图2所示。

图2 水相中绿豆黄酮的感官特性
2.4 绿豆黄酮提取物在浓香型白酒中的阈值与舒适阈
采用Scheffe 成对比较检验并加以改进,测定绿豆黄酮提取物在42%vol 和52%vol 基酒中的觉察阈值和舒适度,结果如图3所示。

图3 绿豆黄酮在基酒中感官特性
由图2 及图3 可知,绿豆黄酮在水相、42 %vol浓香型白酒和52%vol浓香型白酒中的察觉阈值分别为25 mg/L、5 mg/L、2.5 mg/L。3 种基质中的可接受范围分别<100 mg/L、<7.5 mg/L、<5 mg/L。在低酒精(或无酒精)中,绿豆黄酮可接受的添加量更多、范围更大。对葡萄酒等酒精饮料的研究表明,多酚类物质的苦味强度与其他物质的相互作用有关[20],乙醇可增强多酚类物质苦味的强度和持续时间[21]。相关研究表明,低浓度(4 %~12 %)的乙醇可降低单宁与蛋白质的相互作用,但更高浓度的乙醇则会加剧原花青素和没食子单宁的苦味[22]。大量感官实验已证明,乙醇具有甜、苦、酸等多种味感,在高浓度下会伴随灼烧、刺痛等三叉神经觉[23]。此外,酒精和黄酮类物质分别作用于不同苦味受体[24-26],说明酒精对黄酮类物质苦味的增强作用可能既有味觉的叠加,又有受体的互作。同时,还有观点认为黄酮的感官作用可能与其醇溶性有关[23]。关于乙醇和黄酮类物质的味觉互作机理还有待进一步开展研究。
2.5 绿豆黄酮提取物添加的感官特性分析
为了探究绿豆黄酮在白酒基质中的感官特性,结合相关文献报道和专家品评员对酒样进行感官特征描述,筛选涩味、苦味和其他异味3 个指标进行描述性感官分析。采用5 分制感官强度进行定量描述,以未添加样品为对照,对1 mg/L(低剂量)、2.5 mg/L(中剂量)、5 mg/L(高剂量)添加量的样品进行分析,结果如图4所示。
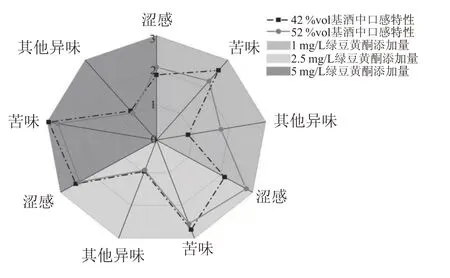
图4 绿豆黄酮在基酒中口感特性
感官分析发现,绿豆黄酮在基酒中主要表现苦味,除苦涩外其他异味不明显,高酒度下涩感更强。在42%vol 浓香型白酒中,绿豆黄酮苦味表现突出,但在52%vol浓香型白酒中,苦味和涩感得分相近,说明更高浓度的乙醇会增强其涩感,这与前人报道相符[22]。42 %vol 浓香型白酒中,低剂量与中剂量味感差异不大,可能与其阈值有关。52%vol浓香型白酒中,低剂量与中剂量差异明显,而中剂量与高剂量相差不大,说明此条件下舌面苦味受体已接近饱和。以上结果侧面反映了前述分析中酒精度对可接受的添加量的影响。对比两种基酒中的感官表现,发现同剂量下高酒度组的苦味均低于低酒度组,推测可能是由于乙醇钝化了味感的产生。
综上所述,绿豆黄酮在浓香型白酒中主要表现苦味和涩感,其他异味不显著。酒精度可能对口感表现具有增强涩感和协同苦味作用。
3 小结与展望
本研究在单因素试验的基础上,通过响应面回归分析,优化得到绿豆黄酮的超声波辅助乙醇提取最佳工艺条件为:乙醇体积分数40 %,料液比1∶3(g/mL),超声功率300 W,超声温度70 ℃,超声时间59 min,在此条件下绿豆黄酮提取量可达1055.58 μ g/g。利用微滤和超滤对绿豆黄酮提取液进行纯化,纯化产物浓缩、冻干后作为绿豆黄酮提取物,纯度为31.00%。
以浓香型白酒为基质,分析绿豆黄酮提取物在浓香型白酒中的感官特性,明确了其在不同基质中的阈值、舒适阈和感官特性,为绿豆黄酮在露酒中的应用提供了理论基础,但针对其他香型酒基的感官特性和与酒精度的互作机理还需进一步探究。接下来的研究将围绕绿豆黄酮的感官作用机理,针对性辅以其他原料,通过酒体设计手段改善绿豆黄酮在浓香型白酒体系中的感官表达,结合绿豆黄酮在露酒中的功效评价,优化绿豆黄酮使用量,进一步增加产品市场竞争力,形成更为显著的经济效益。同时,大量天然食药材中均富含黄酮,本研究成果也可对从其他原料中提取到的黄酮物质在白酒中的感官特性研究提供一定研究思路及应用参考。

