右美托咪定调节miR-711/GDNF信号轴对创伤性脑损伤大鼠认知障碍和神经损伤的影响
汪晖


摘要:目的:探究右美托咪定(Dex)是否能够通过调节miR-711/胶质细胞源性神经营养因子(GDNF)信号轴改善创伤性脑损伤(TBI)大鼠认知障碍和神经损伤。方法:将大鼠按照随机数字表法分为假手术组(Sham组)、TBI组、Dex组、miR-NC组、miR-711 agomir组、miR-711 antagomir组,每组10只。采用脑损伤打击器自由落体打击,建立TBI大鼠模型。结论:Dex可能通过调控miR-711/GDNF信号轴减轻海马组织病理损伤,抑制促神经元凋亡蛋白的表达,改善TBI后认知障碍和神经损伤,发挥脑保护作用。
关键词:右美托咪定;miR-711;胶质细胞源性神经营养因子;创伤性脑损伤;认知障碍;神经损伤
中图分类号:R96 文献标志码:A 文章编号:1008-4657(2023)04-0008-08
0 引言
创伤性脑损伤(traumatic brain injury, TBI)是临床脑外科常见的中枢神经系统损伤性疾病,是由于直接或间接暴力损伤脑部所致,具有较高的致死率、致残率[ 1 ],严重影响人类的生命健康。研究发现,交通事故频发是导致TBI发生率逐渐增加的主要原因,其导致的神经功能障碍与认知功能障碍为患者生活以及家庭都造成沉重的负担[ 2 ]。TBI主要分为原发性和继发性损伤,原发性损伤不可逆,可直接引起死亡[ 3 ];继发性损伤的发生机制复杂,与氧化应激、炎症反应以及神经元凋亡等多种病理活动有关[ 4 ],最终引起神经功能障碍与认知障碍[ 5 ]。因其发生机制尚不清晰,临床上用于TBI后神经保护药物较少,寻找及时有效的神经元修复手段与治疗方法是目前TBI的研究热点。
右美托咪定(dexmedetomidine, Dex)是一种高选择性中枢神经α2肾上腺素受体激活剂,广泛用于手术中的镇静止痛,具有抗氧化应激、改善炎症反应、减少细胞凋亡等作用[ 6-7 ]。大量研究证实,Dex在脑缺血再灌注、缺血缺氧以及脑出血等脑损伤中能够有效发挥神经保护作用[ 8-9 ]。研究发现,Dex能够通过减轻脑水肿、减少神经元凋亡、抑制自噬,改善TBI大鼠学习与记忆功能障碍,发挥脑保护作用[ 10 ]。近年来,微小RNA(miRNA)在脑损伤发生发展中的研究迅速发展,并受到广泛关注。研究发现,Dex通过调控miR-129-5p对新生小鼠缺血缺氧性脑损伤治疗效果显著[ 11 ]。TBI后miR-711水平显著上调,引起神经元凋亡蛋白异常表达,导致神经元死亡[ 12 ]。
胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)是一类多巴胺能神经营养因子,能够保护多种神经元损伤[ 13 ]。采用生物信息学网站预测可知,GDNF的3UTR上具有miR-711的结合位点,猜测GDNF可能是miR-711的靶基因。本研究采用双荧光素酶报告基因实验验证GDNF与miR-711的靶向关系,并建立TBI大鼠模型,探究Dex是否能够通过调节miR-711/GDNF信号轴,改善TBI后大鼠认知障碍,保护神经损伤。
1 材料
1.1 实验动物
SPF级雄性SD大鼠60只,8周龄,体质量为200~220 g,购自中国医学科学院医学生物学研究所,动物生产许可证号为SCXK(滇)K2019-0002。实验前适应性饲养一周,饲养条件为:温度22~25℃,湿度45%~55%,昼夜时长12 h:12 h,期间不控制饮水和采食。实验过程严格按照实验动物管理条例进行,符合“3R”原则。
1.2 实验药物与试剂
Dex(SC13911)购自北京凯诗源生物科技有限公司;miR-711激动剂(miR-711 agomir)、miR-711抑制剂(miR-711 antagomir)及阴性对照物均购自广州锐博生物科技公司;HE染色试剂盒(R3209)购自北京康瑞纳生物科技有限公司;TRIzol試剂盒(CD-13433-ML)购自武汉纯度生物科技有限公司;qPCR SYBR Green Master Mix荧光定量试剂盒(MQ101-01/02)购自南京诺唯赞生物科技股份有限公司;RIPA裂解液(R0010)、BCA蛋白检测试剂盒(PC0020)、ECL发光液(PE0010)均购自北京索莱宝生物技术有限公司;GDNF抗体(ab28956)、Bcl-2抗体(ab196495)、Bax抗体(ab32503)、GAPDH抗体(ab181603)、山羊抗兔二抗(ab6721)均购自英国Abcam公司。
1.3 实验仪器
ZH-ZYQ脑损伤打击器购自安徽正华生物仪器设备有限公司;Morris水迷宫装置购自广州吉妮欧生物科技有限公司;NB2000生物显微镜购自南京先纳光学仪器有限公司;RTQ-960 Pro实时荧光定量PCR(qRT-PCR)仪购自杭州艾康生物技术有限公司;Miulab GIS-500凝胶成像分析系统购自杭州米欧仪器有限公司。
2 方法
2.1 模型建立
将大鼠按照随机数字表法分为假手术组(Sham组)、TBI组、Dex组、miR-NC组、miR-711 agomir组、miR-711 antagomir组,每组10只。除Sham组外,其余组参考文献[ 14 ]采用脑损伤打击器自由落体打击,建立TBI大鼠模型:大鼠腹腔注射戊巴比妥钠进行麻醉,仰卧位固定于打击器上,头部消毒备皮,于颅骨正中开约3 cm长的切口,分离软组织暴露颅骨;于矢状缝正中,人字缝和冠状缝连接线中点的右3 mm处钻孔,注意保持硬脑膜完好;将打击垫放置在暴露的硬脑膜上,进行打击;之后进行止血消毒、逐层缝合头皮。Sham组10只大鼠仅开窗,不做撞击处理。
2.2 给药方法
参照文献[ 15 ],Dex组、miR-NC组、miR-711 agomir组、miR-711 antagomir组分别于造模前10 min腹腔注射Dex 100 μg/kg。造模结束后miR-NC组、miR-711 agomir组、miR-711 antagomir组立即进行对侧侧脑室miR-NC、miR-711 agomir和miR-711 antagomir的注射,每次1 nmol,注射5 μL。Sham组与TBI组给予等体积生理盐水进行注射。
2.3 Morris水迷宫实验评价各组大鼠认知功能
给药结束后48 h,参考文献[ 16 ]采用Morris水迷宫测试评价各组大鼠认知功能:放置水池,保持温度为22~25℃,注水后将水池平均分为四个象限,其中一个象限设置平台,训练大鼠找到平台,记录所需时间,每日进行4次实验,间隔15 s,训练4 d后,移除平台,记录逃逸潜伏期与经过原平台象限次数。
2.4 神经功能评分[ 14 ]
神经行为学评分:姿势异常(0~2分)、耳廓反射(0~1分)、角膜反射(0~1分)、立体感受检测(0~1分)、放置反射(0~4分)、翻正反射(0~3分)、抓握反射(0~4分),总分16分,评分越低提示行为学异常;运动功能评分:行走试验(0~3分)、平衡试验(0~6分)、爬坡试验(0~2分),总分11分,评分越低提示运动功能异常。
2.5 HE染色观察各组大鼠海马组织病理学变化
麻醉并断颈处死大鼠,分离海马组织,部分组织置于多聚甲醛中固定,制备常规石蜡切片,随后采用常规二甲苯、酒精脱蜡处理,HE染色,封片,置于显微镜下观察各组大鼠海马组织病理学变化。
2.6 qRT-PCR检测各组大鼠海马组织中miR-711、GDNF mRNA表达
采用TRIzol试剂盒提取海马组织总RNA,反转录合成cDNA。按照qPCR SYBR Green Master Mix荧光定量试剂盒说明书进行操作,采用qRT-PCR仪进行荧光定量PCR扩增。扩增条件为95℃预变性3 min,95℃变性5 s,60℃退火30 s,72℃延伸30 s,共45个循环。采用2-ΔΔCt法,以U6、GAPDH为内参,计算miR-711、GDNF mRNA相对表达量。qRT-PCR所需引物序列见表1。
2.7 双荧光素酶报告基因实验检测miR-711与GDNF的靶向关系
应用TargetScan生物信息学预测网站(http://www.targetscan.org/)预测发现,miR-711与GDNF具有潜在结合位点。采用双荧光素酶报告基因系统确定两者之间的靶向关系:将构建好的GDNF野生型质粒(GDNF-WT)与GDNF突变型质粒(GDNF-MUT)分别与NC mimics和miR-711 mimics共转染至HEK293T细胞(中科院细胞库提供)中,分别为miR-NC组、miR-711组。培养48 h后,采用荧光素酶活性检测试剂盒检测各组萤火虫荧光素酶活性(Fluc)和海肾荧光素酶活性(Rluc),以Fluc/Rluc表示相对荧光素酶活性。
2.8 Western Blot法检测各组大鼠海马组织GDNF以及神经元凋亡相关蛋白的表达
海马组织中加入RIPA裂解液提取总蛋白,采用BCA蛋白检测试剂盒检测总蛋白含量;取40 μg蛋白上样进行SDS-PAGE电泳,将蛋白转移至PVDF膜上,5%BSA封闭1 h,TBST洗膜,加入GDNF、Bcl-2、Bax、GAPDH一抗,4℃孵育过夜,TBST洗膜,加入二抗,室温孵育1 h,TBST洗膜后采用ECL显影,凝胶成像分析系统分析灰度值,以GAPDH为内参,计算目的蛋白的相对表达量。
2.9 统计学方法
实验数据采用SPSS22.0统计学软件进行分析,计量资料符合正态分布,以( ± s)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P < 0.05为差异具有统计学意义。
3 结果
3.1 Dex对TBI大鼠认知功能的影响
与Sham组比较,TBI组大鼠逃逸潜伏期明显延长,经过原平台象限次数显著减少(P < 0.05);Dex组大鼠逃逸潜伏期较TBI组显著缩短,经过原平台象限次数显著增加(P < 0.05);与Dex组比较,miR-NC组大鼠逃逸潜伏期与经过原平台象限次数无显著差异(P > 0.05);与miR-NC组比较,miR-711 agomir组大鼠逃逸潜伏期明显延长,经过原平台象限次数显著减少(P < 0.05),miR-711 antagomir组大鼠逃逸潜伏期明显缩短,经过原平台象限次数显著增加(P < 0.05)。结果见表2。
3.2 Dex对TBI大鼠神经功能的影响
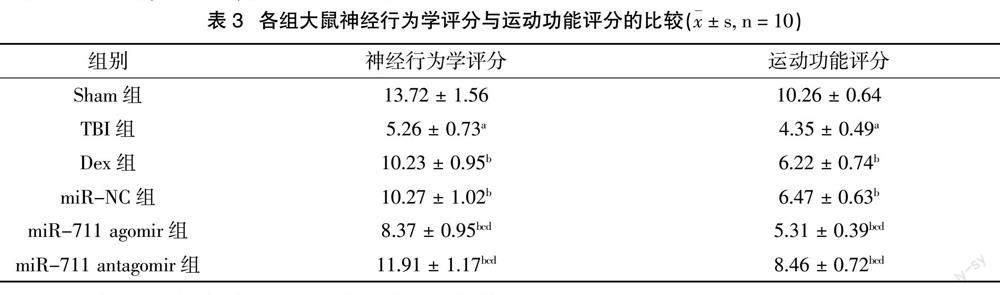
与Sham组比较,TBI组大鼠神经行为学评分与运动功能评分均显著降低(P < 0.05);与TBI组比较,Dex组大鼠神经行为学评分与运动功能评分均显著提高(P < 0.05);与Dex组比较,miR-NC组大鼠神经行为学评分与运动功能评分无显著差异(P > 0.05);与miR-NC组比较,miR-711 agomir组大鼠神经行为学评分与运动功能評分显著降低(P < 0.05),miR-711 antagomir组大鼠神经行为学评分与运动功能评分显著提高(P < 0.05)。结果见表3。
3.3 Dex对TBI大鼠海马组织病理损伤的影响
与Sham组比较,TBI后海马组织出现明显出血水肿,组织中神经元排列紊乱,细胞核固缩,可见细胞变性;与TBI组比较,Dex组大鼠海马组织病理损伤明显减轻;与Dex组比较,miR-NC组病理结构的改变类似;与miR-NC比较,miR-711 agomir组海马组织病理损伤加重,神经元排列松散,可见水肿变性,miR-711 antagomir组海马组织病理损伤显著改善。见图1。
3.4 Dex对TBI大鼠海马组织中miR-711、GDNF mRNA表达的影响
与Sham组比较,TBI组大鼠海马组织中miR-711表达显著升高,GDNF mRNA表达显著降低(P < 0.05);与TBI组比较,Dex组大鼠海马组织中miR-711表达显著降低,GDNF mRNA表达显著升高(P < 0.05);与Dex组比较,miR-NC组上述指标的变化无显著差异(P > 0.05);与miR-NC组比较,miR-711 agomir组大鼠海马组织中miR-711表达显著升高,GDNF mRNA表达显著降低(P < 0.05),miR-711 antagomir组大鼠海马组织中miR-711表达显著降低,GDNF mRNA表达显著升高(P < 0.05)。结果见表4。
表5显示,与miR-NC组比较,miR-711组转染GDNF-WT的细胞相对荧光素酶活性显著降低(P < 0.05),转染GDNF-MUT的细胞相对荧光素酶活性无显著差异(P > 0.05)。
3.6 Dex对TBI大鼠海马组织中GDNF、Bcl-2和Bax蛋白表达的影响
与Sham组比较,TBI组大鼠海马组织中GDNF、Bcl-2蛋白表达降低,Bax蛋白表达升高(P < 0.05);与TBI组比较,Dex组大鼠海马组织中GDNF、Bcl-2蛋白表达升高,Bax蛋白表达降低(P < 0.05);与Dex组比较,miR-NC组上述蛋白的表达差异无统计学意义(P > 0.05);与miR-NC组比较,miR-711 agomir组大鼠海马组织中GDNF、Bcl-2蛋白表达降低,Bax蛋白表达升高(P < 0.05),miR-711 antagomir组大鼠海马组织中GDNF、Bcl-2蛋白表达升高,Bax蛋白表达降低(P < 0.05)。結果见图3、表6。
4 讨论
由于颅脑结构的特殊性与功能重要性,大部分TBI患者都会遗留长期神经功能障碍状态[ 17 ]。TBI损伤主要是最初外力击打造成的原发性神经元和组织受损,经过一系列继发性病理变化,如炎性反应、氧化应激、细胞凋亡等导致大量神经元死亡,最终导致神经元丢失,造成不可逆的神经功能障碍[ 18-19 ]。因此,TBI发生后,进行及时有效的治疗,对TBI患者神经功能的修复具有关键意义。本研究通过采用改良自由落体法建立TBI模型,Morris水迷宫实验结果可知,TBI后大鼠认知功能出现明显障碍,行为学与运动能力也明显降低,海马组织中可见明显病变,神经元水肿变性,出现核固缩现象,提示TBI模型建立成功,大鼠认知功能出现障碍,神经损伤现象发生。Dex已被证实在缺血性脑损伤、TBI等疾病中能够抑制神经元凋亡,发挥脑保护作用[ 20-21 ]。本研究结果显示,Dex干预后的TBI大鼠认知功能得到一定程度的改善,海马组织病变减轻,海马组织中Bcl-2蛋白表达明显上调,Bax蛋白表达下调,提示Dex在TBI后神经损伤中发挥神经保护作用,并可能与抑制神经元凋亡有关,与李坪等[ 15 ]研究结果一致。
miRNA是一类高保守的非编码单链RNA,具有调控生命活动的作用,在中枢神经系统中参与神经细胞的生长与分化[ 22 ]。已有研究表明,上调miR-711的表达,引起DNA修复机制受阻,诱导神经元凋亡,引起神经退行性病变[ 23 ]。GDNF是一种生物活性极强的神经营养因子,研究发现,其能够通过抑制小胶质细胞活化和炎症反应,减少神经元凋亡,参与中枢神经系统神经元的存活与修复[ 24 ]。本研究结果显示,TBI大鼠海马组织中miR-711的表达明显增加,GDNF mRNA与蛋白表达均显著降低;另外,生物信息学网站预测与双荧光素酶报告基因实验证实GDNF是miR-711的靶基因,提示TBI后miR-711表达上调,抑制GDNF的表达,引起神经损伤。Dex干预后TBI大鼠海马组织中miR-711表达下调,GDNF表达上调,提示Dex可能通过调控miR-711/GDNF信号轴发挥神经保护作用。另外,本研究结果显示,过表达miR-711可以显著逆转Dex对TBI大鼠的神经保护作用,抑制miR-711表达又可以进一步促进Dex的神经保护作用,证实Dex改善认知功能障碍,减轻神经损伤,可能与miR-711/GDNF信号轴有关。
综上所述,Dex能够有效改善TBI大鼠认知障碍,减少神经元凋亡,减轻神经损伤,发挥脑保护作用,可能通过调控TBI后大鼠海马组织miR-711/GDNF信号轴的表达实现。这为临床上使用Dex作为TBI的新治疗手段提供了新的实验基础。但TBI病理机制复杂,本实验仅对认知障碍、组织损伤以及神经元凋亡相关蛋白表达进行了初步检测,其他机制还需进一步进行探索。
参考文献:
[1] Silverberg N D,Iaccarino M A,Panenka W J,et al. Management of concussion and mild traumatic brain injury: a synthesis of practice guidelines[J]. Arch Phys Med Rehabil,2020,101(2):382-393.
[2] Shin M K,Vázquez R E,Koh Y,et al. Reducing acetylated tau is neuroprotective in brain injury[J]. Cell,2021,184(10):2715-2732.
[3] 林淑君,张玉娟,林吉欢,等.针刺对创伤性脑损伤大鼠神经损伤的影响[J].针刺研究,2019,44(1):19-24.
[4] Liu Zaiming,Chen Qianxue,Chen Zhibiao,et al. RIP3 deficiency protects against traumatic brain injury(TBI) through suppressing oxidative stress,inflammation and apoptosis: dependent on AMPK pathway[J]. Biochemical and Biophysical Research Communications,2018,499(2):112-119.
[5] Arneson D,Zhang Guanglin,Ying Zhe,et al. Single cell molecular alterations reveal target cells and pathways of concussive brain injury[J]. Nature Communications,2018,9(1):3894.
[6] Fang Hua,Li Huafeng,Yang Miao,et al. MicroRNA-128 enhances neuroprotective effects of dexmedetomidine on neonatal mice with hypoxic-ischemic brain damage by targeting WNT1[J]. Biomedicine & Pharmacotherapy,2019,113:108671.
[7] Wang Kun,Wu Mengge,Xu Jian,et al. Effects of dexmedetomidine on perioperative stress,inflammation, and immune function: systematic review and meta-analysis[J]. British Journal of Anaesthesia,2019,123(6):777-794.
[8] Shi Yanyan,Peng Xiaohong,Li Xia,et al. Neuroprotective role of dexmedetomidine pretreatment in cerebral ischemia injury via ADRA2A-mediated phosphorylation of ERK1/2 in adult rats[J]. Experimental and Therapeutic Medicine,2018,16(6): 5201-5209.
[9] Wu Jin,Vogel Todd,Gao Xiang,et al. Neuroprotective effect of dexmedetomidine in a murine model of traumatic brain injury.[J]. Scientific Reports,2018,8(1):4935.
[10] 冀翔宇,張丽娜,刘然,等.右美托咪定后处理对大鼠创伤性脑损伤后脑保护作用及其机制[J].中华实验外科杂志,2020,37(9):1627-1630.
[11] Zhou Xiumin,Liu Jie,Wang Ying, et al. Silencing of long noncoding RNA MEG3 enhances cerebral protection of dexmedetomidine against hypoxic-ischemic brain damage in neonatal mice by binding to miR-129-5p[J]. Journal of Cellular Biochemistry,2018,120(5):7978-7988.
[12] Sabirzhanov B,Stoica B A,Zhao Z,et al. miR-711 upregulation induces neuronal cell death after traumatic brain injury[J]. Cell Death & Differentiation,2016,23(4):654-668.
[13] d'Anglemont de Tassigny X, Pascual A, López-Barneo J. GDNF-based therapies, GDNF-producing interneurons, and trophic support of the dopaminergic nigrostriatal pathway. Implications for Parkinson's disease[J]. Front Neuroanat,2015,9:10.
[14] 林晨,陈闯.三七总皂苷对创伤性脑损伤大鼠神经元凋亡的保护作用[J].中华全科医学,2021,19(6):932-935.
[15] 李坪,李晓文,王艳雪,等.右美托咪定通过SIRT1信号通路抑制脑损伤大鼠神经元凋亡[J].神经解剖学杂志,2020,36(6):612-618.
[16] Hu Hongqiang,Shu Mangqiao,Xue Fen,et al. Sirt1 mediates improvement of isoflurane-induced memory impairment following hyperbaric oxygen preconditioning in middle-aged mice[J]. Physiology & Behavior,2018,195:1-8.
[17] Pavlovic D,Pekic S,Stojanovic M,et al. Traumatic brain injury: neuropathological,neurocognitive and neurobehavioral sequelae[J]. Pituitary,2019,22(3):270-282.
[18] 童汝有,董黎明.三白草木脂素對创伤性脑损伤大鼠神经保护作用及Nrf2-ARE信号通路的影响[J].新中医,2020,52(6):1-4.
[19] Saeb S,Azari H,Mostafavi-Pour Z,et al. 9-cis-Retinoic acid and 1,25-dihydroxy vitamin D3 improve the differentiation of neural stem cells into oligodendrocytes through the inhibition of the notch and Wnt signaling pathways[J]. Iranian Journal of Medical Sciences,2018,43(5):523-532.
[20] Teng Lu,Chen Weiguang,Yin Changyou,et al. Dexmedetomidine improves cerebral ischemia-reperfusion injury in rats via extracellular signal-regulated kinase/cyclic adenosine monophosphate response element binding protein signaling pathway[J]. World Neurosurgery,2019,127:624-630.
[21] Zhang Manhe,Zhou Xiumin,Cui Jianzhong,et al. Neuroprotective effects of dexmedetomidine on traumatic brain injury: Involvement of neuronal apoptosis and HSP70 expression[J]. Molecular medicine reports,2018,17(6):8079-8086.
[22] Jiang Qiyong,Zhang Zhaohua,Sun Ying,et al. MiR-24 protects against ischemia-induced brain damage in rats via regulating microglia polarization by targeting Clcn3[J]. Neuroscience Letters,2021,759:135998.
[23] Sabirzhanov B,Makarevich O,Barrett J P,et al. Irradiation-induced upregulation of miR-711 inhibits DNA repair and promotes neurodegeneration pathways[J]. International Journal of Molecular Sciences,2020,21(15):5239.
[24] 刘芳,毛志蓉,邓莉,等.GDNF基因修饰的NSCs移植对暂时性缺血性脑卒中大鼠的神经保护作用研究[J].中国临床解剖学杂志,2020,38(4):408-413.
Impacts of Dexmedetomidine on Cognitive Impairment
and Neurological Damage in Rats with Traumatic Brain
Injury by Regulating miR-711/GDNF Signaling Axis
WANG Hui
(Laboratory Animal Center, Ningxia Medical University, Yinchuan 750004, China)
Abstract:Objective: To investigate whether dexmedetomidine (Dex) can improve cognitive impairment and neurological damage in rats with traumatic brain injury (TBI) by regulating the miR-711/glial cell-derived neurotrophic factor (GDNF) signaling axis. Methods: Rats were randomly divided into sham operation group (Sham group), TBI group, Dex group, miR-NC group, miR-711 agomir group, and miR-711 antagomir group, with 10 rats in each group. A TBI rat model was established by using a brain injury hammer to hit with a free fall. Conclusion: Dex may alleviate pathological damage in the hippocampus by regulating the miR-711/GDNF signaling axis, inhibit the expression of pro-apoptotic proteins, improve cognitive impairment and neural damage after TBI, and exert a protective effect on the brain.
Key words:dexmedetomidine; miR-711; glial cell-derived neurotrophic factor; traumatic brain injury; cognitive impairment; nerve injury
[责任编辑:许立群]

