灯盏花乙素对黑色素瘤B16 体内外的作用及机制研究
田冲冲,张 琦,包小波,陈延绅
(江苏医药职业学院药学院,江苏盐城 224005)
黑色素瘤是一种由黑色素细胞恶变产生的皮肤恶性肿瘤。据世界卫生组织数据统计,全世界每年约有132000 例新诊断的黑色素瘤患者[1],且发病率在世界范围内均呈逐年上升趋势。虽然黑色素瘤只占皮肤癌总体的1%,但由于其恶性程度高、侵袭性强,是死亡率最高的皮肤癌类型[2]。随着早期诊断、筛查、手术治疗的改进以及革新性的靶向治疗和免疫疗法的出现,黑色素瘤的死亡率在过去的十几年里有了明显的下降[3]。但转移性黑色素瘤患者5 年存活率仍旧不高,仅为16%[4]。我国多数黑色素瘤患者确诊时常处于中晚期,平均生存期较短[5]。目前黑色素瘤的临床治疗方案仍然是以局部手术为主。放疗、化疗、靶向以及免疫治疗等也可用于黑色素瘤的治疗[6]。但是,这些治疗方法存在一定的局限性[7],如放、化疗存在耐药性以及明显的毒性反应;靶向药物和免疫治疗的耐药性以及高昂的治疗成本也在一定程度上成为了疗效提高的限制性因素。为此,迫切需要能够治疗黑色素瘤新的化学结构实体并阐明其作用机制。
灯盏细辛(Erigeron breviscapus(Vant.)Hand.-Mazz),又名灯盏花,是中国传统药材,具有消炎止痛、散寒解表、活血通络等多种药理作用[8],临床主要用于治疗缺血性脑血管疾病、冠心病、心绞痛等。除此之外,灯盏花还被开发用于食品如茶饮以及化妆品领域[9-11]。现代药学研究证实,灯盏花中含有黄酮类、香豆素类、木脂素类、萜类等多种化学成分,其中以灯盏花乙素(Scutellarin,SCU)的含量最高[8]。进一步药理学研究表明,SUC 具有抗炎、抗氧化、抗纤维化、抗肿瘤等生物活性[12-14]。然而,目前尚无有关SCU 对黑色素瘤的作用及机制的研究。
本研究拟采用黑色素瘤B16 为研究对象,体外探究SCU 对B16 肿瘤细胞的直接作用,体内观察其对小鼠肿瘤生长及肿瘤血管新生的影响。由于骨髓源性细胞(Bone marrow derived cells,BMDCs)在肿瘤血管新生过程中扮演着重要角色[15],因此本研究拟进一步观察SCU 对BMDCs 及其亚群动员的影响,以进一步阐明SCU 抗肿瘤作用的分子机制。
1 材料与方法
1.1 材料与仪器
雌性C57BL/6 小鼠(体重16±2 g) 由北京维通利华动物技术有限公司提供[动物许可证号:SCXK(京)2018-001]。饲养条件:温度(24.0±1.0)℃,相对湿度40%~70%,昼夜交替进行光照,自由饮水和进食。所有操作均符合动物伦理学要求和实验动物管理条例,本实验已通过江苏医药职业学院动物伦理委员会批准。
B16 细胞株 中科院上海细胞库;胎牛血清 美国Gibco 公司;RPMI-1640 培养基 美国Gibco 公司;0.25%胰酶 Biosharp 生物科技公司;灯盏花乙素粉末 昆明龙津药业有限公司;吉西他滨 豪森制药有限公司;环磷酰胺 齐鲁制药(海南)有限公司;乌拉坦 上海山浦化工有限公司;肝素钠注射液 上海上药第一生化药业有限公司;多聚甲醛 天津科密欧化学试剂有限公司;Matrigel 基质胶 美国BD 公司;兔IgG 免疫组化试剂盒 博士德生物工程有限公司;Laminin Abcam 公司;红细胞裂解液、中性树胶、DAB 博士德生物工程有限公司;苏木素染色液 上海碧云天生物科技有限公司;乙醇、二甲苯 国药集团化学试剂有限公司;PE-anti-mouse VEGFR2、PE-anti-mouse Gr-1、Alexa Fluor488 antimouse CD11b Biolegend 公司。
HF90 细胞培养箱 上海力申仪器有限公司;医用超净工作台 江苏苏净集团有限公司;XD-202 倒置显微镜 德国ZEISS 公司;游标卡尺 世达工具有限公司;ELX808 酶标仪 美国BIOTEK 公司;TS-1000 脱色摇床 其林贝尔仪器制造有限公司;YB5001B 电子太平 上海衡际科学仪器有限公司。
1.2 实验方法
1.2.1 B16 细胞培养 将小鼠恶性黑色素瘤B16 细胞培养于含10%的胎牛血清的RPMI 1640 培养基中,置于37 ℃、5% CO2的恒温培养箱中培养。采用0.25%胰酶常规消化细胞并传代。
1.2.2 CCK-8 实验 参考彭布成等[16]的方法,取对数生长期的B16 细胞以8×103个/孔的密度接种于96 孔板中,每孔100 μL,置于培养箱中培养24 h 后,分别加入不同浓度梯度(0、20、40、80、160、320 及640 μmol/L)的SCU,同时设置空白对照组(无B16细胞)、阳性对照组 [0.1 μmol/L 吉西他滨(GEM)],每组6 个复孔。48 h 后,向每孔中添加CCK-8 溶液10 μL,孵育2 h。使用酶标仪测定450 nm 处的光密度(OD)值,计算细胞增殖率。上述实验单独重复3 次。
1.2.3 Transwell 实验评估细胞的迁移和侵袭能力 参考张媛等[17]的实验方法并进行修改。
1.2.3.1 迁移实验 B16 细胞常规消化后,用无血清的RPMI-1640 培养基重悬细胞,按2×105个/孔的密度接种至Transwell 上室中,并加入含200 μL 无血清培养基。下室加入600 μL 用完全培养基配制的不同浓度药物溶液(SCU 0、160、320 μmol/L;GEM 0.1 μmol/L),于培养箱培养48 h。取出上室,经无水酒精固定后,结晶紫染色,双蒸水冲洗后于显微镜下随机选取5 个视野进行观察拍照,观察并计算各组细胞穿出膜的数量。每组设置3 个复孔,实验单独重复3 次。
1.2.3.2 侵袭实验 预先使用稀释后的Martrigel 基质胶包被于Transwell 上室,自然晾干,其他步骤与迁移实验步骤相同。
1.2.4 荷瘤小鼠模型的建立 参考 Fernandes 等[18]的方法建立B16 荷瘤小鼠模型,即B16 细胞经胰酶消化后,用RPMI-1640 培养基重悬并调整细胞浓度为1×107个/mL,接种于C57BL/6 小鼠股沟皮下,每只0.1 mL(1×106个细胞)。
1.2.5 实验动物分组及给药 C57BL/6 小鼠皮下注射接种B16 细胞后,随机分为4 组,每组6 只:对照组(生理盐水)、40 mg/kg 环磷酰胺(CTX)组、30 mg/kg SCU 组和60 mg/kg SCU 组,接种24 h 后,按上述分组分别采取腹腔注射给予CTX 以及灌胃给予相应剂量的SCU,之后每24 h 给药一次,共给药13 次。
1.2.6 小鼠称重以及采集肿瘤组织样本 小鼠每天称重;待小鼠体内肿瘤长出后,用游标卡尺每隔1 天测量肿瘤长径(a)与短径(b),记录并计算小鼠肿瘤体积(V=1/2ab2)。待小鼠肿瘤最大直径约为10 mm时,20%((w/v)乌拉坦腹腔注射麻醉小鼠,用1 mL注射器抽取腹腔静脉血,剥离肿瘤组织,称重并拍照,将肿瘤组织投入到预先配好的4%(w/v)多聚甲醛中固定。
1.2.7 肿瘤组织免疫组化染色 参考试剂盒说明书和李湘平等[19]的方法,略作修改。将经脱水处理后的肿瘤组织放入熔融石蜡中进行包埋,包埋后的组织块切成约5 μm 厚的切片。切片经二甲苯、乙醇中浸泡后,滴加过氧化物酶去除剂、封闭液,作用后分别加入用PBS 稀释的Laminin 一抗,4 ℃过夜后,分别加入二抗、SABC(链霉亲和素-过氧化物酶复合物)。用DAB 染色水冲洗,苏木素溶液中复染,二甲苯溶液中透明处理,中性树胶封片,后在光学显微镜下观察肿瘤组织微血管分布情况。
1.2.8 流式细胞术检测SCU 对荷瘤小鼠循环血液中BMDCs 动员的影响 参考Zhou 等[20]的实验方法,将抽取的腹腔静脉血于1000 r/min,离心5 min,弃上清。加入10 倍体积的红细胞裂解液,于冰上裂解5 min。待裂解完成后于4 ℃,1000 r/min,离心5 min,弃红色上清。加入500 μL PBS 重悬,调整细胞数至1×106个/mL。加入100 μL 抗体稀释液于4 ℃避光孵育45 min 后,1000 r/min 离心5 min,弃上清,加入500 μL PBS 重悬,重复洗涤2 次。用500 μL 1%(w/v)多聚甲醛固定后上流式仪进行检测SCU 对荷瘤小鼠循环血液中VEGFR2+和Gr-1+CD11b+BMDCs细胞计数的影响。
1.3 数据处理
所有细胞实验重复3 次,结果以平均值±标准差表示。采用SPSS 23.0 统计软件对数据进行统计和分析;采用Origin 2018 软件作图。
2 结果与分析
2.1 SCU 对B16 肿瘤细胞增殖的影响
本实验首先在体外水平考察SCU 对B16 细胞的增殖抑制作用。由图1 CCK-8 检测结果可知,用浓度为20、40、80、160、320、640 μmol/L 的SCU以及0.1 μmol/L 的GEM 处理细胞48 h 后,与空白对照组相比,各组B16 细胞的相对增殖率分别为 96.04%、 88.59%、 79.34%、 52.85%、 41.93%、25.62%和34.20%。其中,当SCU 浓度为160、320、640 μmol/L 时,B16 的增殖率明显减少,差异具有极显著意义(P<0.01)。且320、640 μmol/L SCU 处理组的增殖抑制作用与阳性药0.1 μmol/L GEM 处理组相当。结果提示,SCU 可明显抑制B16 细胞的增殖。

图1 SCU 对B16 肿瘤细胞增殖的影响Fig.1 Effect of SCU on the proliferation of B16 cells
2.2 SCU 对B16 肿瘤细胞迁移和侵袭能力的影响
基于抗增殖实验的结果,选择了160 和320 μmol/L 两个SCU 浓度进行后续的侵袭和迁移实验。通过Transwell 实验检测了SCU 作用于B16细胞48 h 后对肿瘤细胞迁移和侵袭能力的影响。如图2 所示,与空白对照组相比,160、320 μmol/L 的SCU 以及0.1 μmol/L 的GEM 处理组穿过小室的细胞更少。说明SCU 抑制了细胞的迁移和侵袭。经统计(图3),160 μmol/L 的SCU 以及0.1 μmol/L 的GEM 均可显著抑制黑色素瘤B16 细胞的迁移(P<0.05);320 μmol/L 的SCU 可极显著抑制黑色素瘤B16 细胞的迁移(P<0.01)。无论是0.1 μmol/L 的GEM 还是160、320 μmol/L 的SCU 均可极显著抑制黑色素瘤B16 细胞的侵袭(P<0.01)。以上结果提示SCU 能够抑制B16 肿瘤细胞的迁移和侵袭能力。

图2 SCU 对B16 肿瘤细胞迁移和侵袭的影响Fig.2 Effect of SCU on the migration and invasion capacity of B16 cells

图3 SCU 对B16 细胞迁移(A)和侵袭(B)的统计分析Fig.3 Statistic analysis of SCU on the migration (A) and invasion (B) ability of B16 cells
2.3 SCU 对黑色素瘤B16 荷瘤小鼠肿瘤生长的影响
为了进一步验证SCU 对黑色素瘤的增殖抑制作用,接下来,在体内水平探索了不同剂量SCU 对B16 细胞荷瘤小鼠肿瘤生长的抑制作用。如图4A所示,在给药13 d 后,与空白对照组相比,30 mg/kg SCU 组、60 mg/kg SCU 组肿瘤平均体积分别减少了30.1%和60.5%,差异具有极显著性(P<0.01)。同时,整个给药期间,无论是30 mg/kg 还是60 mg/kg SCU 处理组均未引起小鼠体重明显的下降(图4B)。提示SCU 在抑制B16 荷瘤小鼠肿瘤生长的同时并未引起明显的毒性。
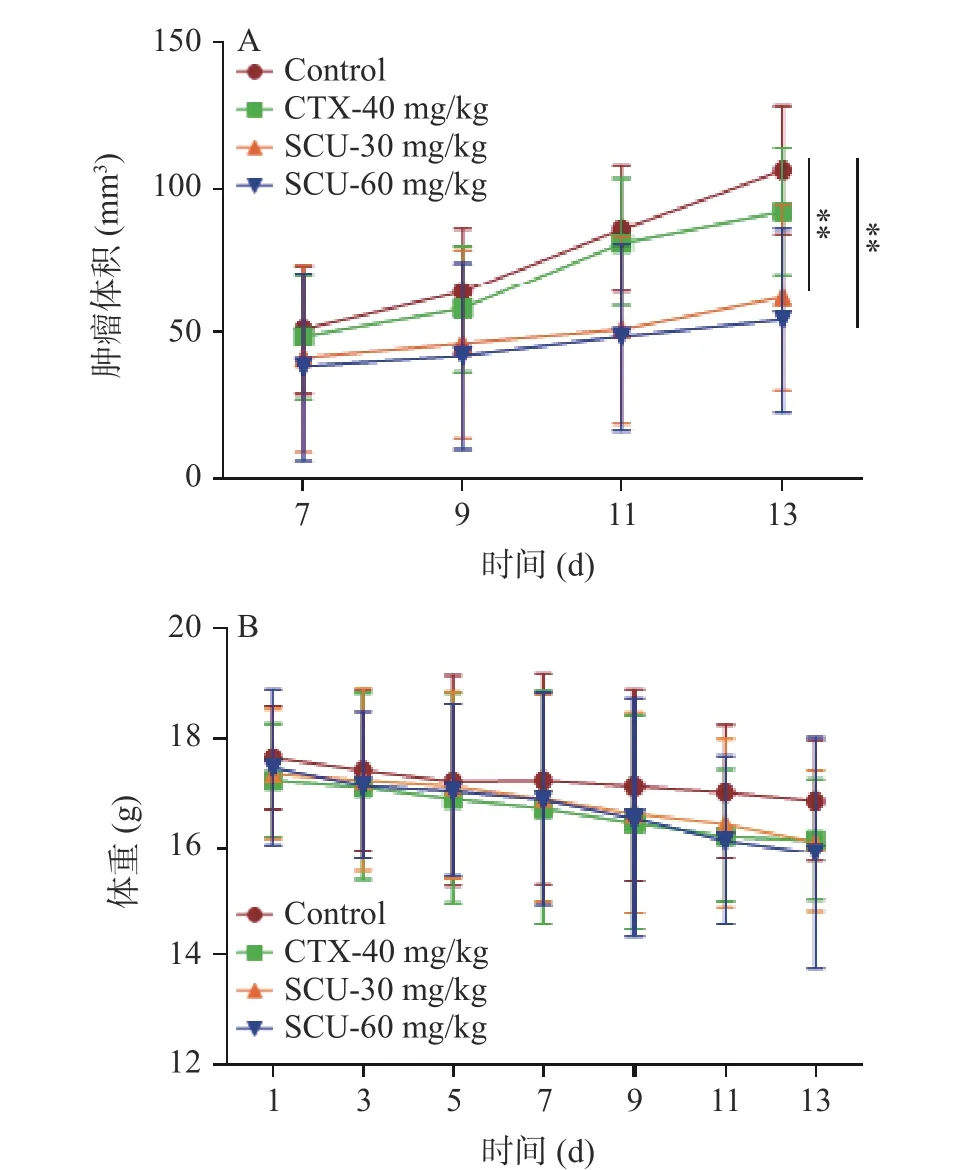
图4 SCU 对B16 荷瘤小鼠肿瘤体积(A)和体重(B)的影响Fig.4 Effect of SCU on tumor volume (A) and weight (B) of B16-bearing mice
实验结束后处死小鼠并剥离肿瘤组织称重,如图5 所示,空白对照组以及各给药组(CTX 40 mg/kg、SCU 30 mg/kg 和60 mg/kg)的瘤重分别为1.22±0.09 g、0.68±0.46 g、0.31±0.17 g 和0.24±0.17 g。与空白对照组相比,40 mg/kg CTX 组瘤重减少44.3%,具有显著性差异(P<0.05);30 mg/kg SCU 组和60 mg/kg SCU 组瘤重分别减少74.6%和80.3%,均具有极显著性差异(P<0.01)。由以上结果可知,SCU 能够显著抑制在体肿瘤B16 的生长。

图5 SCU 对B16 荷瘤小鼠肿瘤生长的影响Fig.5 Effect of SCU on the growth of B16 tumor from mice
2.4 SCU 对B16 荷瘤小鼠微血管密度的影响
微血管密度(Microvascular density,MVD)是直观评估肿瘤血管生成程度的定量指标,间接判断血管生成能力[21]。层粘连蛋白(Laminin,LN)是构成细胞间质的一种非胶原糖,与胶原一起构成基底膜的成分,在体内参与细胞黏附、转移、分化、生长,以及信号转导、组织修复,且在血管生成中也具有重要作用[22]。LN 主要存在于微血管基底膜中,检测LN 可反映微血管结构完整性[23]。为了在体内水平探讨SCU 抑制黑色素瘤的机制,采用免疫组化方法对肿瘤组织切片进行了LN 染色以评估SCU 能否影响B16肿瘤的微血管密度(Microvascular density,MVD)。如图6 所示,显微镜下观察组织切片可见阳染的微血管广泛分布于肿瘤组织间质(图中箭头所指)。通过免疫组织化学半定量分析结果显示,与空白对照组相比,40 mg/kg CTX 组肿瘤组织的MVD 减少25.44%,差异具有显著性(P<0.05);30 mg/kg SCU组及60 mg/kg SCU 组肿瘤组织的MVD 分别减少36.03%和44.61%,具有极显著差异(P<0.01)。结果表明,SCU 可以降低B16 荷瘤小鼠肿瘤组织的MVD。

图6 SCU 对B16 肿瘤组织微血管密度的影响Fig.6 Effect of SCU on microvessel density in B16 tumor tissue
2.5 SCU 对B16 荷瘤小鼠循环血液中BMDCs 动员的影响
骨髓源性细胞(Bone marrow-derived cells,BMDCs)由内皮和周细胞祖细胞以及促血管生成、肿瘤浸润的免疫细胞组成,在肿瘤血管新生、肿瘤生长和转移中发挥着十分重要的作用[24]。其中,血管内皮生长因子受体2 阳性(Vascular endothelial growth factor receptor 2 positive,VEGFR2+)内皮祖细胞倾向于沉积于血管生成活跃的血管腔中,促进血管形成[25-26]。抑制内皮细胞祖细胞可抑制肿瘤移植物的血管生成,从而增加动物存活率[27]。晚期癌症患者循环VEGFR2+BMDCs 细胞水平升高则与总生存期更差相关[28]。因此,为了进一步阐明SCU 的抗肿瘤作用,首先采用流式细胞技术检测了SCU 对B16 荷瘤小鼠外周循环血液中VEGFR2+BMDCs 亚群细胞计数的影响。结果如图7 所示,对照组及各给药组VEGFR2+BMDCs 计数分别为14.33%、6.83%、4.59%及4.25%。与空白对照组相比,40 mg/kg CTX 组、30 mg/kg SCU 组及60 mg/kg SCU 组计数平均减少52.32%、67.95%及70.35%,差异均具有统计学意义(P<0.01)。结果表明SCU 可以减少B16 荷瘤小鼠外周循环血中VEGFR2+BMDCs 水平。

图7 SCU 对B16 荷瘤小鼠外周血中VEGFR2+ BMDCs计数的影响Fig.7 Effect of SCU on numbers of VEGFR2+ BMDCs in peripheral blood of B16-bearing mice
BMDCs 中的骨髓抑制细胞(Myeloid-derived suppressor cells,MDSCs)在肿瘤免疫抑制以及血管形成过程中也扮演着重要的角色[29-30]。MDSCs 是由未成熟的髓系细胞组成的异质性细胞群体,其中CD33+CD11b+HLA-DRlow-/-是人的MDSCs 标志物,Gr1+CD11b+为小鼠的MDSCs 标志物[31]。因此,采用流式细胞技术也检测了SCU 对B16 荷瘤小鼠外周循环血液中Gr-1+CD11b+MDSCs 细胞计数的影响。结果如图8 所示,空白对照组、40 mg/kg CTX 组、30 mg/kg SCU 组及60 mg/kg SCU 组的Gr-1+CD11b+MDSCs 计数分别为84.73%、61.62%、44.74%及24.90%。与空白对照组相比,40 mg/kg CTX 组计数减少27.28%,差异具有统计学意义(P<0.05);30 mg/kg SCU 组及60 mg/kg SCU 组计数分别减少了47.20%及70.61%,具有极显著差异(P<0.01)。结果表明SCU 也可以减少B16 荷瘤小鼠外周循环血中Gr-1+CD11b+MDSCs 的水平。

图8 SCU 对B16 荷瘤小鼠外周血中Gr-1+CD11b+MDSCs 计数的影响Fig.8 Effect of SCU on numbers of Gr-1+CD11b+MDSCs in peripheral blood of B16-bearing mice
3 结论
本实验对SCU 的抗黑色素瘤作用进行了探究。结果显示,SCU 在160~640 μmol/L 浓度范围内均可显著抑制B16 细胞的增殖,且160 μmol/L 与320 μmol/L 的SCU 还能够显著抑制B16 肿瘤细胞迁移和侵袭。接下来的体内移植瘤实验结果表明,SCU 可明显抑制B16 肿瘤生长,与空白对照组相比,30 mg/kg SCU 组和60 mg/kg SCU 组瘤重分别减少74.6%和80.3%。同时30 mg/kg 及60 mg/kg SCU处理组还可显著降低肿瘤组织的MVD。证实SCU 在体内水平也具有抗黑色素瘤作用。后续的流式细胞术分析结果证实,30 mg/kg 和60 mg/kg SCU 可明显减少小鼠循环血液中VEGFR2+BMDCs及Gr-1+CD11b+BMDCs 的计数。以上结果也验证了SCU 的抗肿瘤作用可能也与其抑制BMDCs 的动员,从而间接减少了肿瘤血管新生有关。
综上所述,SCU 具有抑制B16 肿瘤的生长的作用,这一作用与其直接抑制肿瘤细胞增殖、迁移侵袭能力有关,更与其抑制BMDCs 的动员,从而间接削弱了肿瘤血管新生密切相关。本次研究虽为深入了解SCU 抗癌的药理学作用规律机制提供了一定的理论依据,但仅仅是从体内外实验的角度初步探讨了SCU 对B16 肿瘤生长的抑制作用,后续还需要对具体的作用机制进行更为深入的研究和验证,以便全面、准确地掌握SCU 的药理作用规律,提高肿瘤治疗效果,加快其早日应用于临床肿瘤治疗的步伐。

