DEB-TACE联合瑞戈非尼二线治疗不可切除晚期肝细胞癌的疗效和安全性▲
于广计 张永会 徐慧超 王庆东 刘 松 朱志真
(临沂市肿瘤医院介入治疗科,山东省临沂市 276034)
由于起病隐匿,50%~75%的肝细胞癌患者就诊时已处于疾病晚期,失去外科根治手术治疗的机会[1]。多激酶抑制剂索拉非尼和仑伐替尼是不可切除晚期肝细胞癌患者的一线药物治疗方案,然而治疗后患者的中位无进展生存期仅为3.7~7.3个月[2-3],一线药物治疗后如肿瘤进展则需要进行二线治疗。瑞戈非尼、卡博替尼、雷莫芦单抗是用于治疗晚期肝细胞癌的二线药物,但治疗后患者客观缓解率仅为4%~11%,中位生存期为8.5~10.6个月[4-6]。因此,亟待寻求更优的方案进一步改善不可切除晚期肝细胞癌患者的预后。经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)为不可切除晚期肝细胞癌的重要治疗手段,联合载药微球(drug-eluting beads,DEB)可获得更高的肿瘤反应率[7]。因此,在瑞戈非尼治疗的基础上联合DEB-TACE治疗不可切除晚期肝细胞癌可能更具优势。本研究探讨DEB-TACE联合瑞戈非尼二线治疗一线药物治疗失败的不可切除晚期肝细胞癌患者的有效性和安全性,现报告如下。
1 资料与方法
1.1 临床资料 回顾性分析2019年10月至2021年6月山东省临沂市肿瘤医院收治的34例不可切除晚期肝细胞癌患者的临床资料。入选标准:(1)经临床或肝脏穿刺病理活检诊断为肝细胞癌[8],经过医院多学科综合诊疗评估,明确为目前不可手术切除者;(2)既往接受一线药物(索拉非尼/仑伐替尼)治疗后肿瘤进展或复发者;(3)年龄≥18岁;(4)美国东部肿瘤协作组体能评分[9]0~2分;(5)Child-Pugh肝功能分级[10]A~B级,心肺肾功能正常,无本研究治疗禁忌证;(6)预计生存期在3个月以上。排除标准:(1)合并其他重要脏器严重功能障碍;(2)存在不能有效控制的肝外转移病灶,如肺、骨、脑等部位肿瘤转移。依据治疗方案将患者分为观察组15例和对照组19例。两组患者在年龄、性别、Child-Pugh肝功能分级、美国东部肿瘤协作组体能评分、巴塞罗那临床肝癌分期[11]等方面差异均无统计学意义(均P>0.05),见表1。本研究经临沂市肿瘤医院伦理委员会批准通过,患者在治疗前均签署知情同意书。

表1 两组患者的一般资料比较
1.2 治疗方法
1.2.1 对照组: 口服瑞戈非尼片(Bayer公司,国药准字H20171300)治疗,120 mg/次,1次/d,连续服药21 d,停药7 d,28 d为1个治疗周期,所有患者均规律服药至肿瘤出现进展恶化或末次随访时。服药治疗期间,监测药物不良反应发生情况。如果出现不可耐受的药物毒性反应则将瑞戈非尼剂量降至80 mg/d或停药。不可耐受的药物毒性反应指3级或4级血液学毒性、皮肤毒性、高血压、肝功能障碍等。
1.2.2 观察组: 先行DEB-TACE治疗,DEB-TACE治疗后3~5 d服用瑞戈非尼治疗,服药方法同对照组。DEB-TACE治疗采用塞丁格穿刺法穿刺右侧股动脉,引入泰尔茂外周血管造影导管肝管常规行腹腔动脉、肝总动脉造影,根据肿瘤部位、大小及肿瘤染色是否完整等情况,辅助行膈动脉、肠系膜上动脉、胃左动脉、右肾动脉等异位供血动脉造影,以明确肿瘤所有供血动脉。微导管超选择送至肿瘤供血动脉后,缓慢推注预先配置好的CalliSpheres DEB(微球直径为100~300 μm/300~500 μm,加载药物为表柔比星60~80 mg)直至对比剂流速停滞后停止栓塞,5 min后再次行造影检查,观察肿瘤染色是否完全消失,若仍有肿瘤染色存在则追加栓塞。
1.3 观察指标 首次治疗后2个月复查上腹部强化CT/MRI,应用改良的实体瘤疗效评价标准[12]进行疗效评价。完全缓解:所有目标病灶动脉期强化显影消失。部分缓解:目标病灶(动脉期强化显影) 的直径总和较治疗前减少≥30%。疾病稳定:目标病灶(动脉期强化显影)的直径总和较治疗前减少未达到部分缓解或增加未达到疾病进展。疾病进展:目标病灶(动脉期强化显影) 的直径总和较治疗前增加≥20%,或出现新病灶。客观缓解率=(完全缓解+部分缓解)例数/总例数×100%;疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。总生存期定义为接受二线治疗开始到患者死亡或末次随访的时间;无进展生存期(progression-free survival,PFS)定义为接受二线治疗开始到患者疾病进展或死亡的时间。根据美国国立癌症研究所常见不良反应分级标准5.0版[13]判定不良反应,分为0~Ⅳ级。
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析。计数资料以例数(百分比)表示,组间比较采用χ2检验;正态分布的计量资料以(x±s)表示,组间比较采用两独立样本t检验;采用Kaplan-Meier进行生存分析,采用log-rank检验比较生存率。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者近期临床疗效的比较 治疗2个月后,观察组患者客观缓解率为73.3%(11/15),疾病控制率为86.7%(13/15);对照组患者客观缓解率为10.5%(2/19),疾病控制率为52.6%(10/19)。观察组客观缓解率及疾病控制率均高于对照组(均P<0.05)。见表2。

表2 两组患者近期临床疗效的比较
2.2 生存分析 末次随访为2022年7月31日,随访时间为6~30个月,中位随访时间为12.5个月,无失访病例。至末次随访时,观察组和对照组中位PFS分别为9个月和6个月,两组比较差异有统计学意义(χ2=5.555,P=0.018);观察组和对照组患者中位生存期分别为18个月和12个月,两组比较差异有统计学意义(χ2=7.837,P<0.005)。见图1、图2。

图1 两组患者PFS曲线图 图2 两组患者总生存曲线图
2.3 两组患者不良反应发生情况 观察组患者DEB-TACE相关不良反应有发热、疼痛、恶心及呕吐,均≤Ⅱ级,持续时间5~7 d,经对症处理后均得到缓解,未出现肝脓肿、胃肠道穿孔、肝肾功能衰竭等严重并发症。两组患者发生的与瑞戈非尼相关的不良反应主要有手足综合征、乏力、高血压、腹泻、蛋白尿等,经短暂停药、对症处理、降低服药剂量后基本可缓解,未出现终止用药退出研究的病例。两组患者瑞戈非尼相关不良反应发生率比较,差异均无统计学意义(均P>0.05)。见表3。
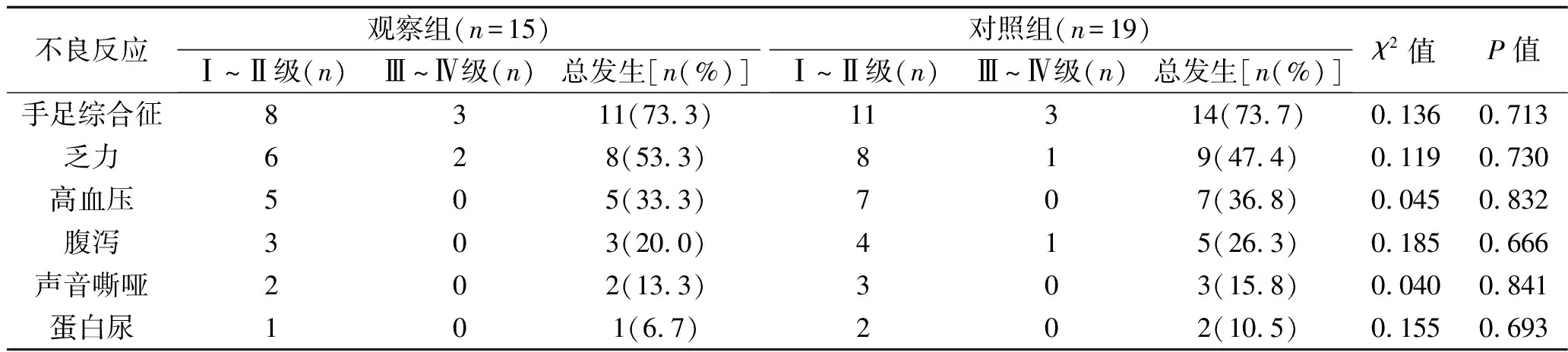
表3 两组患者瑞戈非尼相关不良反应发生率的比较
3 讨 论
瑞戈非尼是一种多靶点的口服酪氨酸激酶抑制剂,作用位点包括血管内皮细胞生长因子受体、血小板衍生生长因子受体-β、成纤维细胞生长因子受体、突变型C-Kit激酶及鼠类肉瘤滤过性毒菌致癌同源体B1等,可有效抑制相关信号通路、阻断血管生成,从而抑制肿瘤进展[14]。此外,瑞戈非尼还具有改善肿瘤免疫微环境的作用,与其他治疗方法发挥协同抗肿瘤作用[15]。一项多中心、安慰剂对照的Ⅲ期临床试验将索拉非尼不耐受或治疗后疾病进展的晚期肝细胞癌患者,随机分为瑞戈非尼组(n=379)和安慰剂组(n=194),结果显示,与安慰剂组相比,接受瑞戈非尼治疗的晚期肝细胞癌患者具有更高的客观有效率和疾病控制率,以及更长的PFS、疾病进展时间和总生存期[4]。目前瑞戈非尼成为索拉非尼治疗后肝细胞癌进展患者的标准二线治疗药物。但由于瑞戈非尼单一治疗的疗效有限,目前主要与其他治疗方法联合应用以提高晚期肝细胞癌患者生存率。
TACE可快速降低肿瘤负荷,但同时会诱导缺氧诱导因子1α表达,引起局部组织缺氧,导致血管内皮细胞生长因子等表达上调[16]。瑞戈非尼可作用于多个靶点,相较其他酪氨酸激酶抑制剂药物能更全面地抑制肿瘤相关信号通路,并可调节免疫微环境,联合TACE可发挥更强的抗肿瘤作用[17]。既往研究显示,TACE联合索拉非尼可以优势互补,从而弥补单一治疗的不足,提高整体治疗效果[18]。Han等[19]发现,使用瑞戈非尼联合TACE治疗索拉非尼治疗后肝细胞癌进展患者,治疗有效率较高,预后较好。
DEB作为一种新型栓塞材料,具有血管栓塞和化疗药局部缓释的双重作用,可以有效作用于瘤体,从而提高肿瘤反应率[20]。我们前期研究应用DEB-TACE治疗不可切除大肝癌,术后5~7 d复查CT/MRI即可见肿瘤组织明显坏死,部分成蜂窝状改变,客观缓解率和疾病控制率可达69.05%、92.86%[21]。本研究结果显示,观察组客观缓解率和疾病控制率均高于对照组(均P<0.05)。这提示,对于一线药物治疗后进展的肝细胞癌患者,由于抗血管生成作用,使得肿瘤血管变纤细,但DED-TACE依然可以对供瘤动脉进行有效栓塞,DEB的药物缓释作用使局部聚集的高浓度化疗药物最大限度地发挥杀伤肿瘤细胞的作用,增强抗肿瘤效应。本研究中,对照组患者中位PFS为6个月,中位总生存期为12个月,疗效优于部分研究结果[22-23]。分析原因可能是除病例基线资料的差异外,本研究所采用的较低起始剂量(120 mg/d)的瑞戈非尼耐受性好,便于患者长期服药,临床获益更多。观察组患者的中位PFS为9个月,中位总生存期为18个月,提示DEB-TACE联合瑞戈非尼可能具有协同抗肿瘤作用,可延长不可切除晚期肝细胞癌患者的生存时间。
研究表明,TACE联合靶向药物治疗可能会增加患者肝功能不全的风险[24]。本研究中,瑞戈非尼治疗后常见的不良反应有手足综合征、乏力、高血压、腹泻、蛋白尿等,主要为Ⅰ~Ⅱ级不良反应,Ⅲ~Ⅳ级不良反应发生率为29.4%(10/34),低于其他研究报告的结果[25]。考虑原因为,本研究中瑞戈非尼服药起始剂量较低,治疗期间根据不良反应发生情况及时进行对症处理,有效减少Ⅲ~Ⅳ级不良反应的发生。两组瑞戈非尼相关不良反应发生率差异均无统计学意义(均P>0.05),提示DEB-TACE联合瑞戈非尼未增加瑞戈非尼相关的不良反应发生率,患者耐受性良好。观察组患者行DEB-TACE治疗后出现的不良反应主要为发热、疼痛、恶心及呕吐,均≤Ⅱ级,经内科对症处理后均得到缓解,未出现肝脓肿、胃肠道穿孔、肝肾功能衰竭等严重并发症,这与相关研究结果相似[26-27]。
综上所述,不可切除晚期肝细胞癌患者采用DEB-TACE联合瑞戈非尼二线治疗可以提高客观缓解率和疾病控制率,延长患者的PFS和总生存期,安全性和耐受性良好。但本研究样本量较小,且属于回顾性研究,相关数据不够完善,导致研究结果可能存在一定偏倚,今后将加大样本量进行前瞻性临床研究,以进一步观察该方法的疗效和安全性。

