我国15 种典型土壤中菲对白符跳的毒性阈值及其预测模型
冯献捷,王 冕,韩东锦,侯 红,赵 龙,左晓俊1
1. 南京信息工程大学,江苏 南京 210044
2. 中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012
多环芳烃(PAHs)是一种典型的持久性有机污染物,广泛分布在环境中,由于其“三致”效应受到广泛关注[1]. 环境中的PAHs 来源广泛,其中燃煤和石油等化石燃料的焚烧是其主要来源[2-3]. PAHs 在各种环境介质中长期累积,其中土壤承担了环境中90%以上的PAHs 负荷[4]. 16 种优先控制黑名单中的PAHs 在我国农用地和工业用地土壤中均有检出,其中菲(Phe)和荧蒽的检出率最高[5-6]. Phe 是3 个苯环以弯接的方式排列组成的稠环芳烃,在我国耕层土中的含量介于n.d.(未检出)~782 ng/g 之间[7],是PAHs 的主要成分之一. Phe 拥有稳定的化学结构和高辛醇-水分配系数等特性,易在环境中富集,进入土壤环境后会破坏土壤结构,从而降低农作物品质[8];如果Phe进入动植物和人类的体内,将导致生物体中的自由基和超氧化阴离子增加,进而损伤动植物的抗氧化防护结构,最终造成DNA 损伤,并为人体带来致癌风险[9-11].
跳虫是一种典型的土壤无脊椎动物,在土壤环境中广泛分布[12]. 由于跳虫在土壤中的特殊地位和功能,其群落结构和种群特征多年来一直被作为土壤质量评估的指标,随着近些年各种环境污染问题的不断提出与重视,跳虫也逐步用于重金属、农药及污染物的毒性评估中[13]. 跳虫分布广泛,种类繁多,其中白符跳(Folsomia candida)由于具有繁殖周期短、生长速度快的特性,在针对某些化学污染物时,相较于节跳(Isotomidae)具有更高的敏感度与耐受性[14],近年来已在对污染环境的生态评估研究中得到越来越广泛的应用,并且已被国际标准化组织(ISO)规定为模式生物.
PAHs 毒性阈值研究能够为土壤PAHs 环境基准值的制定提供依据. 目前,国内外学者基于PAHs 对植物与土壤无脊椎动物开展了相关毒性阈值研究,例如,Henner 等[15]在外源添加PAHs 的土壤中培养卢珊豆,以探究土壤中PAHs 对卢珊豆生长及种子萌发的抑制作用;崔春燕等[16]研究发现,土壤外源添加Phe 对赤子爱胜蚓(Eisenia foetida)7 d 和14 d 的LC50值分别为88.01 和60.96 mg/kg,但国内关于Phe 对白符跳的毒性阈值研究非常缺乏,且已开展的研究仅限于单一土壤或人工土壤,忽略了不同类型土壤可能对PAHs 毒性产生的差异[17-18]. 已有相关研究[19-21]表明,土壤的理化性质(有机质含量、pH、CEC、黏粒等)会对其中PAHs 的生物有效性及毒性产生影响.因此,在进行具体土壤生态风险评估或制定普适性土壤标准时,需综合考虑土壤理化性质的影响[22].
本研究以白符跳(Folsomia candida)为研究对象,参照ISO 国际标准方法指南[23],以个体水平的死亡率和繁殖率作为测试终点,选用我国15 种具有一定代表性且理化性质差异明显的土壤作为供试土壤,以外源添加不同含量Phe 的染毒方式,研究白符跳的毒性阈值并建立基于土壤理化性质的毒性预测模型,以积累和完善PAHs 的毒性数据,为我国PAHs 土壤生态基准和生态筛选值的制定提供依据和参考.
1 材料与方法
1.1 供试土壤
选取并采集了理化性质不同的15 种表层(0~20 cm)农田土壤作为供试土壤,分别为山东潮土(SDC)、宁夏灰钙土(NXH)、湖北水稻土(HBS)、山西大同栗钙土(SXL)、重庆紫色土(CQZ)、广东红壤(GDH)、河南潮土(HNC)、河北潮土(HBC)、云南黄红壤(YNH)、吉林黑土(JLH)、江苏水稻土(JSS)、海南砖红壤(HNH)、江西红壤(JXH)、黑龙江黑土(HLJH)、安徽黄棕壤(AHH). 供试土壤在使用前进行预处理,自然风干后先剔除土壤中的石块与植物根系,过2 mm 筛后再测定土壤理化性质(pH 以及土壤黏土含量、有机质、铁、锰、铝含量).
具体测定方法:土壤pH 是用0.01 mol/L CaCl2按照土水比为1∶5 的条件振荡0.5 h 后采用pH 计(梅特勒-托利多FE28 -Standard)测定;土壤有机质(OM)含量采用重铬酸钾容量法测定[24];碳酸钙含量采用气量法进行测定;阳离子交换量(CEC)采用EDTA铵盐法测定;土壤中铁、锰、铝含量采用湿式消解法(HF-HClO4-HNO3)测定;经草酸铵和草酸缓冲溶液提取后使用电感耦合等离子体质谱仪(ICP-MS,Agilent7500)测定土壤中非晶质氧化铁(Fe非晶质)、非晶质氧化铝(Al非晶质)、非晶质氧化锰(Mn非晶质)和晶质氧化铁(Fe晶质)的含量;土壤黏土含量使用吸管法测定.
1.2 供试白符跳
供试白符跳(Folsomia candida)由中国科学院南京土壤研究所提供,已在笔者所在课题组的实验室培养超过5 年. 参照ISO 国际标准指南[23],将白符跳饲养在特制的培养基(活性炭与熟石膏质量比为1∶9)中. 制作培养基时应在石膏凝固前用刀在其表面划出划痕,便于跳虫产卵[25]. 饲养条件使用人工气候箱(SPX-450 型,宁波赛福试验仪器有限公司)控制饲养温度为(20±1) ℃,光照与黑暗比为16 h∶8 h(光照强度为400~800 lx),空气湿度为75%. 每周补充少量干酵母两次并添加蒸馏水以保持培养基的水分含量.
正式试验中,不同白符跳的虫龄以及大小差异会对试验结果产生影响[26],因此,正式试验前需对跳虫进行同龄化培养. 将个体大小接近的成虫转移到新的培养基上产卵,幼虫孵化后移走成虫,得到10~12 d大的同龄幼虫用于毒性试验.
1.3 土壤外源Phe 添加
将称量好的Phe 标样(纯度96%)溶解在适当的丙酮溶液中,待样品充分溶解后倒入土壤中并搅拌均匀,对照组只加入丙酮. Phe 的添加量设置为10、20、50、100、200 mg/kg,外源添加Phe 后的土壤放入通风橱中稳定48 h,加入适量蒸馏水将土壤湿度调节至最大持水量的60%. 同时,以未添加Phe 的土壤作为空白对照.
1.4 白符跳毒性试验
称取30 g 外源添加Phe 的潮湿土壤于有机玻璃杯(直径8 cm,高12 cm)中,加入10 只同龄化培养的10~12 d 的跳虫,Phe 添加量范围为10~200 mg/kg,并添加一组空白对照,每个处理设置4 个重复,加入约2 mg 干酵母后加盖放入人工气候箱中培养28 d,培养条件同跳虫饲养的条件. 每3 d 开盖换气并适当补充干酵母并清理发霉的酵母,利用称重法补充去离子水以保证土壤湿度. 28 d 培养结束后将有机玻璃杯中的所有内容物倾倒于500 mL 的烧杯中,在烧杯中加入200 mL 自来水并滴入几滴蓝黑色墨水(白符跳体色偏浅色,滴入蓝黑色墨水后便于观察白符跳),利用玻璃棒由下至上轻轻搅拌,由于存活的个体表面会分泌油脂,使其可以漂浮在水面上,搅拌后静置1~2 min,待存活的成虫与幼虫浮出水面,拍照后利用Image J 软件[27]对白符跳存活和繁殖数量进行计数.
1.5 土壤中Phe 的提取与测定
基于混合有机溶剂(正己烷与丙酮的体积比为1∶1,下同)提取土壤中的Phe:土壤中Phe 的提取方法参照EPA 3545A 法[28],称取3 g 土壤样品与10 g 石英砂,混合后加入到20 mL 萃取池中. 使用混合有机溶剂,在100 ℃、120 r/min 的条件下于快速萃取仪(E916,瑞士步琦公司)中萃取10 min,每个样品萃取两次,萃取液浓缩至1 mL,经硅胶柱(SPE,上海禹熠仪器有限公司)净化后,用旋转蒸发仪浓缩至1 mL,待测.使用配备毛细管柱(30 m×0.25 mm 内径,0.25 mm 膜厚)的GC-MS(7890B-5977B 型,美国安捷伦公司)测定Phe 添加量,载气为He(纯度≥99.999%),流量为1 mL/min;进样口温度为290 ℃,接口温度280 ℃,柱温为80 ℃,以6 ℃/min 的速率升温至290 ℃,保持5 min. 定性分析采用全扫描方式,质量扫描范围为15~500 amu;定量分析采用选择性离子检测法(SIM).为保证数据质量,每10 个样品进行重复样本分析,Phe 的标记回收率为87%~115%.
基于羟丙基-β-环糊精(HPCD)提取土壤中的Phe:HPCD 提取方法参照Khan 等[29]的研究并略作修改.使用去离子水制备50 mmol/L HPCD 溶液(纯度98%,上海源叶生物科技有限公司). 称取2 g 土壤样品于离心管(n=3)中,并向每个离心管中加入25 mL HPCD溶液. 首先将离心管放置在恒温振荡器上于25 ℃、150 r/min 的条件下振荡20 h,然后以3 000 r/min 的转速离心10 min,上清液通过0.45 μm Whatman 过滤器. 从HPCD 提取物中重新提取Phe,先将10 mL HPCD 提取液与10 mL 不混溶的溶剂正己烷混合,并快速振荡30 s,然后在室温下离心. 接着向混合液中添加无水MgSO4干燥,并将干燥后获得的有机相通过0.45 μm Whatman 过滤器过滤. 有机萃取溶液在通风橱中干燥以除去有机溶剂,残留物重新溶解在1 mL甲醇中,并在HPLC 定量分析之前用甲醇进一步稀释. HPLC 分析使用安捷伦1100 系列液相色谱仪(美国)和ODS 色谱柱(Hypersil 100 mm×4.6 mm,5 μm填料);流动相为乙腈和水;进样量10 μL,柱温35 ℃,流速1 mL/min. HPLC 定量分析通过外标法定量浓度,用于色谱分析的溶剂为HPLC 级,HPCD 萃取Phe 的标记回收率为80.8%~102.6%.
1.6 数据处理与分析
本研究中Phe 对白符跳繁殖的EC50利用以下方程推导:
式中:y为不同处理浓度所对应的繁殖数量,只;x为测得的Phe 添加量,mg/kg;a为不同浓度处理的对照组中白符跳繁殖数量,只;x0为EC50值,mg/kg;b为方程拟合过程中所产生的斜率参数. 该方程的拟合利用SigmaPlot14.0 软件进行,不同土壤理化性质与Phe 毒性阈值间的相关关系利用Pearson 相关性分析确定,且Pearson 相关性分析利用IBM SPSS Statistics 软件确定.基于土壤理化性质的PAHs 对白符跳毒性阈值的毒性预测模型利用多元逐步回归分析方法建立,使用OriginPro 2018 和Excel 2018 软件进行所有图表的制作.
2 结果与分析
2.1 土壤理化性质
15 种受试土壤的理化性质如表1 所示. 由表1可见:15 种土壤中均未检出Phe;土壤pH 变化范围为5.23~9.05,其中南方红壤土(广东红壤、江西红壤、海南砖红壤等)pH 较低,普遍呈酸性,北方潮土与灰钙土(山东潮土、河北潮土、宁夏灰钙土)pH 较高,普遍呈碱性;土壤有机质含量范围为1.96~49.6 g/kg,差异较大,其中黑土与水稻土(黑龙江黑土、吉林黑土、湖北水稻土)中土壤有机质含量较高,而在潮土与灰钙土(河北潮土、山东潮土、宁夏灰钙土)中土壤有机质含量偏低;阳离子交换量(CEC)为3.61~20.6 cmol/kg;黏粒(粒径<0.002 mm)占比为5.34%~39.94%;土壤晶质铁含量为4.11~79.08 g/kg,其中红壤(海南砖红壤、江西红壤)中土壤晶质铁含量显著高于潮土(河北潮土、河南潮土、山东潮土);其他理化性质如碳酸钙含量、土壤非晶质铁(Fe非晶质)、土壤非晶质锰(Mn非晶质)、土壤非晶质铝(Al非晶质)与土壤晶质铁(Fe晶质)含量也有较大差异.
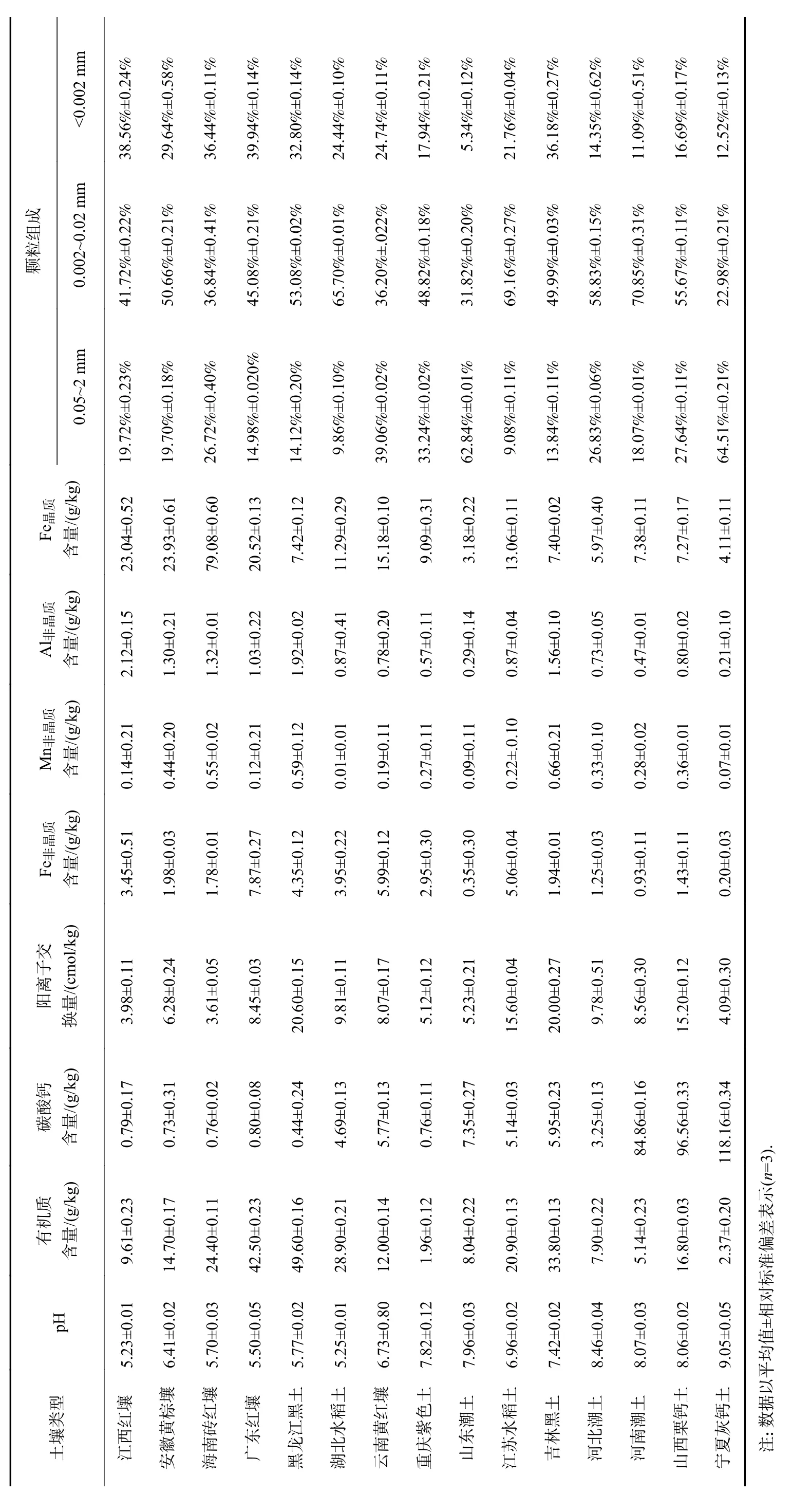
表1 15种供试土壤的理化性质Table1 The basic physicochemical properties of tested soils
2.2 不同土壤中Phe 对白符跳毒性效应和阈值的差异
对试验后存活成虫数量的统计发现,多数土壤中白符跳存活数量与Phe 添加量之间的量效关系不显著. 当Phe 添加量为200 mg/kg 时,白符跳成虫的存活与对照组差异显著的情况仅发生在有机质含量较低的土壤中,如河南潮土、河北潮土、江西红壤等,其余土壤中成虫存活数量与Phe 添加量之间未呈现明显的规律性变化. 试验28 d 后白符跳成虫的整体存活率超过50%,对照组成虫数量均超过80%,数据符合ISO 国际标准,但是数据之间变异性较大,且未呈现出显著的量效关系,无法计算Phe 对白符跳存活的LC50值,在此结果不做展示.
对试验后存活幼虫的数量统计发现,不同土壤中白符跳的繁殖率与Phe 添加量之间具有明显的量效关系(见图1). 对比不同土壤中Phe 对白符跳的毒性效应结果可以发现:两种黑土的对照组幼虫数量显著高于红壤与黄棕壤的对照组幼虫数量,这可能与较低的土壤pH 不适于跳虫生存有关. 当土壤中Phe 添加量较低时,大部分土壤中幼虫数量变幅较小;但当土壤中Phe 添加量超过50 mg/kg 时,几乎所有土壤都随着Phe 添加量增加而呈现幼虫数量明显下降的趋势,其中在山东潮土、江苏水稻土、云南黄红壤和宁夏灰钙土中幼虫数量下降趋势更加显著;在Phe 添加量达到最大值时,除黑龙江黑土、吉林黑土与广东红壤中还有部分白符跳幼虫存活外,其余土壤中只有极少量幼虫存活,且存活的幼虫也出现应激性减弱、活性差等现象. 整体而言,经28 d 的毒性试验后15 种土壤中白符跳繁殖的幼虫数量与Phe 添加量之间具有明显的量效关系,但变化趋势不同. 通过计算得出,基于混合溶剂提取的Phe 实测值推导的白符跳繁殖的EC50值范围为21.09~99.50 mg/kg,其最高值是最低值的4.72 倍(见表2).
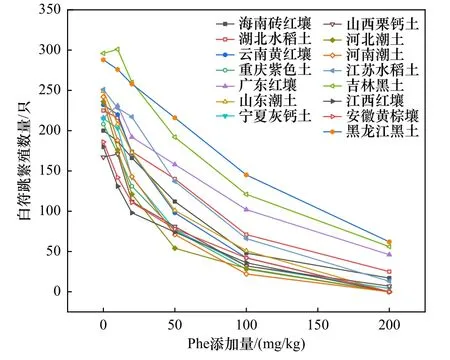
图1 暴露28 d 后不同土壤中Phe 对白符跳繁殖数量的差异Fig.1 The reproduction the number of Folsomia candida after 28 days of exposure in different soils
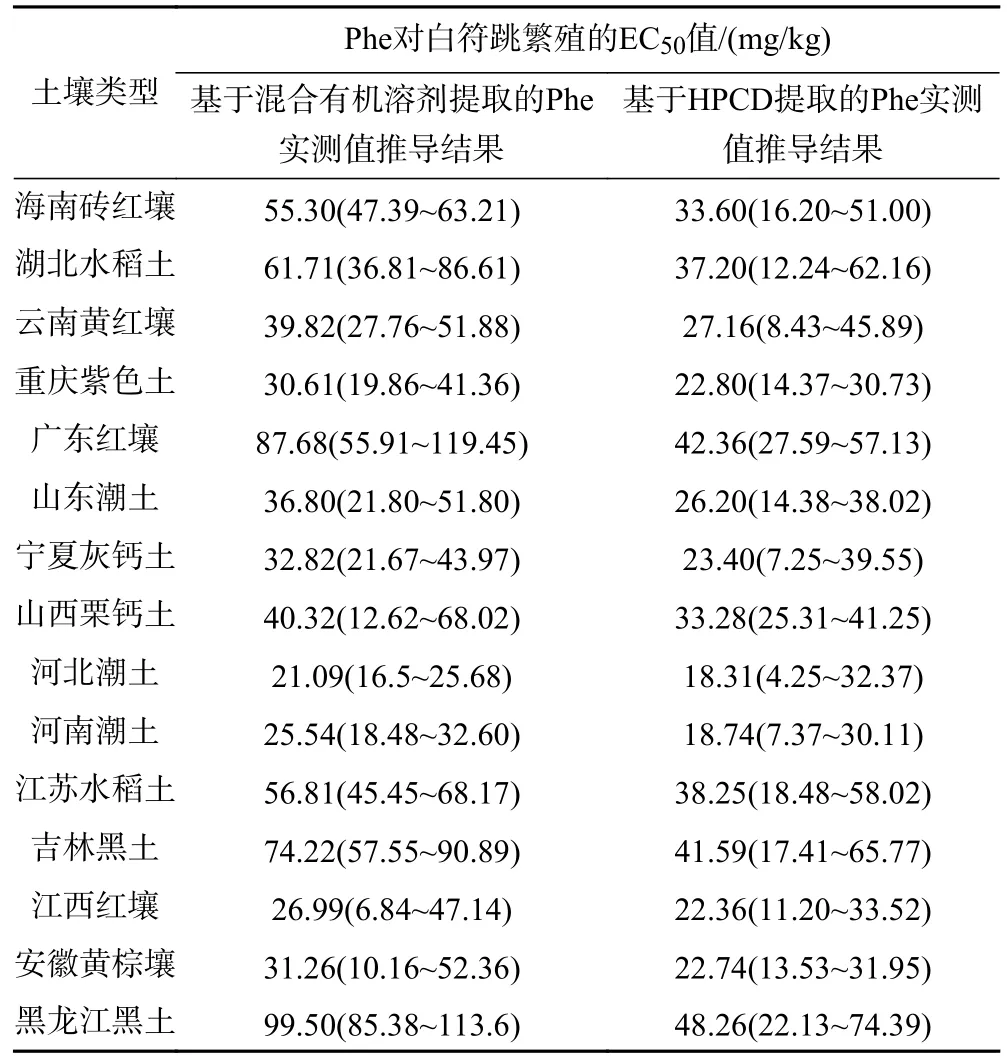
表2 基于混合有机溶剂提取的Phe 实测值和基于HPCD 提取的Phe 实测值推导的白符跳繁殖的EC50 值Table 2 The EC50 values of Phe for the reproduction of Folsomia cnadida based on mixed organic solvent extracted Phe and HPCD ertracted Phe
2.3 基于土壤理化性质的Phe 对白符跳繁殖的EC50预测模型
将表2 中基于混合有机溶剂提取的Phe 实测值推导的EC50值与土壤理化性质进行Pearson 相关性分析,发现Phe 对白符跳繁殖的毒性阈值与土壤有机质含量和土壤黏粒占比均呈显著正相关,相关系数分别为0.923(P<0.01)、0.656(P<0.05);与土壤pH 呈显著负相关,相关系数为——0.590(P<0.05). Pearson 相关性分析也表明除这3 种土壤理化性质外,基于混合有机溶剂提取的Phe 实测值推导的EC50值与其他理化性质间的相关性均未达到显著水平. 基于这3 种相关性较好的土壤理化性质,利用多元逐步回归分析方法建立毒性预测模型,在单一因子的模型构建过程中土壤有机质含量是影响Phe 对白符跳繁殖的EC50值最重要的单一因子,解释了不同土壤之间EC50值84.0%的差异(见表3). 在构建毒性预测模型的过程中也尝试将土壤黏粒与pH 这2 个因子引入,但是在建立回归方程时发现这2 个因子并不能更好地对不同土壤之间的EC50值进行解释. 基于混合有机溶剂提取的Phe 实测值推导的EC50值与利用回归模型预测的EC50值之间相关性达到了R2=0.921 的水平(见图2).
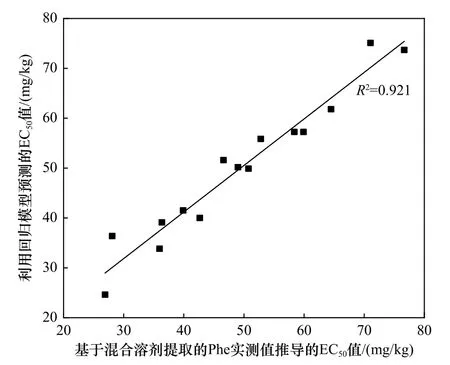
图2 基于混合有机溶剂提取的Phe 实测值推导的EC50 值与利用回归模型预测的EC50 值间的相关关系Fig.2 The correlation relationship between calculated EC50 values based on organic solvent extracted Phe and EC50 values predicted by model
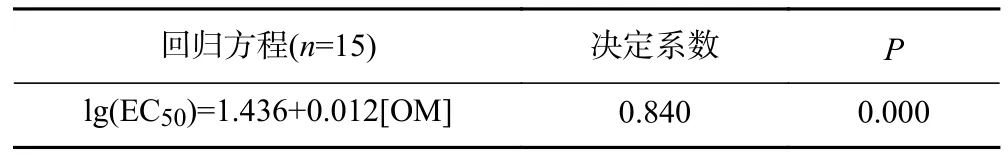
表3 基于土壤理化性质建立的Phe 对白符跳繁殖的EC50 值的预测模型Table 3 The predicting model of EC50 of Phe for the reproduction of Folsomia candida based on soil properties
3 讨论
污染物对生态受体的毒性阈值大小与选取的评价终点有关[30-31]. 有研究表明暴露时间和暴露浓度会对白符跳的生存产生影响,并会使产卵发生延迟[22],因此在白符跳毒性阈值研究中常使用存活率和繁殖率作为评价终点. 本研究表明,在所有受试土壤中白符跳的存活率与Phe 的添加量之间均无明显的量效关系. 然而以繁殖率为评价终点,土壤Phe 对白符跳的毒性阈值具有更好的指示效果,这与其他针对重金属与农药等污染物对白符跳的毒性阈值的研究结果一致[32-34]. 究其原因可能是:①白符跳在面对恶劣环境时,会放弃其他行为优先适应环境,维持自身生存,导致其存活率受污染物浓度的影响灵敏性较差;②白符跳的弹跳性较强,在面对毒性胁迫时,部分跳虫会选择爬至玻璃器皿的壁上以躲避毒性胁迫,而不能移动的虫卵则更容易受到污染物的毒性影响[32]. 因此,本研究主要以繁殖率为评价终点,探究土壤理化性质与白符跳繁殖的EC50值之间的关系.
研究发现,土壤理化性质会影响有机污染物在土壤中的生物有效性[35]. PAHs 在土壤中的生物有效性主要与分配在孔隙水中的PAHs 浓度和残留在土壤颗粒表面弱吸附态的PAHs 浓度有关,而Khan 等[29]的研究结果显示,HPCD 提取的土壤中PAHs 值更接近存在于土壤孔隙水中和弱吸附态的PAHs 浓度,因此在不同土壤中Phe 对白符跳繁殖的EC50差异与不同土壤中利用HPCD 提取的Phe 的实测值有关. 由图3 可见,在有机质含量高的土壤(黑龙江黑土、广东红壤、吉林黑土等)中,利用HPCD 提取的Phe 的实测值较低,而在有机质含量低的土壤(重庆紫色土、江西红壤、河南潮土与河北潮土等)中,利用HPCD提取的Phe 的实测值较高. 本研究发现,不同土壤中Phe 对白符跳繁殖的EC50值差异明显. 由于白符跳在土壤中受到污染物毒害作用主要是通过皮层接触与摄食这两种方式[36],因此土壤中对白符跳产生毒害作用的主要是白符跳能够接触到的孔隙水中的Phe,因此Phe 对白符跳繁殖的EC50值的差异主要与固液分配中分配到孔隙水中的Phe 浓度有关. 基于HPCD 提取的Phe 实测值推导的EC50值与基于混合有机溶剂提取的Phe 实测值推导的EC50值的最大值与最小值的比值由4.72 降至2.63,表明利用HPCD 提取的Phe 的实测值可以在一定程度上解释不同土壤中Phe 对白符跳繁殖的EC50值的差异,这与Cui 等[37]的研究结果一致.
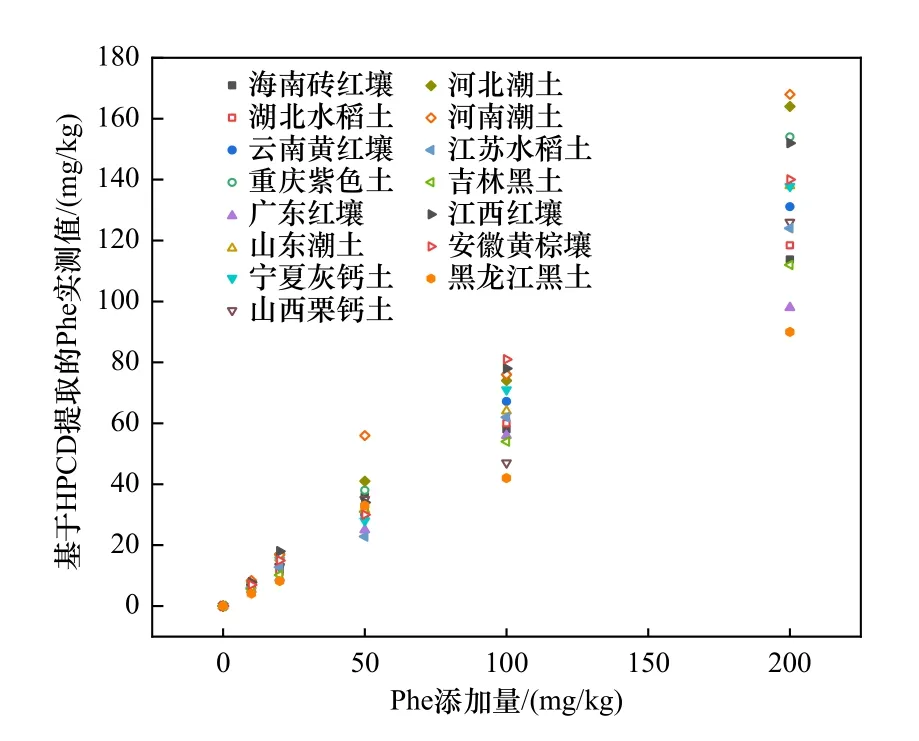
图3 不同土壤中基于HPCD 提取的Phe 实测值与Phe 添加量的关系Fig.3 Relationship between the measured values of Phe extracted from HPCD and the amount of Phe added in different soils
本研究构建的基于土壤理化性质的Phe 对白符跳繁殖的EC50值的预测模型中,除土壤有机质含量、pH、土壤黏粒含量外,其他土壤理化性质对土壤Phe毒性的贡献在统计学上均不显著,所建立的模型P值均大于0.05. 其中土壤有机质含量是预测我国不同理化性质土壤中Phe 的EC50值的最重要的单一因子,可以解释不同土壤中EC50值84.0%的差异. 已有研究[38]表明,土壤有机质含量是影响疏水性有机污染物在土壤中环境行为与生物有效性的一个重要因素.PAHs 是类疏水性有机物,进入土壤后,土壤会对其产生吸附作用,致使一部分Phe 进入土壤有机质内部,无法与土壤生物接触,从而导致其生物有效性降低.这种吸附作用有两种机理[39]:①有机质对污染物的溶解作用,疏水性有机物在进入土壤环境后会在固相与水相之间进行分配,一部分疏水性有机物会分配在固相(即土壤有机质)中;②土壤矿物质的表面吸附作用主要是氢键、配位键及偶极键等化学键力的作用结果.其中,由于矿物组分表面是极性的,易与水分子作用形成吸附水膜,因此矿物组分对有机污染物的吸附以物理吸附为主,与土壤有机质相比起次要作用. 除有机质含量外,颗粒大小也是影响有机污染物生物有效性的重要因素[40],土壤颗粒的粒径越小,则其比表面积越大,吸附能力越强. 如黄擎等[41]的研究指出,Phe在有机矿质复合体上的吸附量随粒径的减小而增大.蔡婷等[42]的研究表明,当土壤有机质含量>10 g/kg 时,土壤有机质是疏水性有机污染物的主要吸附剂,对吸附起主要作用;而当土壤有机质含量<10 g/kg 时,土壤黏粒对吸附会起到重要作用,对吸附污染物产生与土壤有机质类似的影响. 本研究使用的15 种典型土壤绝大部分土壤有机质含量远超过10 g/kg,因此在本研究结果中不同土壤的EC50值与土壤有机质含量展示出比土壤黏粒更高的相关性. 此外,土壤pH 也会对Phe 在土壤中的生物有效性产生影响,这可能是在不同pH 下,土壤腐殖质的组成(即胡敏酸、富里酸、胡敏素的含量)不同,进而导致其吸附性能不同[43-44],并且Phe 在土壤中主要与土壤有机质组分(腐殖质)结合,而腐殖质一般带负电,低pH 有助于Phe 吸附在腐殖酸等复合体上,从而降低PAHs 在水溶液中的分配比,进而减少对跳虫的毒性影响.
目前,虽然国外已有部分学者开展了关于PAHs对土壤白符跳毒性阈值的研究[27],并推导了相关生态基准:美国EPA 针对超级基金场地风险评估要求,建立了以保护与土壤发生接触或以土壤中生物质为食的生态受体的土壤生态筛选值体系,其中低分子量PAHs 生态筛选值为29 mg/kg[45];荷兰通过计算土壤污染对食品安全、生态风险和人体健康的环境风险值构建土壤质量标准,其中Phe 基于生态学的风险干预值为31 mg/kg[46];澳大利亚国家环境保护委员会建立了以保护土壤动物为目的的土壤质量指导值,其中萘(NaP)的指导值为68 mg/kg[47]. 但由于土壤理化性质的巨大差异,导致基于国外土壤建立的毒性阈值数据和预测模型无法直接应用到我国. 因此,本研究建立的基于我国典型土壤中Phe 对白符跳的毒性阈值和基于理化性质建立的毒性阈值预测模型将有助于健全与完善我国土壤PAHs 的生态基准值.
4 结论与展望
a) 15 种典型土壤中Phe 对白符跳繁殖的EC50值范围为21.09~99.50 mg/kg,平均值为48.03 mg/kg,与美国等国家制定的筛选值相近.
b) 15 种典型土壤中Phe 对白符跳繁殖的EC50值差异明显,不同土壤中EC50值最高值是最低值的4.72 倍,基于HPCD 提取的土壤中的Phe 实测值在一定程度上解释了不同受试土壤之间的毒性差异.
c) 根据毒性预测模型显示,土壤有机质含量是影响不同土壤中Phe 对白符跳EC50差异的最重要的单一因素,可解释不同土壤中EC50值84.0%的差异.
d) 本研究仅针对白符跳这一单一物种进行了Phe 的生态毒性阈值研究,后续可以结合针对蚯蚓、线虫等其他土壤无脊椎动物的研究,并结合土壤类型、环境因素、生态风险等指标,参照其他国家制定的生态筛选值,制定我国以保护土壤无脊椎动物为目标的Phe 的生态筛选值.

