捕蝇草花粉活力及柱头的可授性研究
许 凤,张艺萍,赵阿香,侯家娥,朱会宣,蒋亚莲*
(1.云南省农业科学院 花卉研究所/国家观赏园艺工程技术研究中心/云南省花卉育种重点实验室,云南 昆明 650200;2.滇西科技师范学院,云南 临沧 650500)
捕蝇草属(DionaeaJ)为茅膏菜科(Droseraceae)下的一个单种属,该属只有捕蝇草(Dionaea muscipula)一个种,自1760年首次被发现后,经芽变与品种间杂交,截至2019年,在国际食虫植物协会登记的捕蝇草品种有130个[1]。捕蝇草的捕虫夹能散发出含有果香和花香成分的气味,以此吸引飞虫,一旦被吸引来的猎物触碰到捕虫夹内的刚毛,捕虫夹就会闭合,这样昆虫和其他小猎物就被沦为了捕蝇草的食物[2];早在18世纪70年代时,达尔文便在其专著《Insectivorous Plants》中描述了捕蝇草的捕食现象,并称之为世界上最奇妙的植物之一[3]。捕蝇草的叶瓣和叶柄在充足光照下会变为红色或紫红色而具有很强的趣味性和观赏性,因而成为近几年兴起的家庭趣味性小盆栽植物之一。
杂交育种是新品种选育的重要手段之一,而花粉活力及柱头的可授性直接影响着其授粉的成功率[4]。因此,对捕蝇草花粉活力及柱头的可授性进行准确、有效的检测,是保证捕蝇草育种工作顺利开展的重要前提,对育种具有重要的指导意义。目前,对捕蝇草的研究主要集中于繁育、栽培、捕虫机理等方面[5-11],因此,笔者分析了不同品种捕蝇草的花粉活力、花粉离体萌发条件、柱头可授性,旨在为捕蝇草杂交育种提供科学依据,同时也为捕蝇草人工种子繁殖提供技术支持。
1 材料与方法
1.1 材料
试验于2022年5—8月在云南省花卉育种重点实验室进行。以大嘴、锯齿、巨夹、23号捕蝇草4个捕蝇草品种为供试材料,比较了这4个品种的花粉萌发率。另外,选取大嘴捕蝇草(图1)作为花粉离体萌发培养条件、培养基成分及柱头可授性研究的供试材料。试验所用的捕蝇草材料均来源于云南省农业科学院花卉研究所植物工厂。

1.2 方法
1.2.1 花粉的采集 选取生长状况良好、无病虫害并显色的花蕾,于晴天上午9:30~11:30用镊子采集花粉,放入干净的培养皿中,并带回实验室,待散粉时开展试验。
1.2.2 花粉活力的测定方法 (1)TTC染色法。参照赵统利等[12-13]的方法,用不同浓度(0.5%、1.0%、2.0%)的TTC染色液对捕蝇草花粉于35 ℃下分别染色30或50 min,然后镜检观察,红色的花粉粒表示有活力,淡红色或无色的花粉粒表示活力低或无活力。
(2)I2-KI染色法。参照詹妮等[14]的方法,将捕蝇草花粉用I2-KI染液,于室温下分别染色20、40 min,然后镜检观察。其中,活力强的花粉粒呈蓝色,活力弱的花粉粒呈黄褐色,无活力的花粉粒不着色。
(3)孢粉染色法。参照陈家瑞等[15-16]的方法,于30 ℃恒温箱内,反复将捕蝇草花粉用孢粉染液,黑暗条件下染色30、60 min后镜检观察。有活力的花粉细胞质被染成红色,无活力的花粉细胞壁被染成绿色。
(4)离体萌发法。参照杜玉虎等[17-18]的方法,以BK培养基为基本培养基,分别添加不同浓度的MES、蔗糖、硼酸,于恒温培养箱内培养1~4 h后,统计其花粉萌发率,花粉管长度超过花粉直径的1/2时即视为萌发。
1.2.3 花粉萌发的单因素试验 以BK(B3HO30.3 g/L+MgSO42 g/L+KCl 0.08 g/L+CaCL20.6 g/L+肌醇1.8 g/L+MES 1.07 g/L+蔗糖200 g/L)为基本培养基,设置不同pH值(5.0、5.5、6.0、6.5、7.0、7.5)、不同温度(20、25、30、35 ℃)、不同培养时间(1.0、2.0、3.0、4.0 h)分别进行单因素试验(表1)。通过比较不同条件下的花粉萌发率来确定最佳的萌发条件,并在此基础上测定一天之中不同时间段的花粉活力。

表1 单因素试验设计
1.2.4 花粉萌发的培养基组分正交试验 根据1.2.3单因素试验的结果,设置MES、蔗糖、硼酸共3个因素,每个因素设置4个水平,进行正交试验(表2),每个处理设3次重复。

表2 正交试验因素及水平
1.2.5 不同采集时间对捕蝇草花粉活力的影响 在同一天的9:00~11:00、11:00~13:00、13:00~15:00、15:00~17:00等4个不同时间段内分别采集大嘴捕蝇草花粉,并置于最佳培养条件和最优培养基中进行培养,检测同一天内捕蝇草花粉活力的变化。
1.2.6 不同捕蝇草品种花粉活力的比较 结合最佳培养条件和最优培养基,对大嘴、锯齿、巨夹、23号4个捕蝇草品种的花粉活力进行比较。
1.2.7 花粉萌发率的测定与统计分析 在Leica DM6000体式显微镜(目镜10×,物镜4×)下观察捕蝇草花粉粒着色及萌发情况。每个处理设3次重复,每个重复制备3个玻片,每个玻片随机取3个不重复的视野,每个视野观察不少于30粒花粉,统计每个视野内萌发花粉粒数和总的花粉粒数,并计算花粉萌发率,计算公式为:
捕蝇草花粉萌发率(%)=染色或萌发的花粉数/花粉粒总数×100%。
1.2.8 捕蝇草柱头的可授性观察 采用联苯胺—过氧化氢法,观察大嘴捕蝇草的柱头可授性[17-22]。在捕蝇草花蕾显色后,取不同株的花序对其进行挂牌观察,发现捕蝇草的单朵花期为7 d。因此,自花蕾显色后于每天9:00~11:00取样并观察其柱头活力,连续取样和观察7 d。
2 结果与分析
2.1 捕蝇草花粉活力不同检测方法的比较
如图2所示,所有经0.5%、1.0%、2.0% TTC溶液染色后的花粉均变为红色;所有经I2-KI染色后的花粉均呈黄褐色或者黄色,未见蓝色、蓝黑色花粉粒;孢粉染液染色后,所有花粉都呈紫红色,未见花粉壁为绿色的花粉粒。由此可见,TTC、孢粉染色法虽然能使捕蝇草花粉粒染色,但不能精确地反映花粉的活力状况,而离体萌发法可以准确地显示捕蝇草花粉的活力状况。
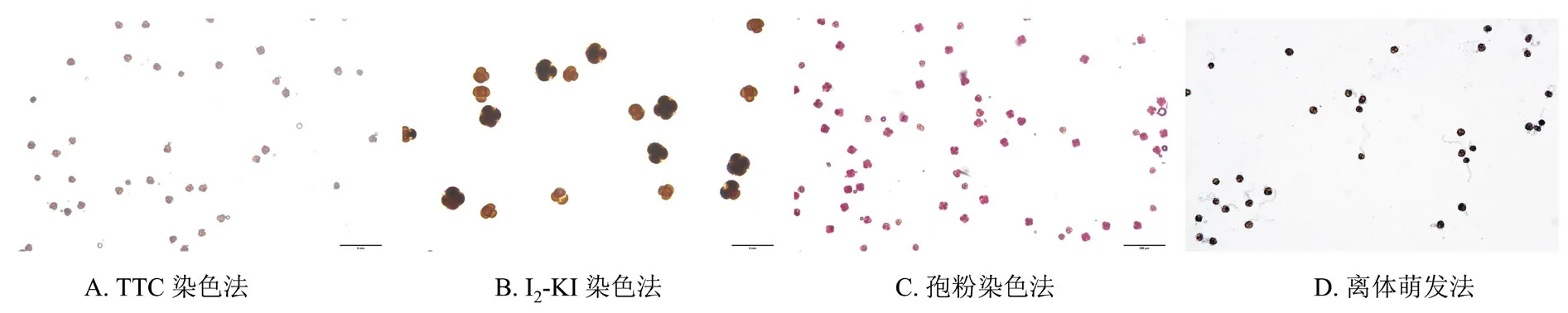
图2 不同测定方法下捕蝇草花粉活力的镜检结果
2.2 不同培养条件对捕蝇草花粉萌发率的影响
2.2.1 pH值对捕蝇草花粉萌发率的影响 在温度30 ℃、培养3 h的条件下,设置pH值5.0、5.5、6.0、6.5、7.0、7.5共6个梯度进行试验。由图3可知:当pH值为5.0时,花粉萌发率最高,达到了60.58%;随着pH值的升高,花粉萌发率则不断下降。因此,pH值较低时有利于捕蝇草花粉的萌发。进一步的方差分析发现,pH值与捕蝇草花粉萌发率呈极显著正相关(P<0.01)。
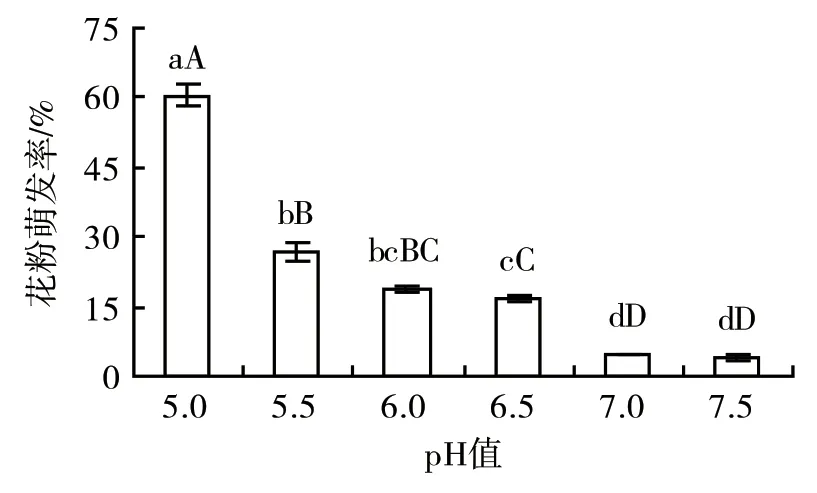
图3 不同pH值对捕蝇草花粉萌发率的影响
2.2.2 培养温度对捕蝇草花粉萌发率的影响 在pH值6.5、培养时间3 h的条件下,设置20、25、30、35 ℃等4个温度梯度进行单因素试验。由图4可知,当温度为30 ℃时,捕蝇草的花粉萌发率最高,为15.75%。进一步的方差分析结果表明,不同培养温度处理之间的捕蝇草花粉萌发率差异极显著(P<0.01)。
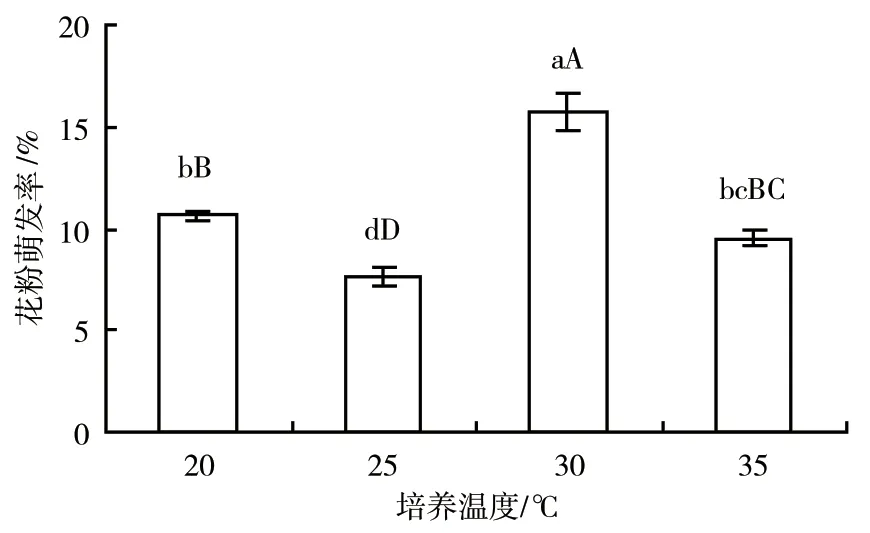
图4 不同培养温度对捕蝇草花粉萌发率的影响
2.2.3 培养时间对捕蝇草花粉萌发率的影响 在pH值6.5、温度30 ℃的条件下,将捕蝇草花粉分别培养1、2、3、4 h。由图5可知,在不同培养时长下,各处理的花粉萌发率无显著差别,只是花粉管随时间的延长而伸长。由此可知,培养时间的长短对花粉萌发率无明显的影响。
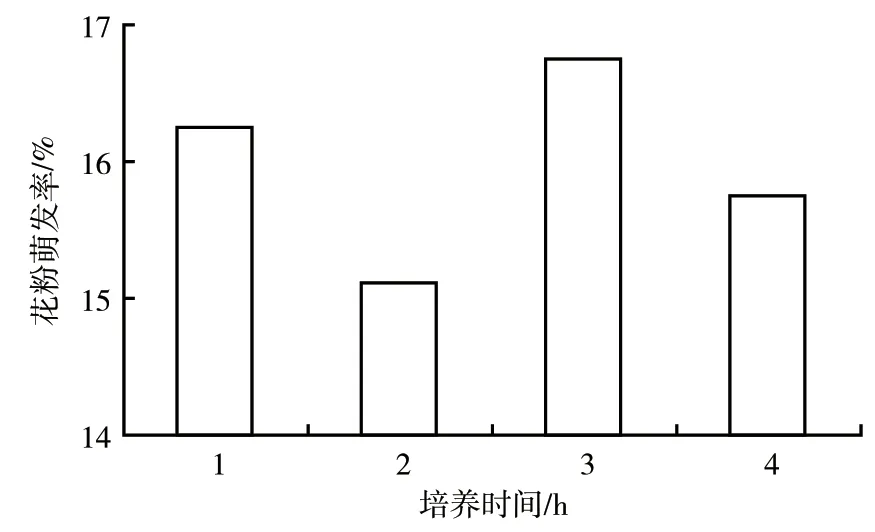
图5 不同培养时间对捕蝇草花粉萌发率的影响
2.3 培养基组分对捕蝇草花粉萌发率的影响
从表3可以看出,RC>RB>RA,说明硼酸、蔗糖和MES对捕蝇草花粉萌发率的影响程度表现为硼酸>蔗糖>MES;从K1、K2、K3、K4值的大小可以得出培养基组分的最佳组合为A4B3C2,即B3HO30.1 g/L+MgSO42 g/L+KCl 0.08 g/L+CaCL20.6 g/L+肌醇1.8 g/L+MES 3.0 g/L+蔗糖100 g/L,且该组合也在正交设计表中,因此,采用该培养基所培养的大嘴捕蝇草的花粉萌发率最高,为62.23%。在该培养基中萌发的花粉粒的花粉管几乎全为双花粉管,少数会出现3根花粉管;A3B2C4组合培养的捕蝇草的平均花粉萌发率最低,仅为 5.32%。

表3 L16(43)正交试验设计表及捕蝇草花粉萌发率的统计分析结果
进一步的方差分析结果表明,B、C因素对花粉萌发率的影响达到极显著水平(P<0.01),A因素对花粉萌发率的影响达到显著水平(P<0.05),说明硼酸、蔗糖和MES均对捕蝇草花粉的萌发率有影响(表4)。

表4 不同培养基组分的方差分析结果
2.4 不同捕蝇草品种花粉萌发率的比较
采用筛选出的实际最佳培养基组合,即0.1 g/L硼酸+2 g/L硫酸镁+0.08 g/L氯化钾+0.6 g/L氯化钙+1.8 g/L肌醇+3 g/L MES+100 g/L蔗糖,对4个品种捕蝇草的花粉萌发率进行检测,结果表明:4个捕蝇草品种的花粉萌发率间存在极显著差异,其中大嘴捕蝇草的花粉萌发率达到了62.14%,而锯齿捕蝇草和23号捕蝇草的花粉萌发率分别仅为2.60%和4.04%(图6)。
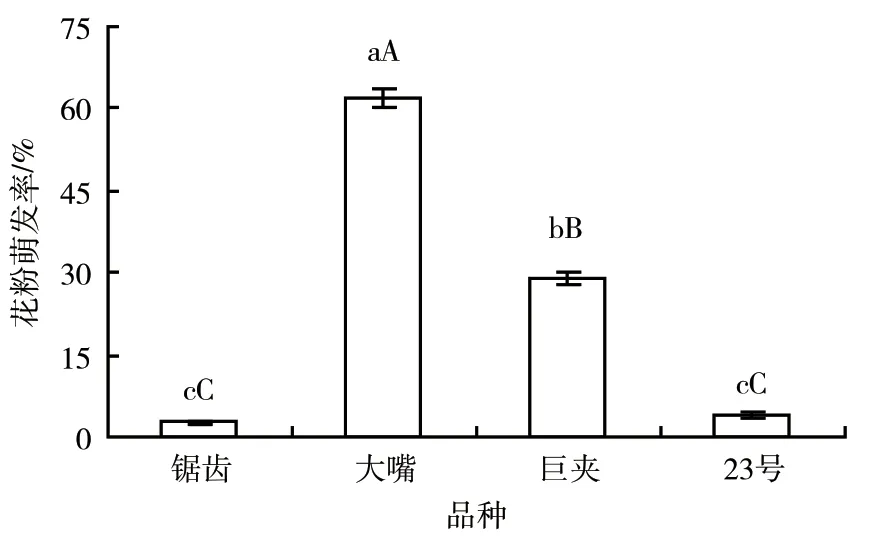
图6 不同品种捕蝇草花粉萌发率的比较
2.5 取样时间对捕蝇草花粉萌发率的影响
以大嘴捕蝇草为试验材料,在同一天的9:00~11:00、11:00~13:00、13:00~15:00、15:00~17:00 这4个时间段内采集花粉进行培养。由图7可知,在9:00~11:00这一时间段的花粉萌发率高达51.83%。进一步的方差分析结果显示,不同取样时间的捕蝇草花粉萌发率的差异达到极显著水平(P<0.01)。

图7 不同取样时间对捕蝇草花粉萌发率的影响
2.6 捕蝇草柱头的可授性
捕蝇草花朵在未开至开放及凋谢的过程中,柱头的形态呈阶段性的变化(表5)。利用联苯胺—过氧化氢法测定柱头的可授性可知,当小花未开花、开花第1天、开花第2天时的柱头直立,直至开花第3天,柱头逐渐弯曲,呈“γ”状;柱头的可授性从开花第2~第7天呈现出先增强随后减弱的趋势,第4~第5天最强,且柱头的形状从“γ”状慢慢变成“羊角状”(图8)。

图8 不同开花时间的柱头形态

表5 捕蝇草的柱头可授性与柱头形态
3 结论与讨论
3.1 捕蝇草花粉活力的测定
杜文文等[16]采用4种方法检验了30种秋海棠的花粉活力,发现TTC、I2-KI染色法均不能使花粉粒染色,离体培养后也不会萌发,而用孢粉染色法能很好地区分有活力或败育的花粉。本研究也采用这4种方法测定了捕蝇草花粉活力,结果表明:3种染色法虽然都能使花粉染色,但是不能准确地区分有活力或败育的花粉;而在培养基培养下捕蝇草花粉能萌发并长出花粉管,这表明离体萌发法是测定捕蝇草花粉活力最有效的方法。
花粉萌发需要在一定的环境条件下才能进行。王晓庆等[23]研究发现,当温度为25 ℃时,早生新水梨花的萌发率提高了53%。同时,段青等[24]研究发现,当pH值6.0、培养温度25 ℃时,大丽花花粉的萌发率明显提高,培养时间2.5 h时花粉管明显伸长。本研究通过单因素试验得出pH值5.0、培养温度30 ℃的条件适合于捕蝇草的花粉萌发,而培养时间的长短对花粉萌发率的影响不明显。本试验对pH值设置了6个梯度,但未进行更低pH值的试验,下一步拟开展pH值<5.0条件对捕蝇草花粉萌发率影响的比较试验。
在优化的条件下,以BK培养基为基本培养基,探讨了硼酸、蔗糖和MES对捕蝇草花粉萌发率的影响,结果表明其花粉萌发率依次表现为硼酸>蔗糖> MES。BK培养基中还含有其他的营养元素,对花粉的萌发也起到了一定的作用,但考虑到因素过多而使得分析变得复杂,本试验只选取了硼酸、蔗糖、MES这3个主要的因素进行试验。
在优化的培养基中,对4个品种的捕蝇草的花粉活力进行测定,结果表明:各品种之间的花粉萌发率存在显著差异,大嘴捕蝇草的花粉萌发率高达62.14%,而锯齿捕蝇草和23号捕蝇草的花粉萌发率分别仅为2.60%和4.04%,说明捕蝇草花粉萌发的培养基具有特异性。
赵剑颖等[25]研究发现,万寿菊的花粉活力在一天之中表现为先升高后降低的趋势,其中在11∶00 ~13∶00之间的花粉活力最高。本研究发现捕蝇草花粉活力在一天之中呈现下降的趋势,以9∶00~11∶00时捕蝇草花粉活力最高,为51.83%,该时间段适合进行捕蝇草杂交授粉。
3.2 捕蝇草柱头的可授性
捕蝇草柱头形态与可授性密切相关,未开花的柱头无可授性;当柱头开始从中间分叉时,柱头开始具有可授性,柱头的可授性可保持5 d;当柱头的分叉向外卷曲为“羊角状”时,柱头则会失去可授性。联苯胺—过氧化氢法被普遍认为是检测柱头可授性的可靠方法[25-28],然而对于捕蝇草来说,柱头需要较长的时间才能被染上棕色而不是蓝色,但仍会产生气泡。因此,在本研究中以产生气泡的多少来确定捕蝇草的柱头活力的强弱。

