精神分裂症患者APOE和SLCO1B1基因多态性分析*
邓顺顺,吴文峰,黄志强,赵 峰,高永双
1.中山市第三人民医院检验科,广东 中山 528400;2.中山市第三人民医院精神科, 广东 中山 528400
精神分裂症是一种临床常见的慢性严重性精神疾病,该疾病严重影响患者的精神和生活状态,目前临床上治疗主要以非典型抗精神病药物治疗为主[1],有些患者病情迁移,需要终身服药。在临床治疗过程中,非典型抗精神病药物的使用常常引起精神分裂症患者糖脂代谢异常,从而增加了心血管疾病的发生[2]。有研究发现精神分裂症患者在接受抗精神病药物治疗前会表现出较高比例的代谢异常[3]。钟远惠等[4]对780例长期住院治疗的精神分裂症患者进行调查后发现,患者发生代谢综合征的比率为35.9%。目前国内研究中关于非典型抗精神病药对精神分裂症患者血糖及泌乳素的影响尚无统一的结论[5]。精神分裂症患者发生心血管疾病的风险也比普通人群高,是导致患者寿命缩短的主要原因之一,且精神分裂症患者较普通人群更易出现血脂异常[6]。在治疗过程中,患者易发生代谢综合征,糖脂代谢分泌紊乱将导致机体发生一系列机能变化,降低患者的生活质量[7]。通过对患者进行APOE和SLCO1B1基因检测,其结果可以给予临床医生在降血脂用药方面的指导,便于对不同基因型的患者进行个体化用药,从而达到更好的治疗效果。本研究旨在分析精神分裂症患者人群APOE和SLCO1B1基因多态性分布情况,从遗传因素方面了解该类人群发生代谢紊乱和使用他汀类药物的风险情况,现将报告结果如下。
1 资料与方法
1.1 一般资料
选取2020 年10 月—2021 年6 月中山市第三人民医院确诊为精神分裂症的95例患者作为研究对象。其中:女性40 名,平均年龄(40±15)岁;男性55 名,平均年龄(36±11)岁。本研究经过中山市第三人民医院医学伦理委员会审核通过,研究对象均确诊为精神分裂症且无合并其他精神类疾病的患者,患者均充分了解了本次研究的内容,并签署了知情同意书。
1.2 方法
1.2.1 标本采集与保存 患者于晨起(6:00—7:00),采取坐位,空腹采集研究对象静脉血5 mL,置于紫色EDTA-K2 抗凝管中,采用3 300 r/m 转速离心10 min,待血浆与细胞层充分分离后,用加样枪吸取细胞层及以下部分分装于刻度冻存管中,按实验收集的患者编号做好标记,保存于-80 ℃冰箱中。
1.2.2 APOE 和SLCO1B1 基因检测 待标本收集整理完成后,将标本通过冷链运输至广州金域检验中心,进行他汀类药物基因APOE 和SLCO1B1 荧光PCR 基因多态性位点检测。分别检测SLCO1B1*1B 基因rs2306283 位点;SLCO1B1*5 基因rs4149056 位点;APOE 基因rs429358 和rs7412两个位点。待出具检验检测报告后,根据基因位点检测的结果分别进行基因型分类,其中SLCO1B1基因包括*15/*15、*1a/*15、*1a/*1a 、*1a/*1b 、*1b/*15、*5/*5、*5/*15、*1a/*5和*1b/*1b 9个基因型;APOE基因包括ε2/ε 2、ε2/ε3、ε3/ε3、ε3/ε4、ε2/ε4和ε4/ε4的6个基因型。
1.3 统计学方法
采用SPSS 20.0 软件进行统计分析,计数资料以频数和百分比(%)表示,采用χ2检验分析各基因型是否符合Hardy-Weinberg 遗传平衡,以P>0.05 表明符合。组间采用χ2检验比较不同性别各基因型间,以P<0.05 为差异有统计学意义。
2 结果
2.1 患者APOE基因多态性分布及Hardy-Weinberg遗传平衡检验情况
患者APOE基因型分布频率以ε3/ε3为主,占60%,其次为ε2/ε3 占18.95%和ε3/ε4,占15.79%,ε2/ε4 和ε4/ε4 基因型患者较少,分别占4.21%和1.05%,本次实验组中未检测到ε2/ε2基因型患者。精神分裂症患者APOE基因多态性位点突变频率预期值均符合Hardy-Weinberg 遗传平衡(P>0.05),提示该样本来自同一总体,具有群体代表性,见表1。

表1 患者APOE基因分布及Hardy-Weinberg遗传平衡检验情况 例(%)
2.2 患者SLCO1B1 基因分布及Hardy-Weinberg 遗传平衡检验情况
患者SLCO1B1 基因型分布频率以*1b/*1b 为主,占35.79%,其次为*1a/*1b 占30.53%和*1b/*15,占18.95%,然后是*1a/*15 占7.68%,*1a/*1a 占4.88%,*15/*15 占3.16%。本次实验组中未检测到*5/*5、*5/*15 和*1a/*5 三种基因型。精神分裂症患者SLCO1B1基因多态性位点突变频率预期值均符合Hardy-Weinberg 遗传平衡(P>0.05),见表2。

表2 患者SLCO1B1基因分布及Hardy-Weinberg遗传平衡检验情况 例(%)
2.3 精神分裂症患者不同性别间APOE 基因多态性分布情况
精神分裂症患者不同性别间APOE 基因多态性分布频数,差异无统计学意义(P>0.05),见表3。
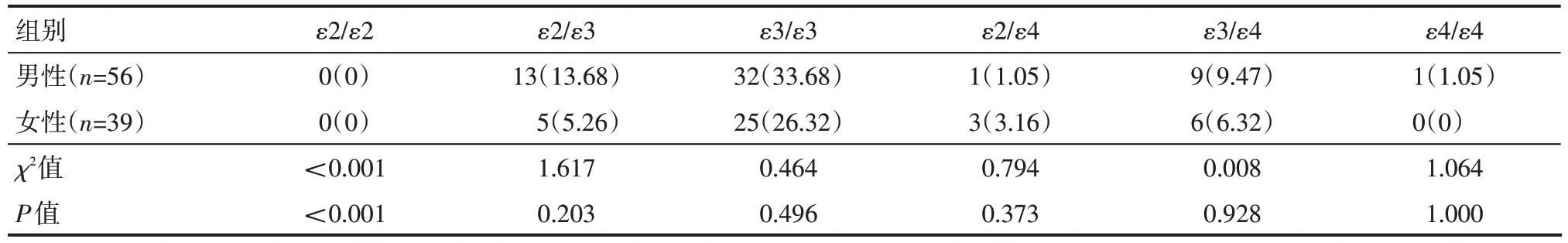
表3 精神分裂症患者不同性别间APOE基因多态性分布情况 例(%)
2.4 精神分裂症患者不同性别间SLCO1B1 基因多态性分布情况
精神分裂症患者不同性别间SLCO1B1基因多态性分布比较,差异无统计学意义(P>0.05),见表4。
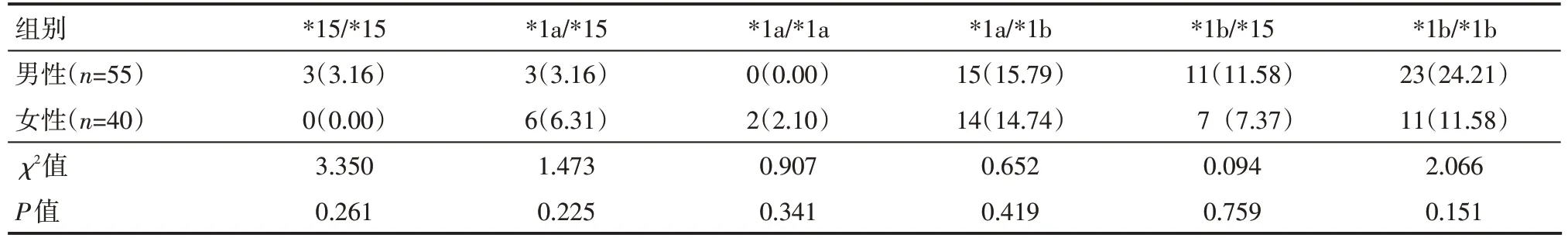
表4 精神分裂症患者不同性别间SLCO1B1基因多态性分布情况 例(%)
3 讨论
他汀类药物是3-羟基-3-甲基戊二酰辅酶A 还原酶抑制剂,是胆固醇合成的限速酶,能在一定程度上降低TG,升高HDL,能有效地降低TC 和LDL,而且是目前临床首选的最有效也是较全面的调脂药物[8]。在精神分裂症患者出现血脂代谢异常时,亦可选择他汀类药物进行治疗。但他汀类的疗效及安全性存在较大的个体差异[9],他汀类药物的疗效存在个体差异且可能会导致严重的不良反应,如肝功能紊乱、肌肉肌病和横纹肌溶解症等[10]。由于他汀类药物在肝脏中由有机阴离子转运多肽1B1 蛋白(OATP1B1)转运,其不良反应的发生也被证实与SLCO1B1 基因多态性有关[11]。通过基因检测可指导临床医生选择适合患者的他汀类药物,并给予合适的剂量,对高脂血症患者进行个体化治疗具有重要的指导作用[12]。SLCO1B1基因多态性证实与不同种族人群血脂异常水平有关[13]。国内外多项研究亦显示SLCO1B1和APOE基因多态性对多种他汀类药物的药物代谢动力学及药效学产生显著影响[14]。SLCO1B1和APOE基因多态性已被证实与多种他汀类药物的疗效及安全性相关,他汀药物的个体化应用在中国人群中尤为重要[15]。
APOE 基因的多态性影响脂质的吸收、转化与清除的过程。WEI 等[16]通过对中国人群载脂蛋白E 基因多态性与他汀类药物疗效关系的Meta分析,发现载脂蛋白E基因多态性与他汀类药物疗效相关。APOE和SLCO1B1的单核苷酸多态性(SNP)是导致他汀类药物的安全性和疗效个体差异的关键因素,两种基因的SNP使他汀类药物在肝脏代谢和转运的遗传特性不同,从而影响他汀类药物的血浆及肝脏浓度[17]。APOE 基因主要有两种单核苷酸多态性,形成E2、E3、E4三种单倍型。APOE基因多态性是影响机体血脂水平,特别是血清胆固醇水平的重要因素之一[18]。对于ε2 等位基因携带者,他汀类药物具有较好的降脂效果,而对于ε4等位基因携带者作用则相反[19]。
研究[20]表明,当SLCO1B1 基因发生突变时,可能导致编码的OATP1B1 转运体活性降低,OATP1B1 为跨膜转运蛋白,具有介导肝细胞膜转运内、外源性物质并对其进行代谢和消除的生理功能,在转运他汀类、降糖药、利福平、血管紧张素Ⅱ、受体拮抗剂等药物中发挥重要的调控作用,肝脏摄取药物能力降低,导致他汀类药物血药浓度升高,增加肌病或横纹肌溶解症的风险,严重会危及生命。本研究对象中*1a/*1a、*1a/*1b和*1b/*1b基因型属于SLCO1B1I 类基因型,是正常代谢型,有63 例占68.42%;*1a/*15 和*1b/*15 基因型属于SLCO1B1Ⅱ类基因型,是中间代谢型,有27 例占28.42%;*15/*15 基因型属于SL⁃CO1B1 Ⅲ类基因型,属于弱代谢型[21],有3 例,占3.16%,这类人群他汀类药物代谢能力差,发生横纹肌溶解症或肌病的风险较高。研究对象中携带APOEE4等位基因有16 例,占16.84%。两种基因型的多态性分布与患者性别无关。已有研究证实APOE与阿尔茨海默症其他的风险因子密切相关,APOEε4 可通过与动脉粥样硬化,周围血管疾病及2型糖尿病等协同作用而增加阿尔茨海默症的发病风险[22]。
综上所述,他汀类药物常用于临床将血脂作用,在使用时可以根据SLCO1B1和APOE不同的基因型选择适宜的他汀类药物,以减少治疗过程中不良反应的发生。SLCO1B1和APOE基因检测为他汀类药物的使用和疗效预测提供分子遗传学依据,对他汀类药物的合理应用,提高其使用的有效性和安全性有极大的帮助。在采用非典型抗精神病药物治疗精神分裂症的同时要密切关注患者血脂变化,精神分裂症患者SLCO1B1和APOE基因呈现多态性分布,可以为其血脂控制及治疗等提供个体化用药指导。但患者患病风险因素不仅包括基因遗传因素,还与患者自身的身高、体重、年龄、饮食结构因素、环境因素、器官功能以及是否合并其他病症等一系列条件有关,用药前需谨慎,结合其他临床资料进行综合考虑。

