rh-ES在血管正常化时间窗内联合顺铂对小鼠Lewis肺癌移植瘤的抗肿瘤效果*
徐姝玫 严沁 李帅 黎露蔚 何朗
(1.成都中医药大学医学与生命科学学院,四川 成都 610075;2.成都市第五人民医院·成都中医药大学附属第五人民医院/第二临床医学院肿瘤科·成都市肿瘤防治所,四川 成都 611137;3.成都中医药大学,四川 成都 610075)
实体肿瘤的生长、转移、侵袭过程与血管生成密不可分[1]。 微血管密度(Microvessel denstity,MVD) 在临床上被视为评估恶性肿瘤血管生成最重要的指标,其反映的是肿瘤诱导血管的生成,一定程度上能预测肿瘤的生长、发展过程[2]。血管内皮生长因子(Vascular endothelial growth factor,VEGF)作为促血管生成因子中最关键的细胞因子,是恶性肿瘤血管新生的直接体现, 其水平高低可在一定意义上体现肿瘤细胞的活性[3]。重组人血管内皮抑素(Recombinant human vascular endostatin,rh-ES)通过与信号通路中VEGF特异性作用,阻止其与受体相互作用,抑制血管的生成,使得肿瘤细胞难以获取生长所需营养物质,进而控制了癌细胞的生长发育[4-5]。研究发现DNp73是一种抗凋亡蛋白,其具有只在癌组织中及相关血管内皮中高表达的特性,并可促进其他内皮生长因子的表达来抑制肿瘤细胞增殖[6]。故DNp73被认为是检验肿瘤血管生成的重要指标[7-8]。本实验采用第1至3天、第4至6天、第7至9天3个时间段来探讨rh-ES联合DDP化疗的最佳给药时机、抑瘤效果及可能的机制。
1 材料与方法
1.1 材料 Lewis肺癌细胞(Lewis lung cancer, LLC)购自肿瘤生物治疗国家重点实验室(四川大学),6~8周龄SPF级雌性C57/BL6体质量15~20 g的实验小鼠30只(质量合格编号:SYXK2013-076)购自川北医学院动物实验中心(动物生产许可证号:SCXK (川) 2013-18),重组人血管内皮抑素(15 mg/3 mL)购于先声麦得津生物制药有限公司(山东),SABC免疫组化试剂盒购于santa cruz,TUNEL细胞凋亡检测试剂盒购于碧云天公司(上海),二氨基联苯胺 染色剂(diaminobenzidine, DAB)购于博士德公司(武汉),青霉素-链霉素双抗购于Hyclone公司(美国),顺铂注射液(cisplatin, DDP, 10 mg/2 mL)购于个旧生物药业有限公司(云南),CD34 兔抗小鼠单克隆抗体、VEGF 兔抗小鼠单克隆抗体、DNp73α小鼠抗小鼠单克隆抗体购于迈新生物技术公司(福建)。
1.2 小鼠LLC皮下移植瘤模型的建立 将小鼠LLC皮下移植瘤模型制成1×106mL-1单细胞悬液,并取0.2 mL于每只小鼠的左侧腋下皮下注射,记录肿瘤生长、发育情况。本研究获医院伦理委员会审核通过。
1.3 实验分组及治疗 小鼠移植瘤模型建立10天后,将实验小鼠随机分为6组,每组各5只,d1表示治疗开始第1天。NS组在第1至9天小鼠予以腹腔注射生理盐水(0.2 mL/d);rh-ES组小鼠在第1至9天予以腹腔注射重组人血管内皮抑素(5 mg·kg-1·d-1);rh-ES+DDP(d1~3)、rh-ES+DDP(d4~6)、rh-ES+DDP(d7~9)组小鼠分别在第1至9天予以腹腔注射rh-ES(5 mg·kg-1·d-1),并分别于对应时间段腹腔注射顺铂(2 mg·kg-1·d-1)。
1.4 小鼠恶性肿瘤生长发育曲线 测得小鼠肿瘤长径用(a)、短径用(b)表示,按照小鼠肿瘤体积(cm3)=a×b2×0.52,横轴单位为天数(d),纵轴单位为体积(cm3),绘制曲线图。
1.5 标本的采集及处理 肺组织留取:所有小鼠均留取肺组织,肉眼观察肿瘤转移情况,使用4%甲醛溶液固定标本,大体观察、脱水、透明、包埋及制片后进行HE染色镜下观察。小鼠肿瘤标本离体30 min内置入液氮罐中,后置于超低温冰箱中保存。
1.6 免疫组化染色检测肿瘤组织中CD34及相关指标表达 免疫组化(IHC)采用SABC法进行染色。石蜡切片脱蜡,H2O2封闭,蒸馏水洗5 min,高压锅抗原修复后上摇床,PBS洗涤后血清封闭孵育1 h分别滴加CD34抗体(1∶100)、VEGF抗体(1∶100)、DNp73α(1∶50),4 ℃冰箱过夜。PBS洗涤后先后滴加生物素化的二抗及三抗,行DAB显色,镜下观察,适时终止。清水充分冲洗,苏木素复染,清水冲洗返蓝,梯度酒精脱水。阳性对照采用己知阳性切片;阴性对照用PBS液代替一抗[9]。
1.7 结果判断 ①CD34结果判断及MVD的计数:以肿瘤细胞和血管内皮细胞胞浆内出现棕黄色或褐色颗粒为CD34表达阳性。②VEGF结果判断:肿瘤细胞和血管内皮细胞胞浆内出现棕黄色颗粒为VEGF表达阳性。每张切片的阳性细胞率及阳性细胞着色强度参照Tanak的定量积分法进行分级计分,阳性细胞率即阳性细胞占肿瘤细胞的百分比例,阳性强度即阳性细胞率与着色强度的乘积。③DNp73α结果判断:DNp73α阳性表达为胞核清晰棕黄色。VEGF、DNp73α染色结果均按以下标准计分:阳性细胞比例<5%记为0分,5%~25%记为1分,25%~50%记为2分,50%~75%记为3分,>75%记为4分。显色程度未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。总分为阴性(-),2~4分为弱阳性(+),5~8分为阳性(++),9分以上为强阳性(+++)。染色结果以标记指数(labeling index, LI)记录,方法为计算1000 个在任意挑选的5个400倍视野中的肿瘤细胞的阳性细胞个数,LI=(阳性细胞数/1000)×100%。
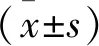
2 结果
2.1 小鼠LLC成瘤情况 接种Lewis肺癌细胞的小鼠10天后,皮下均出现质地较硬、活动度差、呈膨胀性生长的长径约6 mm的移植瘤。
2.2 移植瘤体积变化 依照前述公式计算,横轴以时间(d)为单位,纵轴以体积(cm3)为单位。6组小鼠肿瘤体积随实验进行逐渐增长,NS组肿瘤体积生长最快,rh-ES +DDP(d4~6)组肿瘤体积增长最慢,试验结束时NS组、rh-ES 组、DDP组、rh-ES +DDP(d1~3)组、rh-ES+DDP(d4~6)组、rh-ES +DDP(d7~9)组皮下移植瘤体积分别为(5.69±0.80)mm3、(4.95±0.52)mm3、(3.92±0.37)mm3、(3.53±0.44)mm3、2.02±0.32)mm3、(3.69±0.40)mm3。rh-ES+DDP(d4~6)组肿瘤体积与其余5组比较差异有统计学意义(P<0.05),见图1。
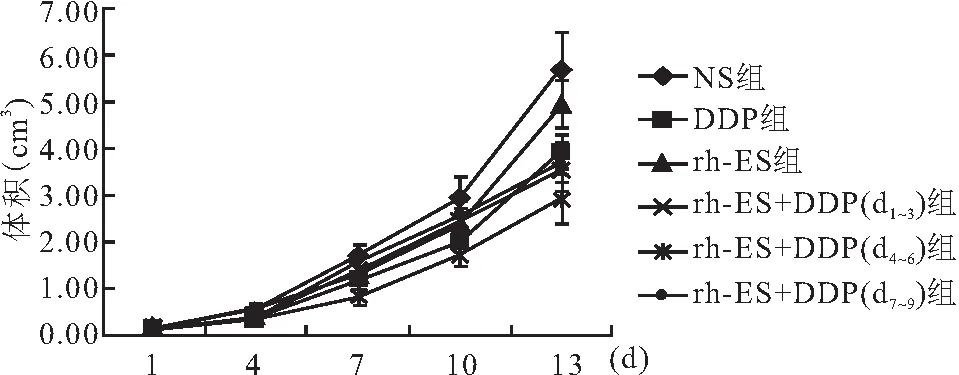
图1 小鼠肿瘤体积变化曲线图
2.3 6组肺转移瘤情况 小鼠肺组织中可见细胞核深染、核分裂象多见的肿瘤细胞。肿瘤周围毛细血管丰富。HE染色切片显示,除rh-ES +DDP(d4~6)肺转移瘤相对较少外,其余各组均可明显见到转移瘤细胞,NS组最为明显,见图2。
2.4 6组CD34及MVD表达状况 CD34阳性区域癌巢中央少见,周围分布较广,瘤内微血管形态欠规则,个别呈蔟状,见图3。通过计数,NS组、rh-ES组、DDP组、rh-ES +DDP(d1~3)组、rh-ES +DDP(d4~6)组、rh-ES +DDP(d7~9)组MVD分别为(28.56±6.55)、(25.32±5.04)、(24.10±4.28)、(17.50±3.12)、(8.32±1.48)和(19.06±3.58)。各联合组MVD均较单药组减少,以rh-ES+DDP(d4~6)组减少最明显(P<0.05),见图4。
2.5 VEGF检测的免疫组化(IHC)结果 IHC显示,NS组中VEGF在肿瘤中的表达LI明显高于其他各组(P<0.05),见图5。rh-ES组、DDP组、rh-ES +DDP(d1~3)组、rh-ES+DDP(d4~6)组以及rh-ES +DDP(d7~9)组5组间比较,rh-ES+DDP(d4~6)组的VEGF表达率最低(P<0.05),见图6。
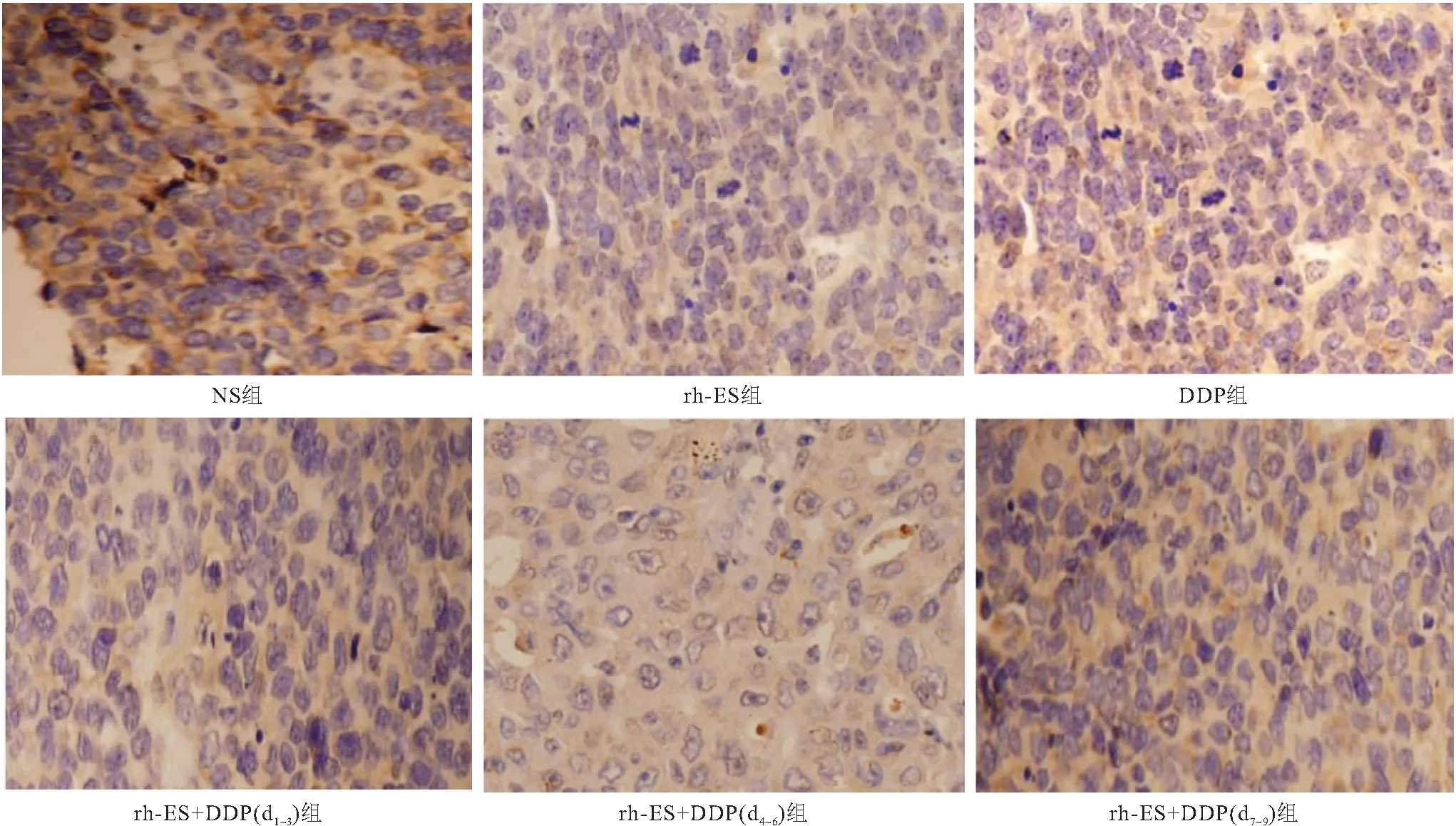
图5 6组VEGF表达情况 (IHC,400×)
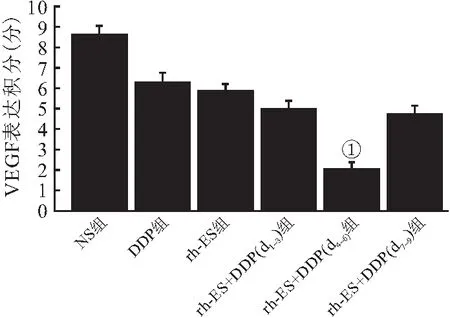
图6 6组VEGF的表达积分
2.6 IHC检测肿瘤新生血管标志物DNp73α的结果 各组按预定时间处死小鼠行肿瘤标本IHC检测DNp73α。结果发现,NS组、rh-ES组、DDP组、rh-ES+DDP(d1~3)组、rh-ES +DDP(d4~6)组及rh-ES +DDP(d7~d9)组DNp73α表达率分别为(80.65±3.36)%、(73.47±3.69)%、(78.12± 3.98)%、(60.89±4.01)%、(30.42±3.02)%和(54.18±3.68)%,rh-ES+DDP(d4~d6)组DNp73α表达显著低于另5组,差异有统计学意义(P<0.05),见图7、8。
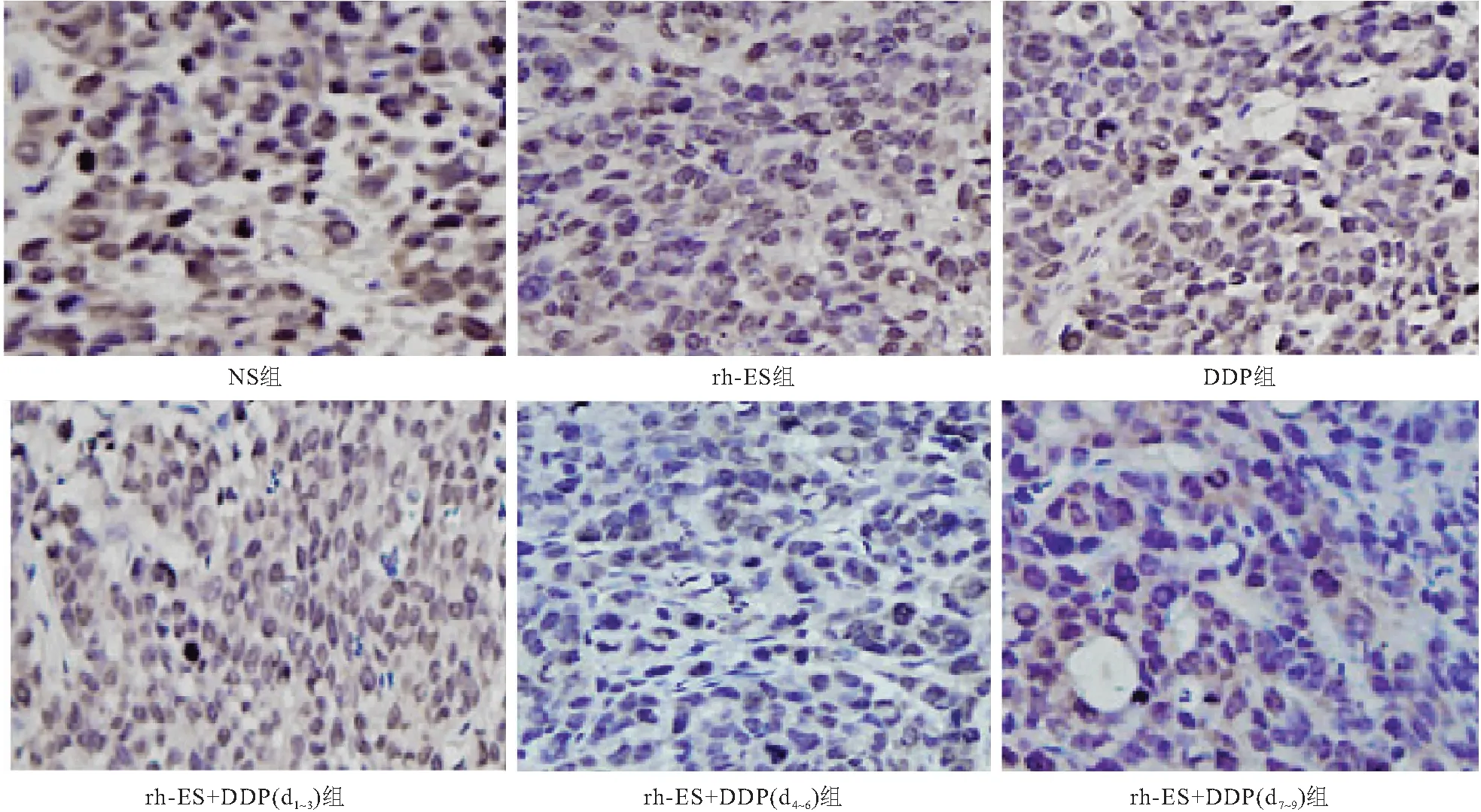
图7 6组DNp73α表达情况(IHC,400×)
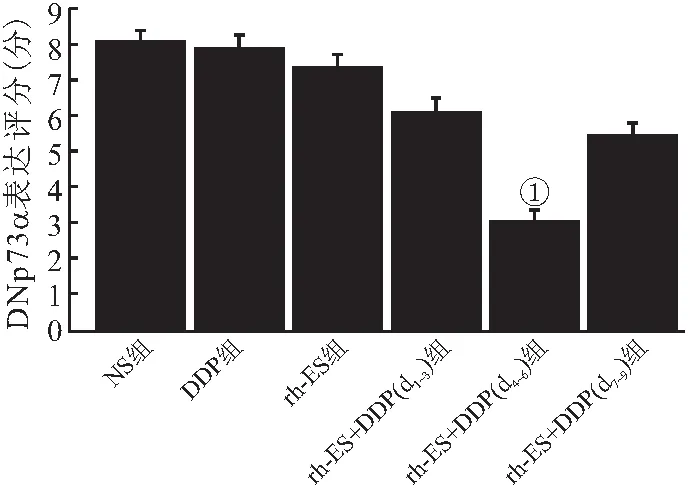
图8 6组DNp73α表达评分
3 讨论
肿瘤微生态系统理论认为肿瘤细胞的生物学行为是肿瘤微生态系统重建其系统内营养联系的结果,而肿瘤的血管化是其重建营养联系的一种表现。人体内血管生成受到复杂的控制系统调控,在正常人体内血管生成促进因子和血管生成抑制因子受到严格的调控,保证体内血管生成维持在一种受控制的动态平衡状态。但在肿瘤患者体内这一平衡被打破,促血管生成因子明显增多,尤其VEGF使肿瘤组织内新生血管生成呈不受控制、无序的生长状态。血管内皮生长因子及血管内皮生长因子受体(Vascular endothelial growth factor receptor,VEGFR)所介导的信号通路是其中最重要的调节通路,通过旁分泌途径进行联合调控,若此动态平衡失衡,肿瘤将脱离休眠状态[10]。
重组人血管内皮抑素是在内皮抑素(Endostatin,ES)于N-端附加9个氨基酸序列而合成,相比于ES,rh-ES具有更高的稳定性,更长的半衰期和更多的作用靶点,通过抑制VEGF及VEGFR的结合,阻断信号通路的激活,特异性的抑制内皮细胞活性,从而使肿瘤血管生成减少,降低MVD[11]。根据血管正常化时间窗理论:运用抗血管生成药物后,肿瘤内部结构、功能紊乱的血管将在一段时间内趋于正常化,这一时间段即为血管正常化时间窗[12]。在该时间窗内, 肿瘤紊乱的血管结构得到纠正、血管基底膜增厚、血管周细胞覆盖率增加,肿瘤乏氧细胞比例降低,对放、化疗敏感性提高,可最大程度发挥化、放疗的抗肿瘤疗效[13-14]。血管正常化时间窗理论已得到国内外众多研究支持[15-16]。不同的血管生成抑制剂具有不同的血管正常化窗口期,是否所有的血管生成抑制剂在血管正常化期间联合用药均能达到增强疗效的作用,仍不明确。因此,验证rh-ES在时间窗内联合用药是否有效提高化放疗疗效对指导临床合理、规范用药具有重要意义。本研究结果显示,rh-ES +DDP(d4~6)组小鼠肿瘤体积最小、增长速度最慢,肿瘤坏死最明显,肺转移瘤也最少(P<0.05)。说明rh-ES联合DDP于第4至6天对肿瘤抑制作用最强,此时期是抗肿瘤作用的最佳时相,是肿瘤血管正常化窗口期。
CD34是稳定的血管内皮细胞标记物之一,能准确反应MVD数量,肿瘤组织内CD34明显增高,已有研究证实VEGF与MVD具有明显相关性[17]。rh-ES通过抑制VEGF等促血管生成因子作用,而减少肿瘤新生血管形成,降低MVD,抑制肿瘤细胞增殖[18]。本研究发现VEGF与MVD在各联合治疗组中的表达均较单药治疗组减少,尤其在rh-ES +DDP(d4~6)组,VEGF与MVD表达率均明显降低,且显著低于其他治疗组(P<0.05)。
p53 是经典的肿瘤抑制因子,其突变频率是抑癌基因中最高的基因之一[19-20]。p73 已被鉴定为肿瘤抑制蛋白 p53 的结构和功能同源物,其具有一个内在的 P2 启动子,剪切生成N-端缺失的蛋白DNp73α。由于氨基末端反式激活结构域的截短,DNp73α表达通常与对细胞凋亡和治疗的抗性有关[21-22]。已有研究发现,DNp73α在肺癌、乳腺癌、食管癌等肿瘤血管内皮中高表达,正常人体组织中几乎不表达[23]。DNp73α也是肿瘤中VEGF表达和有效血管形成的重要调节因子,可能与肿瘤的发生发展密切相关[24-25]。目前国内外关于DNp73α与新生血管关系的研究甚少,本研究通过对肿瘤标本行IHC检测DNp73α,结果发现rh-ES各联合组DNp73α表达均较单药组减少,以rh-ES +DDP(d4~6)组的 DNp73α表达率最低(P<0.05)。说明rh-ES联合治疗可通过抑制DNp73α的表达来抑制内皮细胞增殖,降低微血管通透性,从而改善肿瘤微环境,增强细胞毒药物的抑瘤效果。DNp73α的促瘤作用可能通过上调VEGF的表达来抑制肿瘤血管内皮细胞凋亡和促进肿瘤细胞增殖,而rh-ES能够抑制VEGF高表达[26]。因此,结合本实验结果表明,rh-ES可通过抑制DNp73α和VEGF的高表达促使内皮细胞凋亡,抑制肿瘤细胞增殖,联合顺铂化疗时,在rh-ES作用后的第4天至6天时期达到高峰。
4 结论
在rh-ES使用后第4天至6天血管正常化窗口期加用顺铂能增强抑瘤疗效,其可能的机制之一是通过抑制DNp73α、VEGF的表达,降低肿瘤微环境内微血管密度而增强化疗药物疗效。

