髓芯减压联合VEGF与胶原基骨移植材料对兔股骨头缺血坏死的修复作用*
吕亚军 任立中 李军 张海静 张志坤
(河北医科大学第一医院骨二科,河北 石家庄 050031)
股骨头坏死(Osteonecrosis of femoral head,ONFH)致残率高,严重影响患者的生活水平[1-3]。股骨头发生缺血性坏死后,骨组织表现为血管再生、新骨形成和死骨吸收[4-5]。然而,随着ONFH疾病的进展,血管再生和新骨形成减弱,而死骨吸收增强[6]。髓芯减压已广泛应用于ONFH的治疗,可降低骨内压力,延缓坏死进程[6]。髓芯减压所形成的空腔通常需要植骨来完成。胶原基骨修复材料是利用仿生原理由低结晶度纳米级羟基磷灰石与胶原通过物理方法自组装而成,该成分与天然骨的成分几乎完成吻合[7- 8]。胶原基骨修复材料具有诱导骨髓间充质干细胞向成骨细胞分化的能力及无免疫原性、可降解、易塑形等特性,在骨修复过程中起骨诱导,加快骨愈合的作用[7]。血管再生在骨形成和骨改建过程中至关重要[9]。血管内皮生长因子(Vascular endothelial growth factor,VEGF)是最重要的血管生成因子,具有促进血管内皮细胞分裂及血管生成等作用[9-10]。VEGF通过直接吸引内皮细胞和破骨细胞,促进成骨细胞的分化,在骨再生过程中对骨形成和修复至关重要[10-12]。本实验以兔为研究对象,向股骨头注入无水乙醇方法构建股骨头坏死模型,采用髓芯减压联合VEGF与胶原基骨移植材料治疗兔股骨头坏死,研究VEGF、胶原基骨修复材料对股骨头坏死区域骨修复的影响,探索应用髓芯减压联合VEGF与胶原基骨移植材料治疗股骨头坏死的新领域。
1 材料与方法
1.1 动物 24只6月龄SPF级家兔购自河北医科大学实验动物中心,雌雄不限,合格证号为SCXN(冀)2013-1-003,体质量(2.21±0.29)kg。家兔饲养在12∶12 h的光明-黑暗周期中,室温设定为25 ℃,相对湿度设定为60%,不限制进食和饮水。本研究已获得医院伦理委员会通过。
1.2 动物模型的建立 参考文献[13]中的方法建立ONFH兔模型。腹腔注射50 mg/kg戊巴比妥钠麻醉兔,将兔俯卧位固定,剃毛,消毒,铺巾。在大转子外侧剪开皮肤和筋膜,分离肌肉,在X线引导下,经股骨头穿刺、克氏针扩髓,然后将无水乙醇1 mL (0.1 mL/min)缓慢注射至股骨头中心(图1)。医用骨蜡封闭皮质骨孔洞,逐层缝合。6周后进行CT扫描,CT检查中根据是否观察到股骨头坏死、骨密度增高、股骨头外形改变等特征来判断建模结果(图2)。

图1 ONFH家兔建模的X线片

图2 建模6周后的CT图像
1.3 动物分组和治疗 将24只家兔随机分为模型对照组(A组)、髓芯减压+自体松质骨组(B组)、髓芯减压+胶原基骨修复材料组(C组)和髓芯减压+胶原基骨修复材料+VEGF组(D组),每组6只,按照相应的治疗方法对家兔进行分组治疗。腹腔注射50 mg/kg戊巴比妥钠麻醉兔,将兔俯卧位固定,在大转子外侧剪开皮肤和筋膜,分离肌肉,在X线引导下,用19G骨穿针经皮从大转子处钻入股骨头区,然后进行药物治疗。B、C和D组家兔均进行髓芯减压治疗,在此基础上,B组在股骨头减压区植入自体松质骨,C组在股骨头减压区植入胶原基骨修复材料(天津市赛宁生物工程技有限公司,国械注准20143461867),D组在股骨头减压区植入胶原基骨修复材料的基础上,注入600 μg/kg的VEGF蛋白(上海沪震实业有限公司)。采用医用纤维蛋白胶封堵钻孔。手术后,家兔每日肌肉注射10万U青霉素,连续3 d,以防止感染。
1.4 Western blot检测蛋白水平 治疗12周后,麻醉动物,用空气栓塞法处死动物,并取出股骨头,用预冷的DEPC水冲洗,将每个股骨头用组织研磨机将股骨头在液氮中粉碎,在RIPA(美国Thermo Fisher公司)中4 ℃孵育30 min。裂解产物随后在15000 g、4 ℃下离心10 min。通过BCA法测量总蛋白质浓度。用12% SDS-PAGE(碧云天生物技术研究所)对蛋白质电泳90 min。然后,将蛋白质转移到PVDF上,将膜用5%脱脂乳室温下封闭1 h。然后将膜与VEGF(1∶1000稀释)、Collagen I(1∶1000稀释)、RUNX2(1∶2000稀释)、OCN(1∶1500稀释)、Wnt-3a(1∶1000稀释)、β-catenin(1∶2000稀释)、GSK-3β(1∶2000稀释)和β-actin(1∶2000稀释)一抗在4 ℃孵育过夜。然后将膜与山羊抗兔IgG H&L(HRP)二抗(1:1000稀释)室温孵育1 h。抗体均购自英国Abcam公司。使用增强化学发光(ECL)底物试剂盒(美国Thermo Fisher公司)显影。在Image J软件上分析蛋白质条带的灰度值。β-actin作为内参蛋白。
1.5 HE染色观察家兔股骨头组织切片形态 取股骨头用0.9%氯化钠冲洗,脱钙,切成5 mm厚的石蜡切片。进行苏木精-伊红(HE)染色(碧云天生物技术研究所),显微镜下观察切片。随机选取10个高倍视野,每个视野计数50个骨陷窝。用空骨陷窝数除以总骨陷窝数来计算空骨陷窝的比率。
1.6 骨密度分析系统(QCT PROV 6.1)测量家兔股骨头的骨密度 采用荷兰飞利浦 Incisive 64 排CT扫描后,应用曼德思维软件公司的骨密度分析系统(QCT PRO V6.1)测定并分析骨密度(BMD)。
2 结果
2.1 4组家兔的一般情况 本研究过程中无家兔死亡。A组家兔精神萎靡不振,行动迟缓,皮毛无光泽,皮下脂肪减少,弹跳能力降低。B、C和D组家兔精神状态较A组改善,活动灵敏度增加,皮毛呈现光泽,其中D组家兔的一般情况优于其他组。
2.2 4组家兔股骨头组织病理学形态 HE染色结果显示,A组出现典型的骨坏死,坏死区域位于松质骨和软骨下区域,骨髓结构紊乱,骨髓细胞坏死,碎片聚集,普遍观察到脂肪生成,脂肪细胞数量和大小增高,骨小梁变薄,可见大量空隙;与A组相比,B、C和D组骨髓结构紊乱较轻,骨小梁增厚,可见蓝染的再生软骨,空隙较少,脂肪细胞数量减少,空腔数量减少;与B、C组比较,D组骨小梁排列较整齐,骨髓中观察到大量微血管的形成,可见明显成骨,且坏死区基本被修复,见图3。4组空骨陷窝的比率比较差异有统计学意义(F=58.475,P<0.001);与A组相比,B、C和D组家兔股骨头空骨陷窝的比率均降低(P<0.05);D组家兔股骨头空骨陷窝的比率小于B、C组(P<0.05),见图4。
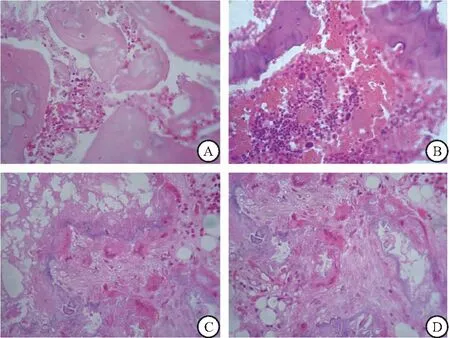
图3 股骨头组织苏木精伊红(HE)染色图(400×)
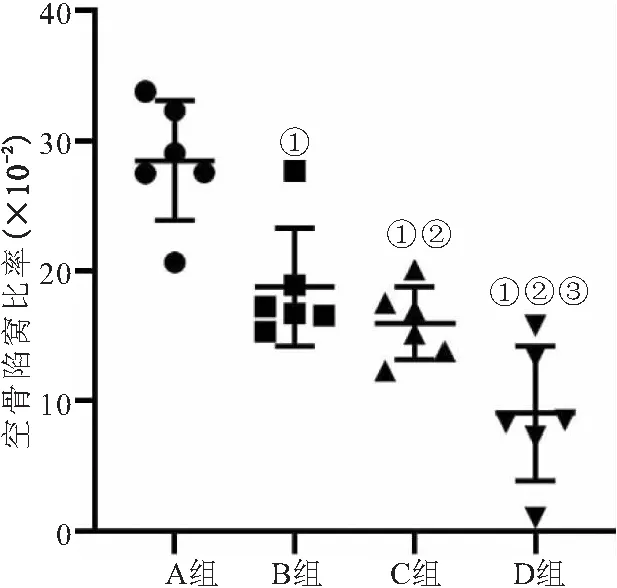
图4 4组空骨陷窝的比率
2.3 4组家兔股骨头骨密度比较 4组家兔股骨头的骨密度比较差异有统计学意义(F=98.524,P<0.001);与A组相比,B、C和D组家兔股骨头的骨密度均显著升高(P<0.05);D组家兔股骨头的骨密度显著高于B、C组(P<0.05),见图5。
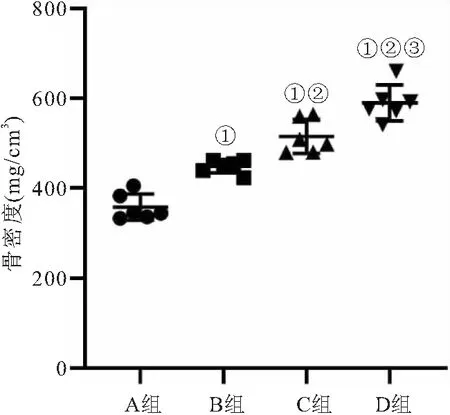
图5 4组的骨密度
2.4 4组家兔的股骨头组织中VEGF、Collagen I、RUNX2和OCN蛋白表达水平比较 Western blot结果显示,4组家兔的股骨头组织中VEGF、Collagen I、RUNX2和OCN蛋白表达水平比较差异有统计学意义(F分别为92.706、48.725、39.251、50.263,均P<0.05);与A组相比,B、C和D组股骨头组织中VEGF、Collagen I、RUNX2和OCN的蛋白表达水平均升高(P<0.05);D组VEGF、Collagen I、RUNX2和OCN的蛋白表达水平均高于B、C组(P<0.05),见图6。
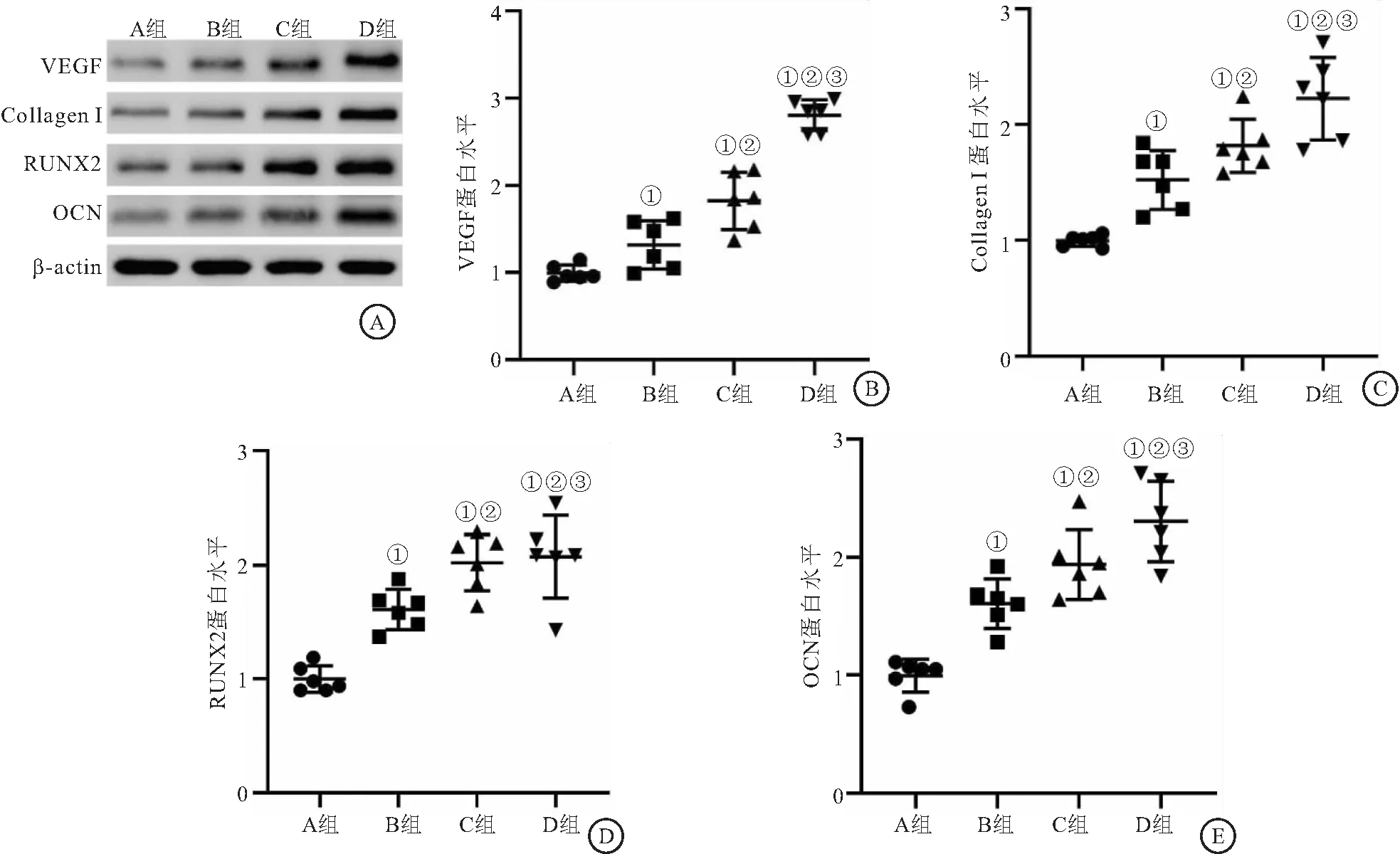
图6 4组股骨头组织中VEGF、Collagen I、RUNX2和OCN的表达
2.5 4组家兔的股骨头组织中Wnt/β-catenin信号通路相关蛋白的表达水平比较 Western blot结果显示,4组家兔的股骨头组织中Wnt-3a、β-catenin和GSK-3β的蛋白表达比较差异有统计学意义(F分别为138.292、395.503、223.654,均P<0.05);与A组相比,B、C和D组股骨头组织中Wnt-3a和β-catenin的蛋白表达水平均显著升高,GSK-3β降低(P<0.05);D组Wnt-3a和β-catenin的蛋白表达水平均显著高于B、C组,GSK-3β低于B、C组(P<0.05),见图7。
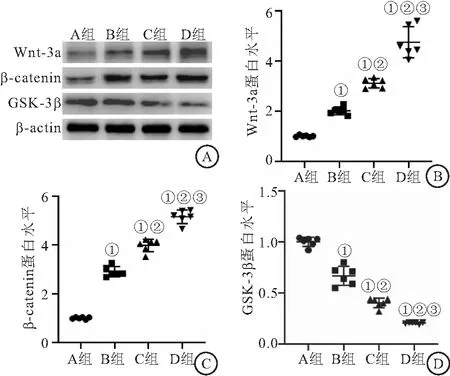
图7 4组股骨头组织中Wnt-3a、β-catenin和GSK-3β的表达
3 讨论
在股骨头坏死早期机械性破坏发生前,通过髓芯减压同时去除坏死骨组织已经成为一种广泛认可的治疗方法[6]。然而,髓芯减压所形成的空腔,通常需要植骨来完成。胶原基骨修复材料是利用仿生原理由低结晶度纳米级羟基磷灰石与胶原通过物理方法自组装而成,该成分与天然骨的成分几乎完成吻合。胶原基骨修复材料具有诱导骨髓间充质干细胞向成骨细胞分化的能力及无免疫原性、可降解、易塑形等特性,在骨修复过程中起骨诱导,加快骨愈合的作用。
VEGF能作用于血管内皮细胞并促进其增殖和血管生成[14]。血管再生参与骨形成和骨改建过程[15-16]。骨折愈合过程中,血管再生可促进新骨形成[17]。Gerber等[18]研究表明阻断内源性VEGF活性,骨形成与骨吸收就停止。Midy等[19]报道,VEGF能直接刺激成骨细胞碱性磷酸酶(Alkaline phosphatase,ALP)活性,并促进成骨细胞的迁移与分化。胶原基骨修复材料有以下优势:①通过生物酶定向酶切技术,产品无任何排异发生。②具有贯通性良好的孔隙率和多尺度孔径,可充分保证血液在其中的流动以及细胞的迁徙与附着。③能够提高自体诱导的效果和材料在骨重建中的再利用。④参与骨重建的过程完全与机体自身的骨愈合周期吻合,能确保骨组织按人体自身实际需要准确地完成全部自诱导过程,不出现异常刺激。⑤可任意塑形,根据需要无缝隙完成填充,不遗留残腔。⑥作为水溶性(非油性)可塑型材料,具有更高的安全性。本课题组采用了一种髓芯减压联合VEGF与胶原基骨移植材料的综合疗法来治疗无水乙醇骨内注射诱导的兔股骨头坏死模型,结果显示,髓芯减压联合VEGF与胶原基骨移植材料治疗12周后的家兔身体状态最佳,股骨头组织病理学改变明显减轻,股骨头骨密度最高,坏死区域基本被修复,治疗效果显著优于髓芯减压+自体松质骨组和髓芯减压+胶原基骨修复材料组。说明髓芯减压联合VEGF与胶原基骨移植材料是治疗股骨头坏死的潜在高效疗法,原因可能与胶原基骨修复材料的骨诱导活性以及VEGF的促血管生成活性有密切的关系。
Collagen I、RUNX2和OCN均是与骨形成和骨重塑密切相关的蛋白质,Collagen I可影响成骨细胞的功能,参与调节人骨髓间充质干细胞骨向分化[20]。RUNX2调节成骨细胞、间充质干细胞中的相关成骨基因的转录、翻译和定向分化[21]。OCN是一种促进骨形成和矿化的骨基质蛋白[22]。本研究检测了4组家兔的股骨头组织中Collagen I、RUNX2和OCN的表达水平,结果显示,髓芯减压联合VEGF与胶原基骨移植材料最大限度的升高了股骨头组织中Collagen I、RUNX2和OCN的表达水平,提示骨形成蛋白的高表达也是该疗法发挥作用的机制之一。
Wnt/β-catenin信号通路是骨稳态的关键调节剂,该通路的激活可促进骨形成[23]。据报道,股骨头缺血性坏死中Wnt/β-catenin信号通路被抑制[24]。Wnt/β-catenin信号通路的激活可促进成骨[25]。本研究结果显示,髓芯减压联合VEGF与胶原基骨移植材料最大限度地激活了Wnt/β-catenin信号通路。
4 结论
应用髓芯减压联合VEGF与胶原基骨移植材料治疗家兔股骨头坏死具有良好的效果,可有效促进坏死股骨头的修复,提高骨密度及成骨蛋白的表达,该治疗方法可能是治疗股骨头坏死的新型高效疗法,具有较高的临床研究价值。

