发芽青稞的营养品质及降血压效果
杜 艳, 梁 锋, 李婷玉, 周文菊, 陈正行,涂兆鑫, 杨 静, 樊梅香, 李 娟*
(1. 江南大学 粮食发酵与食品生物制造国家工程研究中心,江苏 无锡 214122;2. 青海天佑德科技投资管理集团有限公司, 青海 西宁 810016;3. 青海省青稞资源综合利用工程技术研究中心, 青海 西宁 810016;4. 江南大学江苏省生物活性制品加工工程技术研究中心,江苏 无锡 214122)
青稞为禾本科大麦属的禾谷类作物,是青藏地区最主要的农作物之一, 也是青藏地区人民的主粮。 青稞营养丰富,具有“三高两低”的特点,即高蛋白质、高纤维素、高维生素、低脂肪和低糖[1]。 高血压是最常见的心脑血管疾病之一,严重危害人类的健康与生活。 我国现有高血压患者2.5~2.7 亿,且每年增加1 000 万人[2]。 研究表明,长期食用青稞及其产品,具有预防高血糖、高血脂、高血压、癌症等作用[3]。
谷物萌发是一种有效改善和增强谷物营养价值的方法。 在萌发过程中,β-葡聚糖酶、淀粉酶和谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)等酶被激活, 使γ-氨基丁酸 (γ-aminobutyric acid,GABA)、多酚、黄酮等生物活性成分大量富集[4-5]。 研究表明,GABA 可用于预防和辅助治疗高血压[6-7]。此外,有研究报道,多酚、黄酮也具有良好的降血压作用[8-9]。 作者以瓦蓝青稞为原料,以β-葡聚糖、GABA、蛋白质、淀粉、游离氨基酸、总多酚和总黄酮质量分数及相关酶的活力为指标,探究萌发对青稞营养品质的影响;并以心率、收缩压、血管紧张素等为指标考察经过萌发处理的青稞对高血压大鼠血压的影响,为探求具有一定营养性和降血压功效的食源性物质提供科学基础。
1 材料与方法
1.1 材料与试剂
瓦蓝青稞:青海天佑德科技投资管理集团有限公司产品;β-葡聚糖混联检测试剂盒: 爱尔兰Megazyme 公司产品;SPF 级雄性11 周龄原发性高血压大鼠 (spontaneously hypertensive rats,SHR,共60 只):江苏集萃药康生物科技有限公司提供(许可证号:SCXK (京)2018-0008); 血管紧张素Ⅱ(angiotensin Ⅱ,ANGⅡ)、血管舒缓激肽(bradykinin,BK)、前列环素(prostacyclin 2,PGI2)、血管生成素2(angiogenin 2,Ang2)、一氧化 氮(nitric oxide,NO)、内皮源性超极化因子 (endothelium -derived hyperpolarizing factor,EDHF):南京森贝伽生物科技有限公司产品;芦丁(rutin,RU)和没食子酸(gallic acid,GA)(纯度>95%),分析纯试剂四氢呋喃、三乙胺、盐酸、结晶乙酸钠等:国药集团化学试剂有限公司产品。
1.2 仪器与设备
BSC-250 型恒温恒湿箱:上海博讯实业有限公司医疗设备厂产品;UV-3200 型紫外分光光度计:上海美谱达仪器有限公司产品;KENT scientific CODA 无创血压仪:美国Kent 公司产品;微孔分光光度计:梅特勒-托利多国际贸易(上海)有限公司产品。
1.3 实验方法
1.3.1 青稞萌发处理 筛选适量饱满、 完整的青稞, 用体积分数0.5%次氯酸钠溶液浸泡15 min,然后用去离子水清洗3~4 次。 再用2 倍体积去离子水在15 ℃下浸泡10 h。 在托盘(40 cm×30 cm)底部铺2 层纱布,均匀铺放青稞200 g,再在上面盖2 层湿纱布。 在15 ℃、相对湿度95%的条件下萌发培养,每隔6 h 喷洒去离子水100 mL[10]。 分别在萌发12、24、36、48、60、72、84、96 h 取样,并用去离子水洗涤3 次,50 ℃灭酶处理15 min,50 ℃干燥12 h, 粉碎,过50 目筛。
1.3.2 青稞中β-葡聚糖、蛋白质、淀粉及胚乳酶活力的测定 β-葡聚糖:按照NY/T2006—2001《谷物及其制品中β-葡聚糖含量的测定》 中的方法测定;蛋白质:按照GB 5009.5—2016《食品中蛋白质含量的测定》 中凯氏定氮法测定; 淀粉: 按照GB 5009.9—2016《食品中淀粉含量的测定》中酸水解法测定;β-葡聚糖酶: 采用β-葡聚糖酶活性测定试剂盒(K-MBGL)测定;GAD:参照白青云的方法[11]测定;α-淀粉酶:采用试剂盒法(T-AMZ200)并依据Ceralpha 方法测定;β-淀粉酶: 采用试剂盒法 (KBETA)并依据Betamyl-3 方法测定;蛋白酶:按照GB 28715—2012《饲料添加剂酸性、中性蛋白酶活性的测定》中分光光度法测定。
1.3.3 GABA 和游离氨基酸测定 供试品溶液制备[10]:称取青稞粉1.0 g,加入适量体积分数5%三氯乙酸混匀, 再加适量体积分数5%三氯乙酸定容至25 mL, 室温超声提取40 min,10 000 r/min 离心10 min。 取上清液即得供试品溶液。
高效液相色谱条件[10]:色谱柱为Agilent Hypersil ODS 柱(4.0 mm×250 mm×5 μm)。流动相A(pH 7.2)为27.6 mmol/L 乙酸钠-三乙胺-四氢呋喃溶液(体积比500.00∶0.11∶2.50), 流动相B (pH 7.2) 为80.9 mmol/L 乙酸钠-甲醇-乙腈溶液 (体积比1∶2∶2),流量为1.0 mL/min。 柱温为40 ℃,检测波长为338 nm。 梯度洗脱:0 min,体积分数8% B;17.0 min,体积分数50% B;20.1 min, 体积分数100% B;24.0 min,体积分数100% A。
衍生条件:将400 μL 供试品溶液和800 μL 衍生剂在自动衍生装置中反应2 min。 GABA 质量分数以干基质量计。
1.3.4 总多酚和总黄酮测定 供试品溶液的制备:称取青稞粉2.0 g, 加入25 mL 体积分数70%丙酮溶液,混匀,超声提取120 min,4 000 r/min 离心10 min,取上清液即得供试品溶液。
总多酚测定: 吸取供试品溶液25 μL 于96 孔板中,加入体积分数10%福林酚试剂125 μL,静置10 min, 再加入125 μL 质量分数7.5% Na2CO3溶液, 避光反应30 min, 于波长760 nm 处测定吸光度。 以没食子酸为标准品绘制的标准曲线计算总多酚质量分数,结果以mg/hg 表示[12]。
总黄酮测定: 吸取供试品溶液50 μL 于96 孔板中, 加入20 μL 0.5 mol/L NaNO2溶液, 静置5 min, 再加入20 μL 0.3 mol/L AlCl3溶液, 静置6 min,再加入200 μL 0.5 mol/L NaOH 溶液,混合均匀,静置15 min,于波长510 nm 处测定其吸光度。以芦丁为标准品绘制的标准曲线计算总黄酮质量分数,结果以mg/hg 表示[13]。
1.3.5 辅助降血压活性测定
1)实验分组及饲养条件 根据青稞粉中GABA质量分数及人体推荐摄入量,发芽青稞(萌发48 h)的低、 中、 高剂量设为人体推荐食用量的5 倍、10倍、20 倍, 青稞组设为人体推荐摄入量的10 倍,同时设置维持饲料为对照组。 将青稞和发芽青稞添加到维持饲料中饲喂大鼠,大鼠自由采食,每2~3 d 对饲料进行称量。 实验周期为30 d。 饲料添加情况见表1。

表1 实验分组信息Table 1 Experimental grouping information
动物饲养管理条件: 实验动物在温度为20~26℃、相对湿度为40%~70%的江南大学实验动物中心屏障设施SYXK(苏)2016-0045 饲养。 饲料(辐照灭菌)由江苏省协同医药生物工程有限责任公司提供。
2)血压、心率测定 SHR(180~200 g)适应饲养5 d 后,多次测量其血压,使其适应测压环境。 根据测压仪的说明测定大鼠清醒和安静状态下的血压和心率。 实验开始后每周测压1 次,每次对同一只大鼠测压10~15 次,停止给予受试样品之后,持续观察7 d。3)其他指标测定 参照试剂盒说明书测定高血 压 大 鼠 血 清 中ANG Ⅱ、BK、PGI2、Ang2、NO 和EDHF 的质量浓度。
1.3.6 数据分析 采用SPSS 22.0 和Excel 2019 分析处理数据并用Origin 8.5 绘图。
2 结果与分析
2.1 β-葡聚糖、GABA 质量分数及β-葡聚糖酶、GAD 活力变化
由图1 可知,青稞中β-葡聚糖质量分数随萌发时间的延长而下降,其中β-葡聚糖质量分数在12~48 h 降解较慢(降解量在15%内),48 h 后降解速率加快。这可能与青稞萌发过程中胚乳糊粉层和β-葡聚糖酶合成的速度和活力有关[14]。 萌发0~60 h,β-葡聚糖酶的活力呈平缓的上升趋势,萌发72~96 h,β-葡聚糖酶的活力急剧上升。 随萌发时间的延长,青稞中GABA 质量分数呈先增加后减少的趋势,其中萌发48 h 时,GABA 质量分数最高。 青稞在萌发期间,蛋白酶被激活,蛋白质水解生成了谷氨酸,谷氨酸在GAD 作用下转化为GABA[15],故而青稞中GABA 质量分数增加。此外,GABA 生成与消解是一个动态平衡的过程[16],随着GABA 的积累,GAD 活力被抑制,而GABA 转氨酶的活力增强,使GABA转化为琥珀酸半醛,最终导致GABA 质量分数下降[17-18]。 GAD 活力变化与萌发过程中GABA 质量分数的变化趋势一致, 表明青稞中GABA 的增加与GAD 活力呈正相关。萌发48 h 时,青稞中β-葡聚糖质量分数为4.46%, 降解量为11.68%,GABA 质量分数为33.18 mg/hg, 是原料的3.47 倍, 因此,48 h较适合于青稞的萌发。
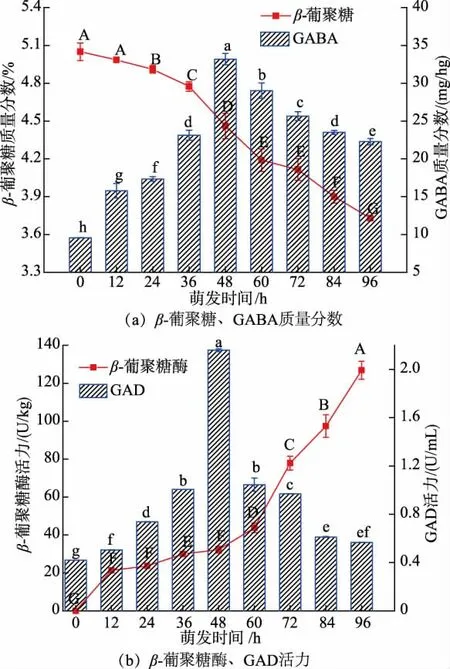
图1 萌发过程中青稞β-葡聚糖、GABA 质量分数和β-葡聚糖酶、GAD 活力变化Fig. 1 Changes of the mass fraction of β-glucan and GABA and enzyme activities of β-glucanase and GAD during germination of highland barley

2.2 淀粉质量分数和淀粉酶活力变化
由图2 可知,青稞中淀粉质量分数随萌发时间的延长而下降。 萌发12~36 h 下降趋势较小,48~96 h 降幅较大。 种子在萌发初期优先利用小分子糖[19],随萌发时间的延长,淀粉酶相关基因表达上调,受到胚中赤霉素的刺激在幼胚和糊粉层中产生大量淀粉酶,特别是α-淀粉酶,从而将淀粉水解成可溶性糖为萌发提供能量[20-21]。 萌发前期因青稞处于休眠期,α-淀粉酶活力很小(0.53 CU/g),萌发60 h 后,α-淀粉酶的活力急剧增大。 β-淀粉酶在萌发前存在一定的活力,在萌发12~36 h 时,酶活力未发生显著变化,36 h 后酶活力显著增加。 可能与结合态的β-淀粉酶通过蛋白酶切割变为游离态而释放出来有关[22]。 谷物中α-淀粉酶主要在萌发期间合成,在种子萌发过程中起着关键作用[22]。 因此,α-淀粉酶和β-淀粉酶的活力增加均有利于促进淀粉的降解。 为确保青稞中的淀粉质量分数,萌发时间不宜过长,根据β-葡聚糖和GABA 质量分数,萌发48 h 较为适宜。

图2 萌发过程中青稞淀粉质量分数和淀粉酶活力的变化Fig. 2 Changes of the mass fraction of starch and enzyme activities of amylase during germination of highland barley
2.3 蛋白质质量分数和蛋白酶活力的变化
由图3 可知,青稞中蛋白质质量分数随萌发时间增加而降低,蛋白酶活力逐渐上升。 在萌发过程中蛋白质不断分解和合成, 在蛋白酶的激活作用下,储存蛋白质分解为小分子肽类和氨基酸,这些小分子肽类和氨基酸再供胚胎形成新的结构蛋白[23]。
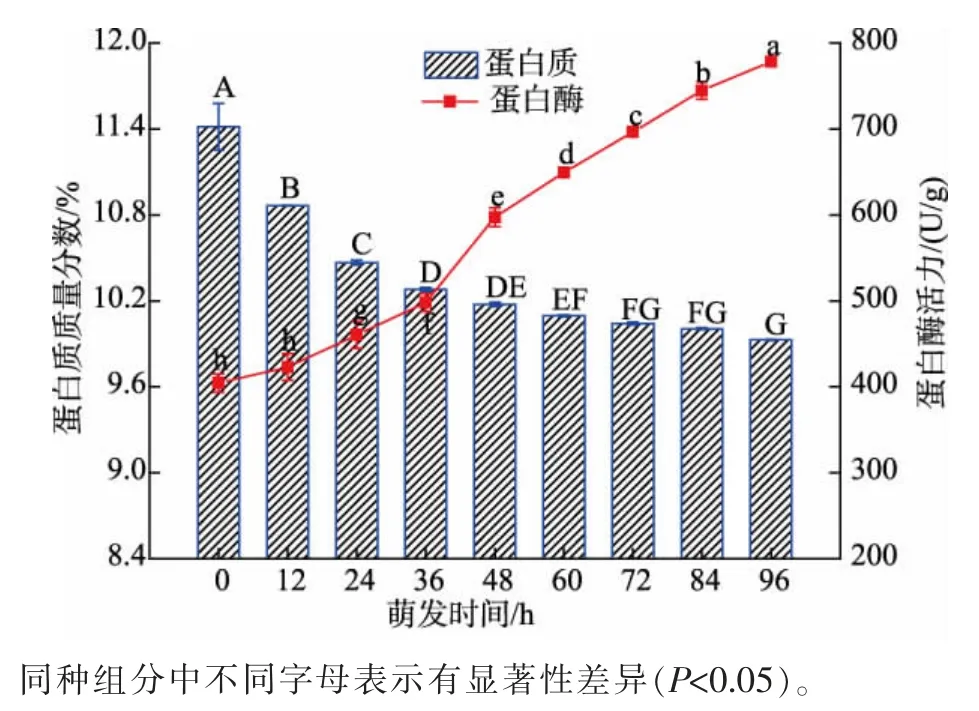
图3 萌发过程中青稞蛋白质质量分数和蛋白酶活力的变化Fig. 3 Changes of the mass fraction of protein and enzyme activities of protease during germination of highland barley
2.4 游离氨基酸质量分数的变化
由表2 可知,青稞在萌发过程中,总游离氨基酸质量分数随萌发时间的延长而显著增加。 萌发后总游离氨基酸质量分数的增加是由于萌发后蛋白酶的活力增加,降解蛋白质和合成新酶,这些酶有助于游离氨基酸的释放[23]。 在萌发12~96 h,除天冬氨酸、谷氨酸、丙氨酸、蛋氨酸外,其余氨基酸质量分数变化趋势基本一致,在萌发12~48 h 显著增加,48 h 后有所下降。 萌发48 h 时,7 种人体必需氨基酸质量分数最高(蛋氨酸除外),缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸、蛋氨酸、苏氨酸和赖氨酸分别是原料的3.59 倍、4.65 倍、6.58 倍、3.41 倍、12.75 倍、3.75 倍和4.59 倍。 非必需氨基酸中脯氨酸、丙氨酸和酪氨酸等也显著升高。 脯氨酸等为合成赖氨酸和其他必需氨基酸提供氮源[24],促使必需氨基酸赖氨酸质量分数增加,改善了青稞的蛋白质质量。 各种游离氨基酸均具有特殊的营养功能,青稞萌发后各种游离氨基酸质量分数显著上升,表明萌发可使青稞功能性成分增加,营养品质得到极大提高。
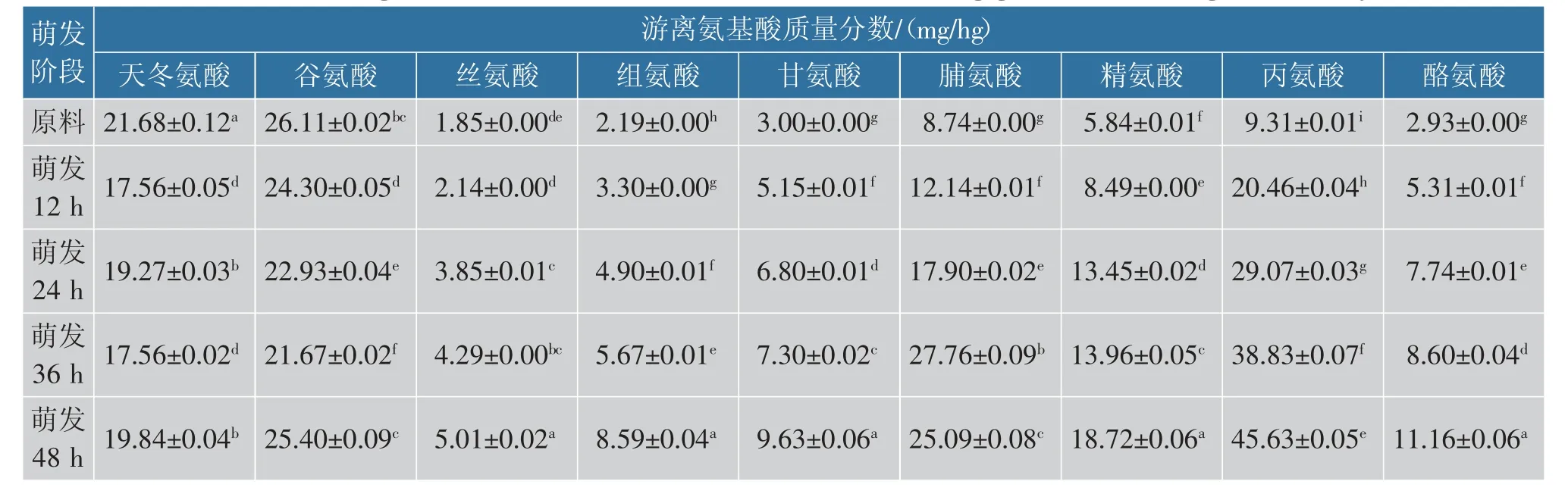
表2 青稞萌发过程中游离氨基酸质量分数的变化Table 2 Changes of the mass fraction of free amino acid during germination of highland barley
2.5 总多酚和总黄酮质量分数变化
由图4 可知,总多酚和总黄酮质量分数随萌发时间的增加呈上升趋势。 研究发现,种子萌发过程中水解酶的激活会降解其细胞壁,释放游离态和结合态的酚类化合物,从而使总多酚质量分数明显增加[25]。 此外,在萌发过程中,可通过激活莽草酸和苯丙烷途径重新合成酚类化合物[26],即随萌发时间延长,多酚氧化酶的活力降低,而蒽酰胺合成酶的活力升高,促进了多酚类物质的合成[26]。
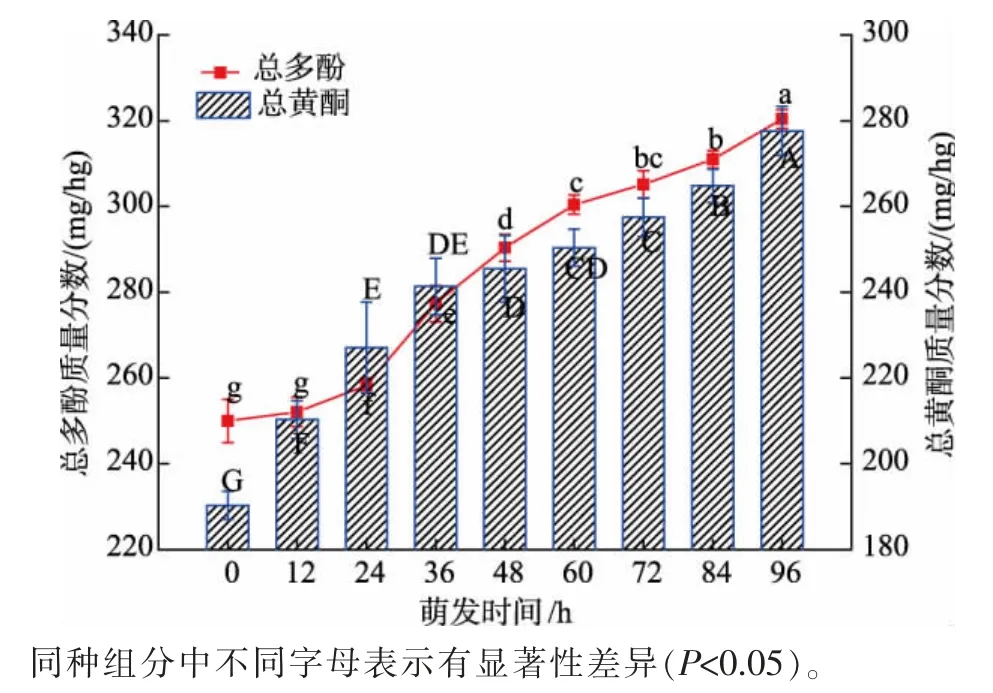
图4 青稞萌发过程中总多酚和总黄酮质量分数的变化Fig. 4 Changes of the mass fraction of total polyphenol and flavone during germination of highland barley
2.6 发芽青稞降血压功效分析
2.6.1 发芽青稞对SHR 体质量影响 由表3 可知,给予受试物前后,SHR 体质量均无显著性变化 (P>0.05), 表明青稞和发芽青稞受试样品对SHR 体质量无不良影响。
表3 青稞对SHR 体质量的影响Table 3 Effects of highland barley on the body weight of SHR
2.6.2 发芽青稞对SHR 血压和心率的影响 由表4可知,实验前,对照组、青稞组和发芽青稞组SHR 的收缩压和舒张压均无显著差异。 饲养30 d 后,与对照组相比,发芽青稞高剂量组SHR 的收缩压和舒张压显著降低(P<0.05),心率无显著差异。表明高剂量发芽青稞具有降血压作用,可能与青稞中GABA、总多酚和总黄酮质量分数有关[6-9]。 青稞萌发后GABA质量分数显著提高, 与青稞组相比, 发芽青稞对SHR 降压效果更显著。
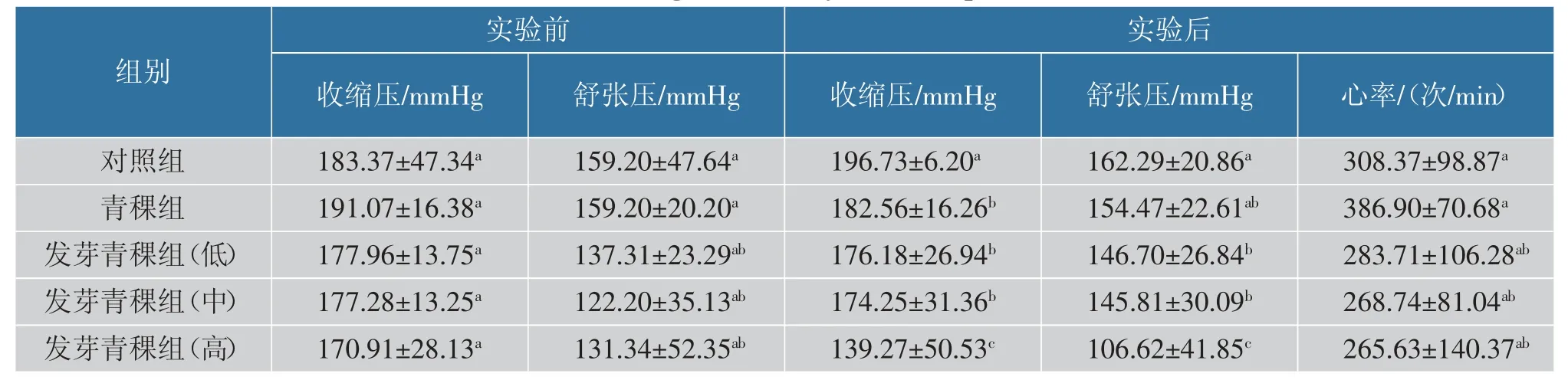
表4 青稞对高血压模型大鼠血压的影响Table 4 Effects of highland barley on blood pressure of SHR
2.6.3 发芽青稞对SHR 血清中ANGⅡ和BK 质量浓度的影响 由表5 可知,与对照组相比,发芽青稞中、 高剂量组的SHR 血清中ANGⅡ质量浓度显著降低(P<0.05),分别下降19.75%、21.22%。 青稞组、发芽青稞低、中、高剂量组BK 质量浓度显著升高 (P<0.05), 分别提高11.48%、8.82%、10.66%、12.85%,可能与血管紧张素转换酶活性降低有关[8]。ANGⅡ合成减少, 血管紧张素转换酶对BK 的降解作用减弱,血管扩张均有利于降低血压[8]。 表明一定剂量的发芽青稞能缓解大鼠高血压症状。
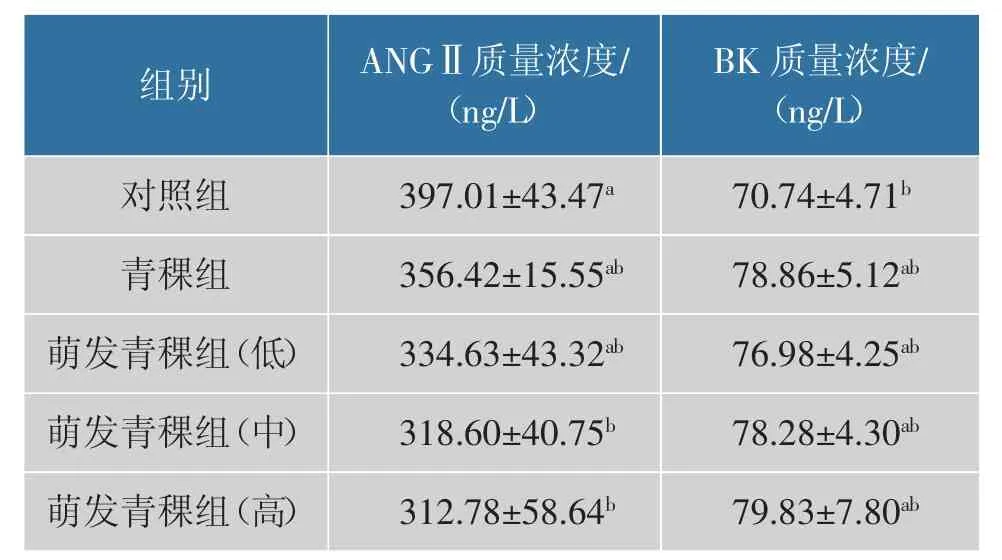
表5 青稞对SHR 血清中ANGⅡ和BK 质量浓度的影响Table 5 Effects of highland barley on the mass concentration of ANGⅡand BK in serum of SHR
2.6.4 发芽青稞对SHR 血清中Ang2、PGI2、NO 和EDHF 质量浓度的影响 Ang2 在炎症刺激下能迅速从内皮细胞释放,从而引发血管效应[27]。Fiedler 等报道,原发性高血压患者Ang2 水平升高,其值可作为高血压患者心血管疾病的一个预测指标[28]。 由表6 可知,与对照组相比,发芽青稞低、中、高剂量组Ang2 水平显著降低(P<0.05),表明发芽青稞在一定剂量下能通过降低Ang2 水平来缓解大鼠高血压症状。
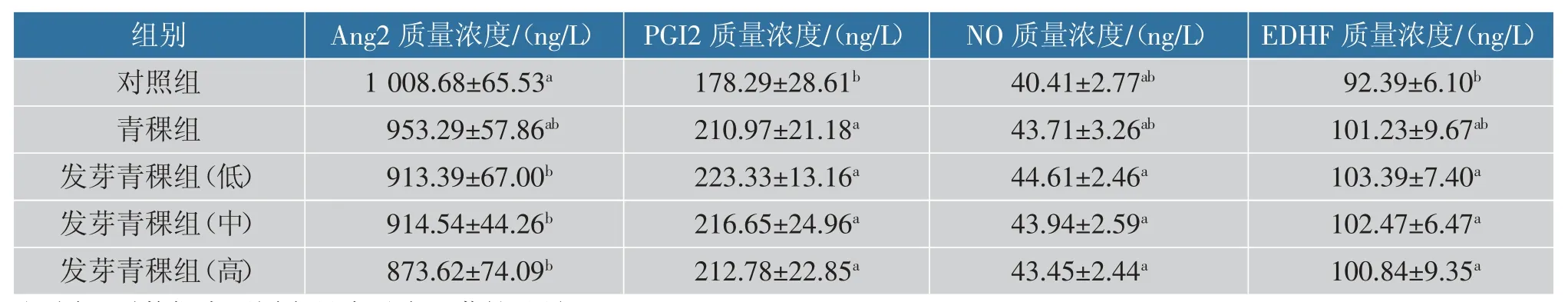
表6 青稞对SHR 血清中Ang2、PGI2、NO 和EDHF 质量浓度的影响Table 6 Effects of highland barley on the mass concentration of Ang2,PGI2,NO and EDHF in serum of SHR
PGI2 是血管壁中花生四烯酸代谢的主要产物。PGI2 的合成与释放会引起血管舒张并抑制血小板聚集[29]。由表6 可知,青稞组和发芽青稞低、中、高剂量组的SHR 血清中PGI2 质量浓度显著高于对照组(P<0.05), 表明青稞和发芽青稞在一定剂量下可通过增加PGI2 的表达进而发挥降压功效。
NO 是一种强效的内源性血管舒张因子, 可诱导血管舒张[30]。 研究报道,内源性NO 生成减少可能是高血压持续进行的原因之一[31]。由表6 可知,青稞组的SHR 血清中NO 质量浓度与对照组无明显差异,发芽青稞低、中、高剂量组的SHR 血清中NO 质量浓度显著高于对照组,表明发芽青稞在一定剂量下可通过增加NO 的表达进而发挥降压功效。
在某些情况下, 内皮功能障碍与舒张过程中EDHF 质量浓度的降低相关,EDHF 的表达减少可导致血管舒张能力下降[32]。 由表6 可知,发芽青稞低、中、高剂量组的SHR 血清中EDHF 的表达显著高于对照组(P<0.05), 分别提高11.91%、10.91%、9.15%,血管舒张能力增强,有助于缓解SHR 高血压症状。
3 结 语
青稞在萌发过程中,β-葡聚糖酶、淀粉酶、蛋白酶和GAD 活力的变化, 尤其是酶活力的加强刺激了大量酶促反应进行生物转化,使β-葡聚糖、淀粉和蛋白质质量分数降低,GABA、游离氨基酸、总多酚和总黄酮质量分数显著增加, 尤其在发芽48 h时,青稞中GABA 质量分数高达33.18 mg/hg,是青稞原料的3.47 倍, 即发芽提高了青稞的营养价值。此外, 青稞和发芽青稞都具有一定的降血压效果,且发芽青稞的降血压效果优于未发芽青稞。 因此,发芽青稞在青稞保健功能食品的研究与开发方面更具发展前景。

