miR-654-3p靶向GMFB抑制骨肉瘤细胞增殖的作用及机制研究
赵立晶 张鸿翔 王国安
骨肉瘤是最常见的原发性恶性骨肿瘤,在青春期和老年期发病率较高。骨肉瘤极易发生转移,且以肺转移最常见[1]。近三十年来,骨肉瘤的治疗进入了平台期,尤其是转移性骨肉瘤和复发性骨肉瘤,致残率和死亡率极高[2-3]。探究骨肉瘤发病的分子机制和治疗靶点是骨肉瘤研究的重要方向。
miRNA是一种由18 ~ 24个核苷酸组成的小型单链非编码RNA,其通过与特定mRNA的靶向结合来调控基因的表达[4]。miRNA 水平的改变与包括肿瘤在内的常见人类疾病的发展有关,能够参与所有关键的肿瘤相关过程,包括DNA 损伤修复、细胞死亡、细胞增殖,以及上皮-间质转化、肿瘤侵袭和转移形成等[5-6]。同样,miRNA的异常变化也参与骨肉瘤的发生和发展,本研究通过生信分析,从经典GEO 数据库中筛选骨肉瘤中异常表达的miRNA。探究miR-654-3p对GMFB基因的靶向调控作用,以及对骨肉瘤细胞增殖的影响,并绘制基于GMFB表达来预测骨肉瘤患者预后情况的列线图,从而为探究骨肉瘤更多的发病机制、探索更可靠的生存预后预测方法提供理论依据。
1 材料与方法
1.1 主要材料、试剂与仪器
主要材料、试剂:人正常成骨细胞系hFOB1.19,人骨肉瘤细胞系143B、MG-63、SAOS2 和HOS[美国模式培养物集存库(ATCC)];DMEM 培养基、胎牛血清(FBS,美 国Gibco 公 司); miR-654-3p mimics、 mimics NC、pcDNA-GMFB、双荧光素酶报告质粒(上海吉玛基因公司)。PrimeScripTM RT试剂盒、SYBR Green Premix试剂盒(日本TaKaRa公司);4%多聚甲醛、CCK8 试剂盒、RIPA裂解液、制胶试剂盒、上样缓冲液、ECL化学发光试剂盒(上海碧云天公司);抗GMFB抗体、山羊抗兔IgG二抗(英国Abcam公司)。主要仪器:二氧化碳培养箱、超净工作台、NanoDrop 分光光度计(美国Thermo Scientific 公司);电泳仪(美国Bio-Rad 公司);低温高速离心机(德国Eppendorf 公司);酶标仪(美国BioTek 公司);倒置相差显微镜(日本OLYMPUS公司)。
1.2 实验方法
1.2.1 细胞培养与转染
将冻存的细胞复苏,用含10%FBS的DMEM培养液将细胞培养于二氧化碳恒温培养箱中,每2 ~ 3 d更换一次培养液。当细胞融合度达到80% ~ 90%时,将细胞消化并以5×105/孔的密度接种到6孔板中。培养过夜后,用miR-654-3p mimics或mimics NC及pcDNA-GMFB转染细胞,严格按照转染试剂说明书进行。置于培养箱中孵育6 h后,更换细胞培养液,继续培养48 h,然后收集各组细胞进行后续实验。
1.2.2 生物信息学分析
在GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)中检索GSE70367数据集,然后采用GEO2R在线分析工具对数据集中骨肉瘤细胞和正常细胞进行miRNA 表达差异分析,筛选满足P值<0.05 且logFC 绝对值≥2 的前20 个miRNA。在TargetScan7.2 数据库(https://www.targetscan.org/vert_72/)和miRmap 数据库(https://mirmap.ezlab.org/app/)中输入has-miR-654-3p,对其靶基因进行预测。在TCGA 数据库(http://cancergenome.nih. gov/)中下载骨肉瘤患者的GMFB表达数据和临床信息,使用R软件4.0.2版本基于survminer R 软件包和survival R 软件包绘制GMFB与骨肉瘤患者总体生存率的KM生存曲线,rms R软件包和survival R软件包绘制骨肉瘤患者的生存预后列线图。
1.2.3 RT-qPCR实验
提取各处理组的不同骨肉瘤细胞的总RNA,根据逆转录试剂盒的说明书反转录合成cDNA,然后按照RT-qPCR试剂盒的反应体系进行定量检测。引物序列如下:miR-654-3p 上游引物:5′-AGCGAATATGTCTGCTGACCA-3′,下游引物:5′-CAGTGCAGGGTCCGAGGT-3′;U6 上游引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,下 游 引物:5′-CGCTTCAGAATTTGCGTGTCAT-3′;GMFB上游引物:5′-ACGCCTGGTGGTACTGGATGAG-3′,下游引物:5′-GCGAGGTTGTCGTTCAGGTAGTTC-3′;GAPDH 上 游引物:5′-CCTCGTCCCGTAGACAAAATG-3′,下游引物:5′-TGAGGTCAATGAAGGGGTCGT-3′。
1.2.4 Western blot实验
收集各处理组的骨肉瘤细胞进行裂解,提取总蛋白,然后加入上样缓冲液在金属浴中煮沸10 min。将蛋白样品经过SDS-PAGE电泳、转膜、封闭、一抗孵育和二抗孵育,采用ECL 化学发光试剂盒在化学发光成像系统中进行显色。选用抗GMFB 抗体(1∶1 000)、山羊抗兔IgG 二抗(1∶2 000)。将目的蛋白和内参蛋白GAPDH的比值作为相对定量结果。
1.2.5 双荧光素酶报告基因实验
将包含GMFB 3'UTR 区的野生型和突变型pGL3 报告质粒,分别和miR-654-3p mimics 或mimics NC 一起转染MG-63 细胞和HOS 细胞。在二氧化碳恒温培养箱中培养48 h后,测定两种骨肉瘤细胞的荧光素酶活性。
1.2.6 CCK8实验
将处于对数生长期的各处理组骨肉瘤细胞以1 500个每孔的数量接种于96孔板中,在二氧化碳恒温培养箱中培养72 h。弃去上清液,在每孔中加入含10% CCK8 溶液的培养液进行孵育。孵育2 ~ 4 h 后,将96 孔板置于酶标仪中在450 nm波长下检测各孔吸光度OD值。
1.2.7 菌落形成实验(colony forming units,CFU)
将处于对数生长期的各处理组骨肉瘤细胞以300 个每孔的数量接种于6 孔板中,然后置于二氧化碳恒温培养箱中,每3 d观察一次菌落形成数量。培养14 d后,当出现肉眼可见的菌落时,弃去培养液,用4%多聚甲醛固定后用结晶紫溶液进行染色。拍照并对克隆数进行计数。
1.3 统计学方法
采用SPSS 22.0软件进行统计学分析,结果用均值±标准差的方式表示。两组间的比较采用Studentt检验,三组或三组以上采用单因素方差分析。KM 生存曲线采用单因素Cox 回归分析,而预后列线图的绘制采用单因素和多因素Cox回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 GEO数据库筛选骨肉瘤细胞中异常表达的miRNA
通过GEO数据库检索到包含骨肉瘤细胞和正常细胞的miRNA表达值的数据集GSE70367,通过GEO2R工具分析骨肉瘤细胞与正常细胞差异表达最明显的20 个miRNA。结果发现其中有4 个miRNA 表达明显上调,16 个miRNA表达明显下调。在这些差异表达的miRNA中,miR-654-3p在骨肉瘤细胞样本中明显下调(见图1)。

图1 GSE70367 数据集中骨肉瘤细胞差异表达的miRNA:A. GSE70367数据集中差异最明显的20个miRNA;B. miR-654-3p在骨肉瘤样本中的表达情况
2.2 miR-654-3p在骨肉瘤细胞系中的表达情况
通过PCR实验检测了正常成骨细胞hFOB1.19和143B、MG-63、SAOS2 及HOS 骨肉瘤细胞中miR-654-3p 的表达情况,结果如图2所示。与hFOB1.19细胞相比,miR-654-3p在这4种骨肉瘤细胞系中的表达均明显下调,且以MG-63细胞和HOS细胞最为明显。
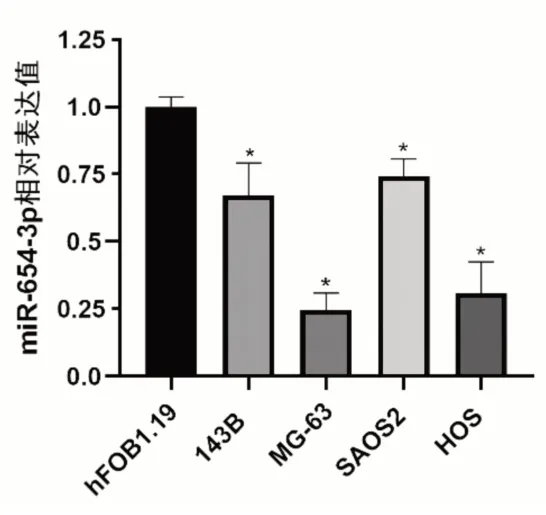
图2 正常成骨细胞和骨肉瘤细胞中miR-654-3p的表达
2.3 miR-654-3p靶向调控GMFB
如图3 所示,通过TargetScan 7.2 数据库和miRmap 数据库预测到GMFB 基因是miR-654-3p 的靶基因之一,且PCR 检测发现,与hFOB1.19 细胞相比,GMFB 在143B、MG-63和HOS骨肉瘤细胞中的含量明显上调。双荧光素酶报告基因实验显示,miR-654-3p mimics能够明显降低野生型GMFB-WT转染的MG-63细胞和HOS细胞的荧光素酶活性,而对突变型GMFB-Mut转染的细胞的荧光素酶活性没有明显影响,而阴性对照组mimics NC 转染的细胞同样没有明显变化(见图4)。miR-654-3p mimics 转染的MG-63细胞和HOS细胞中的GMFB在mRNA和蛋白质水平的表达明显降低(见图5)。
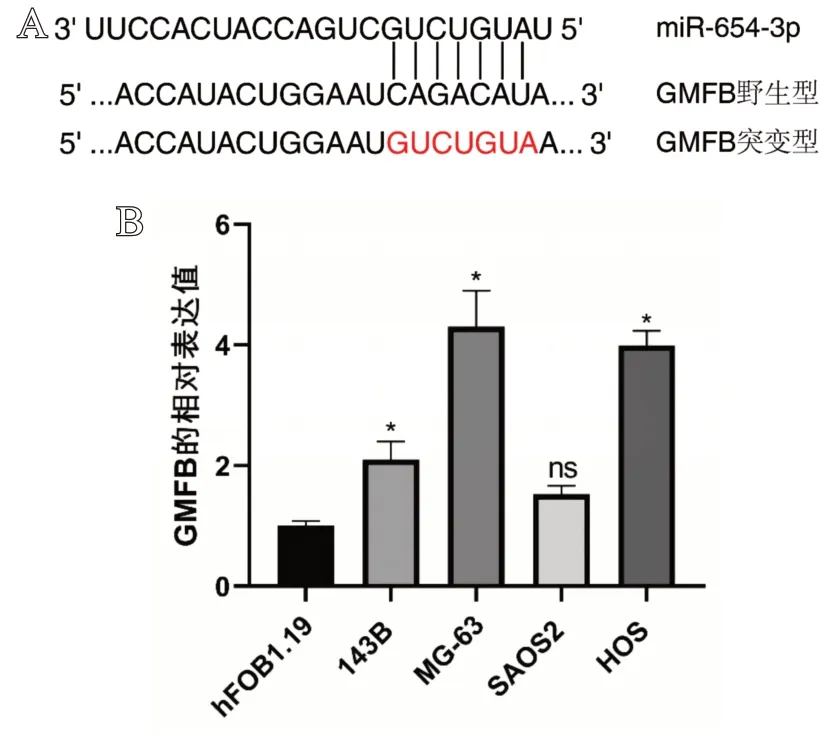
图3 A. miR-654-3p 与GMFB mRNA 的预测结合位点;B. 正常成骨细胞和骨肉瘤细胞中GMFB的表达
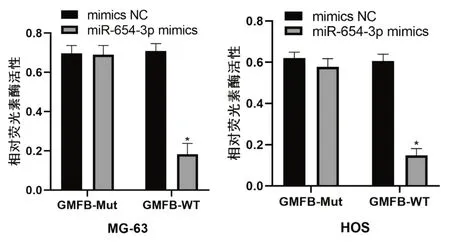
图4 双荧光素酶报告基因实验验证miR-654-3p与GMFB的结合

图5 miR-654-3p 模拟物对骨肉瘤细胞中GMFB 表达的干预情况:A. PCR 实验检测GMFB 在mRNA 水平的变化;B. Western blot 实验检测GMFB在蛋白质水平的变化
2.4 miR-654-3p和GMFB对骨肉瘤细胞增殖的影响情况
CCK8 实验和CFU 实验结果均显示,与mimics NC 组相比,miR-654-3p mimics转染能够明显抑制MG-63细胞和HOS 细胞的增殖,且这种抑制现象能够被pcDNA-GMFB转染所逆转(P<0.05,见图6)。

图6 CCK8实验和CFU实验检测miR-654-3p和GMFB对骨肉瘤细胞增殖的影响:A. CCK8 实验检测MG-63 和HOS 细胞增殖的变化;B. CFU实验检测MG-63和HOS细胞增殖的变化
2.5 GMFB的表达对骨肉瘤患者预后的影响情况
通过TCGA 数据库下载骨肉瘤患者的临床信息和GMFB 表达数据,KM 生存曲线显示GMFB 高表达患者的总体生存率明显低于低表达患者(见图7)。列线图则展示了通过年龄、性别、转移情况、放疗情况和GMFB的表达量对骨肉瘤患者的1 年、3 年和5 年生存率的预测情况(见图8)。
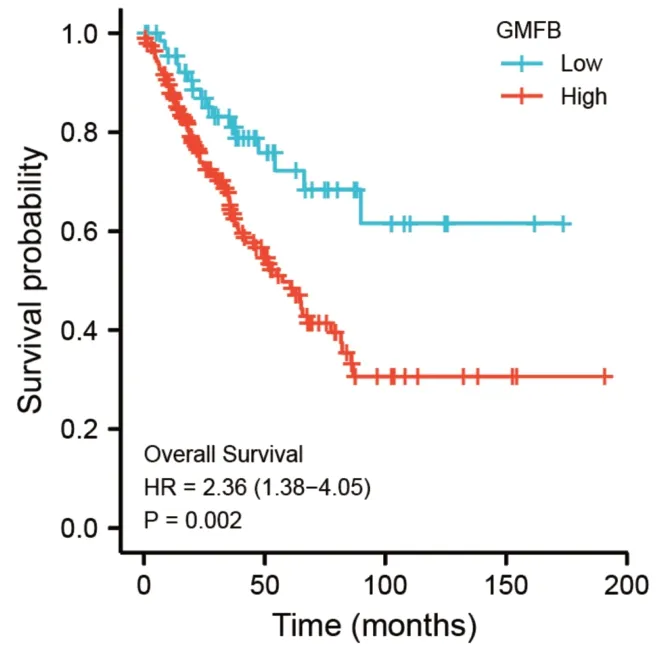
图7 GMFB对骨肉瘤患者生存预后的影响情况
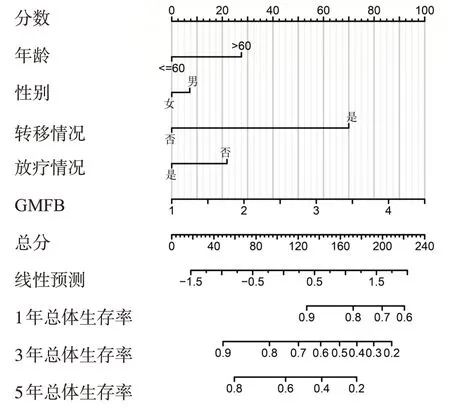
图8 基于临床信息和GMFB表达量构建的骨肉瘤患者预后列线图
3 讨论
既往研究表明,miRNA 在成骨方面发挥着重要作用,miRNA是破骨细胞维持骨吸收活性以及成骨细胞增殖和分化过程中的重要调节因子,如miR-29b、miR-141 和miR-200a均对成骨细胞的分化起到调节作用[7-8]。miRNA的失调是骨退化、吸收和骨肿瘤形成等相关骨疾病中的一个重要病理因素[9],miR-21 在骨肉瘤中过表达,能够参与肿瘤抑制基因和凋亡相关蛋白的调节,如TPM1、PDCD4 和TIMP3等[10]。miR-125和miR-143的异常表达也都对骨肉瘤细胞的异常增殖产生影响,与骨肉瘤的发展密切相关[11-12]。然而目前对骨肉瘤的发病机制研究仍然不足,已发现的异常表达的miRNA未能在骨肉瘤更深入的治疗中提供有力的指导作用,所以骨肉瘤中miRNA的调控谱仍有待完善。因此,本研究对骨肉瘤中miRNA的调控作用继续进行深入挖掘,为骨肉瘤的发病机制、治疗靶点选择和生存情况预测提供更多的理论依据。
本研究首先通过GEO2R 在线工具分析GSE70367 数据集中骨肉瘤细胞与正常细胞之间的miRNA表达差异,以此来筛选骨肉瘤中异常表达的miRNA。笔者发现在表达差异最明显的前20 个miRNA 中有4 个明显上调,16 个明显下调。miR-654-3p 是一种在2010 年才被首次公开描述的miRNA,其生物学功能在2014 年被报道。Geraldo 等[13]发现,miR-654-3p在甲状腺乳头状癌中明显下调,在体外逆转miR-654-3p能够降低癌细胞的增殖和迁移,并且诱导转移相关基因的表达降低,这表明miR-654-3p具有肿瘤抑制作用。Pu等[14]发现miR-654-3p无论是在非小细胞肺癌患者还是细胞系中的含量都显著降低,并且与患者的肿瘤大小和肿瘤淋巴结转移分期显著相关。miR-654-3p通过负调控靶基因PLK4 显著增加癌细胞的凋亡和肿瘤的体内生长。鉴于miR-654-3p作为基因调控分子密切参与其他肿瘤的发生发展,而目前关于miR-654-3p在骨肉瘤中的表达及调控作用尚未见报道,因此笔者聚焦在miR-654-3p展开后续研究。
笔者首先通过PCR实验对骨肉瘤细胞中miR-654-3p的表达进行检测,结果发现与人正常成骨细胞hFOB1.19 相比,miR-654-3p在人骨肉瘤细胞中均明显下调。随后通过TargetScan网站和miRmap网站对miR-654-3p的靶基因进行预测,在两个网站中都显示miR-654-3p能够与GMFB基因特异性结合。于是,笔者猜测miR-654-3p 能够通过调控GMFB 的表达来参与骨肉瘤细胞的生物学功能。GMFB 是一种生长和分化因子,主要参与脊椎动物大脑的生长和分化、中性粒细胞趋化性、单核细胞迁移、T 淋巴细胞迁移和黏附等过程[15-17]。GMFB 在几种神经炎症和神经退行性变情况下上调,而GMFB的表达增加还与包括胶质瘤和卵巢癌在内的多种类型的癌症高度相关,且与肿瘤患者的预后不良相关[18-20]。Liu等[21]的研究发现,在高血糖诱导的人视网膜色素上皮细胞中过表达的miR-5195-3p 负调控GMFB 基因的表达,增强细胞凋亡和促炎细胞因子的分泌。本研究中双荧光素酶报告基因实验检测结果显示,在MG-63和HOS 细胞中miR-654-3p 能够与GMFB 相结合,且被miR-654-3p的模拟物负向调控,因此这说明miR-654-3p在骨肉瘤细胞中作为GMFB 的基因表达调控因子来发挥作用,这与笔者的预测是一致的。为了检测miR-654-3p 及GMFB 是否能对骨肉瘤细胞的增殖发挥作用,笔者进行了CCK8 和CFU 实验,结果显示miR-654-3p 的增加能够显著抑制骨肉瘤细胞的增殖,且这种抑制作用能够被GMFB所逆转,这说明miR-654-3p—GMFB 轴能够参与骨肉瘤细胞增殖的调控过程。
探究肿瘤发病的分子机制主要是为肿瘤诊断、治疗和预后判断提供理论依据,而在骨肉瘤的研究中仍然缺乏一个可靠的生存预后预测模型。为了验证本研究中GMFB基因调控作用对骨肉瘤患者生存预后的影响,笔者对TCGA数据库中骨肉瘤患者的GMFB表达和临床信息进行综合分析,结果发现GMFB高表达患者的总体生存率要明显低于低表达患者。此外,笔者构建了一个包含GMFB 表达量、年龄、性别、转移情况和放疗情况的生存预后模型,能够根据以上几种因素对骨肉瘤患者的1年、3年和5年生存率进行预测,方便判断骨肉瘤患者的预后生存情况,这为骨肉瘤患者的生存发展方向及治疗选择提供了更加丰富可靠的数据支持。
综上所述,本研究发现骨肉瘤细胞系中表达降低的miR-654-3p能够调控靶基因GMFB的表达,且二者的调控作用影响骨肉瘤细胞的增殖能力。本研究还构建了通过GMFB 基因表达量来预测骨肉瘤患者生存预后情况的列线图模型。研究揭示了miR-654-3p—GMFB 轴在骨肉瘤中的作用,为miR-654-3p和GMFB可能作为骨肉瘤诊断标志物提供了理论依据。

