豫中马铃薯早疫病病原菌的分离鉴定及防治药剂筛选
鲁进恒 东莹莹 袁 谦 范志业 张中州 吴 浩 王秋岭
(1.漯河市农业科学院 河南漯河 462000;2.河南省修武县农业技术推广中心 河南修武 454350)
马铃薯是一种重要的粮菜兼用农作物, 因其营养全面,产品开发链长,有着巨大的市场需求。 随着我国农业产业结构调整和马铃薯主粮化加速,其种植区分布逐渐趋于合理[1],产品也实现了周年化供给[2],整个产业呈现稳步向好的局面。
早疫病是马铃薯生产上仅次于晚疫病的第2 大病害,近年来,国内的发病状况呈逐渐加重的趋势[3]。该病可影响植株叶片、茎秆及块茎的生长,显著降低马铃薯的产量和品质,严重时减产可达39%[4]。 关于早疫病的研究,在各种植区皆有大量的报道,张建平等[5]研究了关于马铃薯早疫病孢子传播方式、病害发生规律及其与气象因子的关系,谷青等[6]报道了北方一作区马铃薯早疫病病菌不同地理群体的遗传结构,吴志会等[7]筛选出了适合冀东地区防治马铃薯早疫病的药剂,何凯等[8]明确了重庆地区的马铃薯早疫病致病菌种类及其生物学特性,赵雨佳等[9]筛选了适合重庆地区防治马铃薯早疫病的药剂。
豫中地区作为国家重要的粮食和蔬菜生产基地,马铃薯的播种面积在逐年增加,早疫病几乎连年发生。 但本地区关于早疫病的研究较少,致病菌种类尚未明确,缺乏有针对性的防治方法。 为此,本研究通过组织分离法对豫中5 地的马铃薯早疫病的病原菌进行分离纯化, 采用形态学的方法进行了菌株鉴定,并用室内毒力测定法筛选出了防治药剂,为有针对性地开展马铃薯早疫病的防治提供科学依据。
1 材料与方法
1.1 供试材料
供试材料:于2022 年4-6 月,采集漯河、南阳、开封、周口、驻马店豫中5 地市的马铃薯患病叶片。
供试药剂:75%百菌清可湿性粉剂,由先正达(苏州) 作物保护有限公司生产, 商品名称为好迪施;500 g/L 氟啶胺悬浮剂, 由日本石原产业株式会社生产,商品名称为福帅得;70%丙森锌可湿性粉剂,由拜耳作物科学(中国)有限公司生产,商品名称为安泰生;50%啶酰菌胺可湿性粉剂,由巴斯夫(中国)有限公司生产, 商品名称凯泽;250 g/L 嘧菌酯悬浮剂,由先正达(南通)作物保护有限公司生产,商品名称为阿米西达。
1.2 试验方法
1.2.1 病原菌的分离与纯化 采用组织分离法对病叶进行病原菌分离。 用无菌水反复冲洗病叶,剪取叶片病健交界处2~3 mm2组织块,75%乙醇溶液处理3~4 s,0.1%氯化汞消毒15~20 s, 取出后用无菌水反复冲洗3~5 遍,晾干置于PDA 平板上,在26℃的培养箱中黑暗培养,48 h 后挑取菌落边缘的菌丝进行纯化, 在26℃下培养5 d 后对纯化菌落再次进行单孢纯化[10],获得纯化菌株后保存于PDA 斜面上,置于4℃冰箱保存备用。
1.2.2 致病性测定 采用菌丝块接种法进行致病性测定[11]。 取叶龄大小一致的离体健康马铃薯叶片,用无菌水冲洗1~2 遍,用75%乙醇表面消毒1 min 后,用无菌水冲洗2~3 遍,置于培养皿中备用,皿底铺无菌纱布保湿。先将已分离菌株在PDA 上活化,后用直径为5 mm 的打孔器在菌落边缘打取菌饼,并用灭菌后的接种针对叶片作刺伤处理, 将菌饼接种到伤口处。 以无菌PDA 块作为对照,置于26℃光照培养箱培养(光周期12L∶12D),每24 h 观察1 次。 待发病后再次从病斑处分离病原菌, 并与首次分离的病原菌作对比。
1.2.3 形态学鉴定 将纯化后的病原菌菌株在PDA培养基上26℃光照培养7 d,观察并描述菌落形态及颜色、 培养基质颜色和分生孢子形态, 作为鉴定的主要依据。参照张天宇[12]的真菌鉴定方法进行形态学鉴定。
1.2.4 杀菌剂室内毒力测定 采用菌丝生长速率法测定5 种杀菌剂对病原菌菌丝生长的抑制效果[13]。用无菌水将杀菌剂配制成母液, 每种杀菌剂按有效成分稀释成5 个浓度梯度, 将不同浓度的杀菌剂加入PDA 中制成含药平板, 以不加杀菌剂的PDA 为对照,每个浓度设4 次重复(表1)。 先将储存的病原菌接种到PDA 上进行活化,在26℃的培养箱中黑暗培养5 d 后, 用5 mm 打孔器在菌落边缘打取菌饼,并分别接到制备好的含药PDA 平板和对照PDA 平板上,在26℃下黑暗培养7 d,用十字交叉法测量菌落直径。

表1 5 种杀菌剂的浓度梯度
计算杀菌剂对菌丝生长的相对抑制率,抑制率=[对照菌落直径-处理菌落直径/(对照菌落直径-0.5)]×100%。 将抑菌率换算成生物统计概率值(y),杀菌剂浓度换算成以10 为底的对数(x),根据浓度对数与概率值回归法,做毒力回归方程,计算5 种杀菌剂的抑制中浓度(EC50)及95%置信区间。利用DPS软件进行数据分析。
2 结果与分析
2.1 病原菌分离结果
通过对5 地采集的32 份患病叶片的组织分离,剔除杂菌,单孢纯化后共得到93 份纯化菌株。 其中培养基呈褐色的共64 株,培养基呈黄色或红褐色共29 株,二者大致比例为7∶3。 在显微镜下观察,64 株褐色菌株的菌丝形态基本一致,判定为同一种菌株,标记为A;29 株黄色菌株的菌丝和孢子形态也基本一致,判定为同一种致病菌,标记为B(图1)。
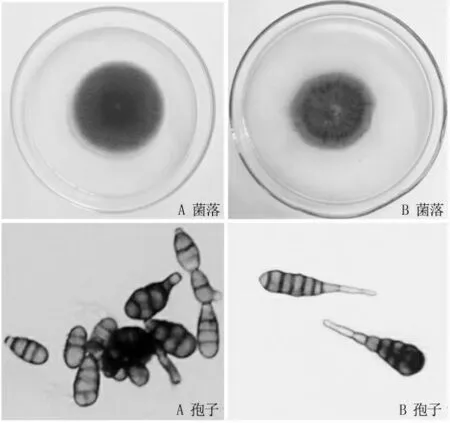
图1 病原菌菌落形态和孢子形态
2.2 致病性鉴定
将分离纯化的2 种菌株活化培养5 d 后,分别取菌落边缘的菌丝块接种在健康的刺伤马铃薯叶片上,在光周期12 L∶12D 下26℃保湿培养4 d 发现,接种叶片与田间患病叶片症状基本相同, 应为两者复合感染, 其中B 菌株接种后的叶片具有黑色较小的轮纹状病斑,而A 则以褐色干枯为主(图2)。 将接种发病的病斑分别进行再次分离, 获得的病原菌与田间分离的病原菌一致。 依据柯赫氏法则,确定分离获得的2 种菌株均为早疫病致病菌。

图2 马铃薯早疫病田间症状及回接后的发病症状
2.3 病原菌的形态学鉴定
将2 种菌株分别接种在PDA 平板上,置于26℃下黑暗培养7 d,可形成圆形或近圆形菌落。 A 菌株的菌落为圆形(图1A 菌落),菌丝初期为白色或灰白色,后转为暗褐色,气生菌丝发达。 后期培养基为黑褐色,说明菌丝可产生黑色色素。 分生孢子顶生,形态差异较大,有椭球形、倒棒状或手雷形(图1A 孢子),大小为(15~43)μm×(8~9)μm,有短喙,多数有隔膜,横膈1~7 个,纵膈0~4 个。 B 菌株的菌落呈圆形或不规则椭圆形(图1B 菌落)菌丝早期为白色,后转为褐色,气生菌丝不发达,能产生黄褐色色素,后期培养基呈黄色或砖红色。孢子为倒棒状(图1B 孢子),量少,大小为(70~150)μm×(6~18)μm,有长喙,喙与孢身等长或略长,孢子有横膈8~15 个,纵膈4~7 个。根据《中国真菌志》的记述,结合致病性鉴定,判定A 为链格孢、B 为茄链格孢。
2.4 杀菌剂室内毒力测定
由表2 可知,5 种药剂对2 种菌株均有一定的抑制作用。 其中5 种药剂对链格孢的EC50在3.262 7~13.457 4 mg/L; 啶酰菌胺的抑制效果最好,EC50为3.262 7 mg/L;嘧菌酯效果次之,EC50为3.480 2 mg/L,百菌清效果最差,EC50为13.457 4 mg/L。 5 种药剂对茄链格孢的EC50在1.155 3~9.507 0 mg/L;嘧菌酯的抑制效果最好,EC50为1.155 3 mg/L;啶酰菌胺次之,EC50为1.951 2 mg/L,居于末位的依然是百菌清,EC50为9.507 0 mg/L。

表2 5 种杀菌剂对2 种病原菌的抑制作(单位:mg/L)
3 讨论与结论
早疫病是马铃薯生产上的主要病害, 可在叶片上引起黑色轮纹状病斑, 严重时导致大量叶片过早枯萎,此病害在豫中地区几乎连年发生,严重制约马铃薯产业的健康发展。 本研究通过形态学的方法,将该地马铃薯早疫病致病菌确定为链格孢和茄链格孢,并明确了二者的比例为7∶3。
链格孢可致马铃薯早疫病的报道最早见于1984 年[14],其 后Boiteux L S 等[15]对 其 致 病性 进 行 了更深入的阐述。 据Lourenco V 等报道茄链格孢为早疫病致病菌的优势菌株[16],而Kapsa J[17]和张福光[18]则分别比较了A. solani和A. alternata的致病性, 结果表明二者都可单独致病。 但本试验表明,在豫中地区马铃薯田A. alternata和A. solani的比例为7∶3,从数量上说,A. alternata为本地区的优势菌株。
据已发表的报道来看, 除本试验分离出的2 种致病菌外,尚有多种病原可致马铃薯早疫病。2009 年,Ardestani S T 报道在伊朗A. interrupta可导致马铃薯早疫病[19], Rodrigues T T 报道了在巴西A. grandis也可导致马铃薯早疫病[20], 2013 年郑慧慧等总括报道了致马铃薯早疫病的病原菌可达8 种之多[21]。大量研究表明,在不同地域或生态条件下,马铃薯早疫病的致病菌存在着差异。 多种病原引起同一种病害,客观上为早疫病的防治带来了困难。
为了有针对性地防治豫中地区的马铃薯早疫病,本试验选取了5 种常用杀菌剂,对分离出的2 种致病菌进行了毒力测定。 结果表明,对链格孢抑制效果最好的是啶酰菌胺,嘧菌酯次之;对茄链格孢抑制效果最好的是嘧菌酯,啶酰菌胺次之。 啶酰菌胺是一种线粒体呼吸链抑制剂,通过抑制线粒体琥珀酸酯脱氢酶活性,阻碍三羧酸循环,进而阻碍ATP 合成[22],干扰能量传递,致菌体死亡;而嘧菌酯为一种内吸性杀菌剂,兼具保护和治疗作用,其作用机制是通过阻止特定细胞色素, 导致线粒体电子传递受到抑制以干扰能量传递[23],使细胞致死。 这2 种杀菌剂都具有广谱、高效的特点,且都对人体安全,易于消解[24-26],建议这2 种药交替使用,以减缓病原抗药性。

