基于网络药理学和实验验证探讨附子治疗变应性鼻炎的作用机制研究
李 琳,丁 顺,徐正扬,严旌仁,张启萌,牟忠林
(海南医学院第一附属医院耳鼻喉科头颈外科,海南 海口 570102)
变应性鼻炎(allergy rhinitis,AR)是耳鼻咽喉科最常见的疾病之一,是一种鼻黏膜症状性、炎症性与免疫性疾病[1]。变应性鼻炎可降低患者生活质量并导致其他疾病产生,如哮喘、阻塞性睡眠呼吸暂停等[2],约80%的变应性鼻炎的患者临床症状在20 岁之前出现并在20~40 岁达到高峰,然后逐渐下降[3]。AR 属于一种多因素的疾病,它的致病机理复杂,牵扯了多种炎性细胞和炎性介质[4]。目前AR的治疗选择包括患者教育、避免接触过敏原、药物疗法、免疫疗法、中医针灸、中医方剂和手术等[5]。西医药物治疗是目前AR 最主要的治疗方式,但这些药物往往容易引起如疲劳、激素抵抗和镇静等副作用[6]。因此目前需要一种有效且安全的药物来防治AR[7]。自古以来,附子是临床治疗AR 的代表中药,附子具有平喘、提高免疫功能、抗氧化、散寒止痛、抗寒抑菌的作用[8,9]。但是目前附子对AR 治疗的具体作用机制仍有待确定。传统基于单一组分的机制研究无法实现对中药药效的全面、系统的理解,网络药理学具有整体性、系统性的特征已被广泛运用于中医药的研究,应用网络药理研究附子治疗AR 的机制是可行的。
本研究应用网络药理学方法获得附子治疗AR的主要活性化合物成分及作用靶点基因,通过富集分析筛选出附子治疗AR 潜在的生物学过程和信号通路。在此基础上,建立AR 小鼠模型,观察附子对AR 的治疗作用。为进一步研究附子治疗AR 的药理机制奠定基础。
1 材料与方法
1.1 数据库及软件分析
通过中医药系统药理学数据库及分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)数据库以生物活性成分为口服生物利用度(oral bioavailability,OB)≥20%和(drug-likeness,DL)≥0.1 作为筛选条件,找到附子相关的活性化合物成分[10]。药代动力学(absorption,distribution,metabolism,and eexcretion,ADME)是筛选附子生物活性化合物成分重要的限制因素,是指药物化合物的吸收、分布、代谢和排泄。在药代动力学中,口服生物利用度OB 和DL 是最重要的药代动力学特性。OB 是指口服药物从胃肠道吸收进入循环系统的速率和程度[11]。DL 是药物设定的定性概念,可作为中草药“类药物”成分选用的依据。
1.2 附子的作用靶点基因筛选
在TCMSP 数据库筛选出的附子活性化合物,通过PubChem 数据库[12],设置筛选物种类别,将靶蛋白名称转为“gene symbol”表示,得到附子主要活性化合物对应的靶点基因,然后利用UniProt 数据库对基因名称进行标准化命名[13],在去除重复基因后获得附子活性化合物对应的靶点基因。
1.3 AR 的靶点基因筛选
GeneCards 数据库是一个人类基因信息数据库[14],在GeneCards 数据库中,通过使用“allergic rhinitis”这个词来搜索找到与AR 相关的靶点基因。
1.4 附子和AR 重叠靶点基因的获得
通过在线工具Venny2.1 筛选出附子与AR 的重叠基因[15],韦恩图是一种常用的统计学图表,它主要用于显示元素集合重叠区域的图示。附子治疗AR 的靶点基因即是这些被筛选出来的重叠基因通过使用韦恩图显示。
1.5 “化合物-基因-疾病”网络图构建
通过数据库筛选出附子治疗AR 的靶点基因,使用Cytoscape 软件构建化合物-基因-疾病(compound-gene-disease,C-G-D)网络图进行可视化,利用网络分析工具得出每个节点的连接度,表示于该节点直接连接的节点数目,连接度越大说明改节点在网络中的作用越重要[16]。
1.6 蛋白互作网络图构建
附子和AR 的重叠基因通过STRING 数据库进行蛋白质互作(protein-protein interaction,PPI)网络研究,在0.4 的置信水平下构建了PPI 网络图[17]。将基于数据库信息生成的PPI 网络导入Cytoscape 软件中,再使用 Cytoscape 中CytoHubba 插件依据MCC 算法筛选出最核心的前十位基因,这些基因是附子治疗AR 的前10 个重要枢纽基因[18]。
1.7 富集分析
通过GO 功能数据库可以帮助我们更好地理解基因功能,如细胞成分(cellular components,CC)、生物过程(biological processes,BP)和分子功能(molecular functions,MF)[19]。KEGG 功能数据库是可以从中获得基因及基因组信息的数据库[20]。DAVID 数据库是一款在线分析软件,为了探索靶点蛋白的基因功能以及信号通路方面的具体作用,使用DAVID 数据库中的功能注释工具对附子中的活性化合物成分与AR 交互靶点基因进行GO 功能富集分析和KEGG 信号通路富集分析[21,22],选取GO 功能富集分析中关于细胞成分、生物过程和分子功能的前十个关键词,通过条形图将结果可视化。选取KEGG 前20 个关键通路,设置P<0.05,通过分析图将结果可视化。
1.8 实验验证
1.8.1 实验材料和方法 (1)实验药物:100 g 附子购自海口市中医医院,加入10 倍量去离子水浸泡10 min,武火煮沸,文火煎煮2 h,过滤得一煎液;二煎加入8 倍量去离子水,武火煮沸,文火煎煮1.5 h,过滤得二煎液,两次煎煮液合并浓缩至生药量为1.52 g/mL 的浓缩液,放置在-80 ℃的冰箱中保存。(2)实验试剂:IL-6 和TNF-α 抗体购置于爱必信(上海)生物科技有限公司。
1.8.2 动物模型构建 选取购自于西安新区枫东新城实验动物园的4~6 周龄雌性小鼠,体重约在(20±2)g。小鼠被饲养在SPF 级的动物实验室中:温度(22±2)℃、湿度(60±5)%、12 h 光/暗循环环境,所有实验均按照中国国家实验动物护理和使用指南进行。该研究获得了海南医学院伦理委员会的批准(动物伦理编号:HYLL-2021-382)。
经过适应性喂养1 周后,将30 只雌性小鼠随机平均分为正常对照组(normal control group,NC group)、变应性鼻炎组(allergic rhinitis group,AR group)和附子组(radix aconiti lateralis preparata group,Fuzi group)。根据参考文献,经过适当的调整创建了以下的AR 的小鼠模型[23]。在前14 d 中,附子组和变应性鼻炎组小鼠给予腹腔注射致敏液致敏,致敏液的成分是卵清白蛋白(ovalbumin,OVA)40 μg 和Al(OH)31.5 mg 溶于生理盐水,配成共0.2 mL 的致敏液,每2 天1 次,从第15 天到第21天,按每只40 μL 5%的OVA 滴鼻液滴入小鼠双侧鼻腔激发,每天1 次。第22 天到30 天,附子组小鼠按给药剂量为1.56 g/kg 进行灌胃,每天1 次,同时为维持鼻部刺激,变应性小鼠组和附子组每隔1 天用OVA 滴鼻液激发,正常组小鼠用同体积的生理盐水替代,第31 天,处死所有小鼠。
1.8.3 HE 染色 取各组小鼠的完整鼻腔黏膜,用4%的多聚甲醛水浸泡24 h,经脱水、浸蜡、包埋、切片等处理后,用苏木精和伊红法对石蜡包埋的鼻黏膜组织进行染色,用光学显微镜来评估和记录组织病理学变化。
1.8.4 蛋白免疫印迹法检测 从各组鼻黏膜组织中分离出蛋白,用于鉴定IL-6 和TNF-α 的表达。将提取的蛋白加入BSA 标准测定溶液中进行蛋白浓度的鉴定,用SDS-PAGE 凝胶电泳对蛋白质进行分离。蛋白质随后被转移到转膜滤纸上,然后用5%的脱脂牛奶孵化2 h 后加入一抗并在4 ℃冰箱下孵育过夜。之后用TBST 洗膜,加入二抗溶液在室温下孵育2 h。最后通过显影仪器显影并测量目标带/相应的相对表达水平。
1.8.5 免疫组化法检测 将脱蜡的石蜡切片用二甲苯和酒精中按梯度脱水。通过在90 ℃的缓冲液中浸泡6 min 使抗原愈合,然后用3%的H2O2孵化10 min 以灭活内源性过氧化氢酶。然后滴加BSA以封闭组蛋白,在4 ℃下加入TNF-α 和IL-6 的一级抗体,之后滴加二抗孵育20 min,再加入辣根酶标记链霉卵白素工作液孵育15 min,加入显色液和苏木素溶液。进行封片后使用倒置显微镜进行观察。
1.9 统计学处理
采用描述性统计分析对实验结果进行统计描述,两组间采用t检验分析,多组间采用单因素方差分析,P<0.05 为差异具有统计学意义。所有的统计分析使用GraphPad Prism 8 进行分析。
2 结果
2.1 附子作用靶点基因的筛选
在TCMSP 数据库中,将OB 和DL 作为靶点基因的筛选条件,找到附子的21 个活性化合物成分。关于附子的21 种生物活性化合物成分的详细信息见表1。然后通过PubChem 数据库,在剔除64 个重复基因后共得到附子的203 个作用靶点基因。

表1 附子21 种活性化合物的详细信息Tab 1 Information on 21 Fuzi compounds in detail
表2 各组小鼠鼻黏膜组织IL-6 蛋白的表达灰度值统计表(n=10,±s)Tab 2 Statistical table of grayscale values of IL-6 protein expression in nasal mucosal tissue of mice in each group (n=10,±s)

表2 各组小鼠鼻黏膜组织IL-6 蛋白的表达灰度值统计表(n=10,±s)Tab 2 Statistical table of grayscale values of IL-6 protein expression in nasal mucosal tissue of mice in each group (n=10,±s)
组别正常对照组变应性鼻炎组附子组灰度值0.7502±0.0596 1.3355±0.0914 0.8415±0.0247 FP 71.312<0.001
表3 各组小鼠鼻黏膜组织TNF-α 蛋白的表达灰度值统计表(n=10,±s)Tab 3 Statistical table of grayscale values of TNF-α protein expression in nasal mucosal tissue of mice in each group (n=10,±s)

表3 各组小鼠鼻黏膜组织TNF-α 蛋白的表达灰度值统计表(n=10,±s)Tab 3 Statistical table of grayscale values of TNF-α protein expression in nasal mucosal tissue of mice in each group (n=10,±s)
组别正常对照组变应性鼻炎组附子组灰度值0.2719±0.0251 0.8658±0.0292 0.5311±0.0369 FP 280.532<0.001
2.2 AR 靶点基因及重叠靶点基因的筛选
通过GeneCards 数据库,在去除重复基因后筛选出AR 相关的靶点基因1 832 个,然后使用Venny 2.1 软件建立附子的203 个靶点基因和AR 的1 832个靶点基因的连接,共筛选出68 个重叠基因,AR 和附子重叠靶点基因的韦恩图见图1,这是附子治疗AR 的作用靶点基因。

图1 AR 和附子重叠靶点基因的韦恩图Fig 1 Allergic Rhinitis and Fuzi targets depicted in a Venny diagram
2.3 “化合物-基因-疾病”网络图构建
化合物-基因-疾病”网络图是研究中药治疗疾病基本过程的有价值的工具。利用Cytoscape 软件构建AR 和附子的“化合物-基因-疾病”网络图如图2 所示,中间红色多边形节点表示疾病,浅绿色长方形节点表示附子主要活性化合物包括去氧穿心莲内酯(deoxyandrographolide)、谷甾醇(sitosterol)、水黄皮素(karanjin)和次乌头碱(hypaconitine)等,深绿色长方形节点表示附子和AR 的重叠基因,如PTGS2、TNF、ALB、CXCL8、IL6、VEGFA、JUN等。每种活性成化合物连接多个靶点,多个靶点也连接多种成分,通过该网络图可以表明附子能通过其中的多种化合物成分作用于多个靶点,从而对AR 起治疗作用。

图2 “化合物-基因-疾病”网络图Fig 2 "Compound-Gene-Disease" network diagram
2.4 PPI 网络图的构建
使用STRING 数据库建立一个附子和AR 重叠基因的PPI 网络图,见图3,该网络包括68 个节点和860 个连接,然后利用CytoHubba 插件中MCC 算法方法筛选出附子治疗AR 的前10 个重叠枢纽基因主要为PTGS2、TNF、IL6、AKT1、AL8、STAT3、CCL2、CXCL8、VEGFA、JUN,并构建前10 位重叠枢纽基因网络图见图4,这些基因是附子治疗AR 的关键基因。

图3 重叠基因的PPI 网络图Fig 3 PPI network diagram of overlapping genes

图4 MCC 算法分析附子治疗AR 的前10 位枢纽重叠基因网络图Fig 4 The top 10 hub gene network of Fuzi therapy in response to Allergic Rhinitis were analyzed using MCC
2.5 GO 功能富集分析
将68 个重叠靶点基因输入DAVID 数据库进行GO 功能富集分析,从而可以说明附子治疗AR 存在多种潜在靶点的生物学功能。GO 功能富集分析图见图5 所示,在GO 功能富集分析中,其中GO 功能富集在BP 方面,选取排位前10 位相关条目,主要涉及转录正调控、一氧化氮生物合成过程正调控、平滑肌细胞增殖、肿瘤坏死因子产生的正调控等。在CC 中,选取排位前10 位相关条目,主要是细胞表面、质膜、蛋白复合物和顶端质膜参与主要的细胞成分。在MF 中,选取排位前10 位相关条目,主要包括与转录调控区的DNA 结合、转录因子的结合、核心启动子近端区的序列特异性的DNA 结合、蛋白质细胞外基质的结合等。

图5 GO 功能富集分析图Fig 5 Evaluation of targets based on the GO
2.6 KEGG 功能富集分析
为了探索附子的活性化合物成分通过靶点基因治疗AR 的作用途径,将附子治疗AR 的共同靶点主要富集在20 条通路上(P<0.05),进一步构建KEGG 功能富集分析图,见图6 所示,包括TNF 信号通路、T 细胞受体信号通路、Toll 样受体信号通路、HIF-1 信号通路等信号通路。选取Toll 样受体信号通路图进行展示,见图7,其中绿色代表共同基因,结合PPI 网络图中核心靶点基因包含了Toll 样受体信号通络中IL-6 和TNF-α 枢纽基因,因此选择该通路进行后续研究。

图6 KEGG 功能富集分析图Fig 6 KEGG functional enrichment analysis diagram

图7 Toll 样受体信号通路图Fig 7 Toll-like receptor signaling pathway
2.7 附子对AR 小鼠鼻黏膜组织病理变化的影响
采用HE 染色法来观察各组小鼠鼻黏膜组织组织学变化结果见图8。正常小鼠组细胞排列整齐,细胞结构完整。与正常组小鼠相比,变应性鼻炎组的鼻黏膜组织表现出不同程度的黏膜完整性的破坏和塌陷,纤维组织增生和炎症细胞浸润的特征。对比变应性鼻炎组,附子组小鼠明显减少了上述的病理改变。
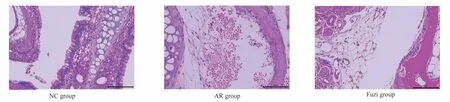
图8 HE 染色法观察各组小鼠鼻黏膜组织学变化(×40)Fig 8 Histological changes of tissues in different experimental mice groups as determined by HE staining(×40)
2.8 蛋白免疫印迹法检测IL-6 和TNF-a 的蛋白表达水平
通过蛋白免疫印迹法检测各组小鼠鼻黏膜中IL-6 和TNF-α 的表达灰度值统计表分别见表2-3。各组小鼠鼻黏膜IL-6 和TNF-α 表达水平的WB 检测结果见图9。结果显示变应性鼻炎组小鼠鼻黏膜的IL-6 和TNF-α 蛋白的表达和正常对照组小鼠相比,差异均具有统计学意义(P<0.000 1)。变应性鼻炎组小鼠鼻黏膜的IL-6 和TNF-α 蛋白表达量高于附子组,差异均具有统计学意义(P=0.000 2;P<0.000 1)。附子组小鼠鼻黏膜中的IL-6 表达与正常对照组相比,不具有统计学差异(P=0.269 7);附子组小鼠鼻黏膜中TNF-α 的表达与正常对照组相比,具有统计学差异(P=0.000 1)。以上结果表明,IL-6 和TNF-α 在小鼠鼻黏膜组织中存在并表达,附子可以通过调节IL-6 和TNF-α 的表达来减少炎症反应,这反过来又证实了网络药理学分析的结果。

图9 各组小鼠鼻黏膜IL-6 和TNF-α 表达水平的WB 检测结果Fig 9 WB results of IL-6 and TNF-α expression levels in the nasal mucosa of mice in each group
2.9 免疫组化法检测IL-6 和TNF-a 的蛋白表达水平
为了证实网络药理学数据的有效性,对各小组小鼠鼻黏膜进行免疫组化检测,各组小鼠鼻黏膜组织IL-6 的表达水平统计表分别见表4、5。各组小鼠鼻黏膜IL-6 和TNF-α 表达水平的免疫组化检测结果见图10。IL-6 和TNF-α 蛋白阳性颗粒大部分存在于细胞膜和细胞浆中,呈棕褐色或棕黄色。正常组小鼠鼻黏膜上皮未受损,未见炎症细胞浸润,而变应性鼻炎组小鼠腺体和黏膜上皮染色较深,鼻黏膜上皮受损,附子组小鼠鼻黏膜损伤明显较轻,腺体增生程度较少,炎症细胞浸润量较少。结果显示变应性鼻炎组小鼠鼻黏膜IL-6 和TNF-α 阳性表达高于正常对照组,具有统计学意义(P<0.001;P<0.001)。附子组小鼠鼻黏膜IL-6 和TNF-α 阳性表达高于正常对照组,具有统计学意义(P<0.05;P<0.05)。附子组IL-6 和TNF-α 表达低于变应性鼻炎组,具有统计学意义(P<0.001;P<0.05)。结果表明,附子改善小鼠鼻黏膜的炎症反应。

图10 各组小鼠鼻黏膜IL-6 和TNF-α 表达水平的免疫组化检测结果Fig 10 Immunohistochemical detection of IL-6 and TNF-α expression levels in the nasal mucosa of mice in various groups
表5 各组小鼠鼻黏膜组织TNF-α 的表达水平统计表(n=10,±s)Tab 4 Statistical table of the expression level of TNF-α in the nasal mucosa tissue of mice in each group(n=10,±s)

表5 各组小鼠鼻黏膜组织TNF-α 的表达水平统计表(n=10,±s)Tab 4 Statistical table of the expression level of TNF-α in the nasal mucosa tissue of mice in each group(n=10,±s)
组别正常对照组变应性鼻炎组附子组TNF-α 0.24±0.08 0.59±0.08 0.32±0.10 FP 43.732<0.001
表4 各组小鼠鼻黏膜组织IL-6的表达水平统计表(n=10,±s)Tab 4 Statistical table of the expression level of IL-6 in the nasal mucosa tissue of mice in each group (n=10,±s)

表4 各组小鼠鼻黏膜组织IL-6的表达水平统计表(n=10,±s)Tab 4 Statistical table of the expression level of IL-6 in the nasal mucosa tissue of mice in each group (n=10,±s)
组别正常对照组变应性鼻炎组附子组IL-6 0.20±0.05 0.53±0.12 0.28±0.17 FP 41.683<0.001
3 讨论
AR 主要是由特应性个体接触过敏原后由IgE介导的炎症性鼻病[24]。在特应性个体中,暴露于室内和室外过敏原(包括花粉、霉菌、尘螨和动物皮屑)可能会促进抗原特异性IgE 的产生。过敏原的重新引入会触发早期和晚期反应,导致AR 的临床表现[25]。中药具有多成分、多靶点和多作用途径的特性,并且中医治疗具有高治愈率和成本低等特点[26],因此越来越多的人选择使用中医药疗法治疗AR[27]。从中医角度来看,中医认为鼻子可以反映肺的生理和病理表现。由于外邪(中医认为是致病因素)经口、鼻侵入人体,侵入鼻腔,损害肺的宣降功能,导致津液失调,导致体液变成痰和黏液。这最终导致AR 的形成[28]。AR 多源于正气不足,在治疗上,一直以益气温阳为主要原则,附子自古是临床治疗虚弱冷综合征AR 的典型中药[29,30],附子辛热温里,助少阴阳气[31],具有提高免疫力和抗炎抗氧化等功能[32]。另一方面,附子治疗AR 的作用机制尚不清楚,应用网络药理学可以研究草药或草药处方的成分、目标、途径和作用模式的复杂性[33],更准确地预测附子治疗AR 的靶点基因和主要作用信号通路。
本研究利用网络药理学来阐明附子在AR 治疗中的潜在生理过程。以OB≥20%和DL≥0.1 的筛选条件下,共筛选出附子的21 种生物活性化合物成分和203 个靶点基因,生物活性化合物成分包括去氧穿心莲内酯、水黄皮素和次乌头碱等,这是附子治疗AR 的主要活性化合物。去氧穿心莲内酯含有二萜内酯、黄酮和多酚[34],在许多研究中,它已被证明具有抗炎特性[35],去氧穿心莲内酯具有二萜内酯和五元内酯环的基本结构发挥抗炎作用[36]。水黄皮素是一种活性呋喃类黄酮,黄酮类化合物是一种抗炎因子。在大鼠模型的研究表明,水黄皮素通过阻断H+和K+ATP 酶而具有抗炎的特性[37]。次乌头碱可以保护上皮细胞免受氧化应激[38]。在小鼠中,次乌头碱已被证明具有有效的抗炎作用,能够抑制环氧合酶-2、肿瘤坏死因子、白细胞介素-1 和前列腺素E2 的产生[39]。
根据各靶点基因的重要程度,我们选择了前10个重要枢纽基因PTGS2、TNF、IL6、AKT1、ALB、STAT3、CCL2、CXCL8、VEGFA、JUN。PTGS2是产生前列腺素家族的关键酶,是非甾体类药物的作用靶点,目前已知可参与细胞炎症、细胞凋亡等生理活动,PTGS2 转录由多个与炎症信号通路相关的细胞因子触发,包括核因子B、激活蛋白1 和CCAAT 增强子结合蛋白[40]。TNF-α 是TNF 家族的成员,可调节细胞死亡,促进细胞质膜破裂导致炎症因子的释放[41]。IL-6 限制了中性粒细胞的产生,并增加了粒细胞的死亡。在AR 中,从快速的宿主防御到适应性持续的全身炎症的变化均与IL-6的促炎作用有关。AKT1 是P13K 信号通路的重要组成部分,促进鼻黏膜细胞存活和增殖[42]。CCL2刺激损伤部位的单核细胞和巨噬细胞的迁移和黏附,当CCL2 与其受体接触时会触发一系列炎症反应。CXCL8 参与组织愈合和血管过程,并通过与白细胞受体结合[43],招募白细胞到炎症和损伤部位。VEGFA 是一种内皮成纤维细胞生长因子,作为血管生成的调节器,可通过控制内皮细胞的完整性和活性,从而产生最佳的血管形态和功能,并刺激动脉内皮细胞和巨噬细胞[44],VEGFA 在AR 中具有抗凋亡和血管完整性的功能。
通过KEGG 富集分析,在HIF-1、Toll 样受体、T 细胞受体和TNF 信号通路中发现了附子治疗AR 相关的枢纽靶点基因。HIF-1 受体信号通路介导的转录调控是对抗缺氧相关细胞应激的重要组成部分,机体在抗感染时,血液循环减慢,促炎性细胞因子和抗原消耗更多的氧气,导致局部缺氧和HIF 的激活。HIF 可以无限期地存在,并参与核转录因子的激活代谢反应,然后可以激活IL-4 产生的巨噬细胞,增强NLRP3 炎性小体的激活,增强IL-1、IL-6 等炎症细胞因子的释放[45]。在AR 小鼠中,由于HIF-1 信号通路的激活,炎症细胞可从鼻黏膜浸润到气道的细胞外环境中[46]。TNF 信号通路是炎症反应的重要通路,虽然它可以导致某些被病毒感染细胞的死亡,但它对正常细胞没有影响,甚至可以刺激它们的发育。T 细胞受体通路是免疫应答的重要组成部分,它们结合外源性肽导致T 细胞的活化,当递质被激活时,CD4+向T 细胞发出信号[47],而CD4+细胞又在AR 的调控中起着重要作用,因此T 细胞受体信号通路在AR 的调控中发挥重要作用。Toll 样受体是Ⅰ型跨膜蛋白天然免疫模式识别受体,可识别自然界中的病原体相关分子模式,启动细胞内信号通路,激活先天免疫反应[48],TLR 信号通路基因的遗传变异会推动炎症和过敏性疾病的进展[49]。从Toll 样信号通路图中显示:IL-6 和TNF-α 是与Toll 样受体信号通路相连的两个枢纽基因,IL-6 和TNF-α 是重要的炎症细胞因子,经常出现在身体炎症反应的各个部位,它们会增强炎症反应,并已被证明与AR 相关[50]。经网络药理学相关数据库及MCC 算法分析附子治疗AR 的前10 个枢纽重叠基因网络图中主要有IL-6 及TNFα。基于上述研究结果,在后续动物实验研究中,对主要靶点基因IL-6 和TNF-α 进行实验验证。实验结果显示,附子主要可以通过抑制小鼠鼻黏膜中Toll 样信号通路的活化,降低IL-6 和TNF-α 的表达活性,从而改善了AR 小鼠的炎症改变。本研究首次探讨了Toll 样受体信号通路(IL-6 和TNF-α)在AR 中的功能和作用,为后续附子治疗AR 研究提供扎实的基础。
综上所述,本研究初步探讨了附子治疗AR 的主要作用机制。从网络药理学基础上探索附子治疗AR 的可能治疗靶点和信号通路,为附子精准治疗AR 提供科学依据,为附子的传承和创新奠定基础。
作者贡献度说明:
牟忠林:构思并设计了该研究和实验;李琳:负责数据收集处理及文章撰写;丁顺、徐正杨、严旌仁、张启萌:负责实验思路及最终文章的修改。
所有作者声明不存在利益冲突关系。

