miR-873 通过靶向Beclin1 基因调控细胞自噬促进支气管上皮细胞炎症与凋亡
陈 洁,林凌桑,李思广,莫濡冰,丁毅鹏,3
(1.海南医学院附属海南医院,海南 海口 570311;2.海南省人民医院全科医学科,海南 海口 570311;3.海南省人民医院呼吸与危重症医学科,海南 海口 570311)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种全球范围内常见的、可预防和治疗的疾病,其特征是持续的呼吸道症状和气流受限。该病病因复杂,主要由长期暴露于有害颗粒或气体所致,导致呼吸道和/或肺泡发生异常[1]。大量研究表明,氧化应激、炎症反应、细胞凋亡、自噬和衰老参与了COPD 的发病机制,其中炎症反应和细胞死亡是慢阻肺最重要的致病因素[2,3]。慢性持续性炎症反应被认为是气道结构损伤、气道重塑和小气道阻塞的机制[4,5]。因此,针对炎症反应和细胞死亡的干预可能成为COPD 治疗的有效策略。
MicroRNAs(miRNAs)是一类长度为18~22 个核苷酸的非编码小RNA,其与目标mRNA 的3'末端非编码区域或编码区结合,参与基因表达调控中的转录后抑制、蛋白质翻译阻止以及mRNA 降解增加等作用[6]。miRNAs 参与了多种生物学过程,包括调控细胞增殖、分化、凋亡、自噬等[7]。大量研究表明,miRNAs 参与调节与肺功能和炎症有关的多个基因的转录[8,9]。本研究将围绕miR-873 通过靶向Beclin1基因调控细胞自噬促进支气管上皮细胞炎症与凋亡这一新角度,阐述COPD 发生发展机制中miRNA 与自噬的关联,为深入理解COPD 的发生发展机制提供理论依据,并为临床干预COPD 进展提供新思路。
1 材料与方法
1.1 试剂
人支气管上皮细胞16HBE 株购自中科院上海细胞库;胎牛血清、MEM 培养基、青霉素/链霉素和胰酶试剂购自Invitrogen;人白介素2(IL-2)、白介素6(IL-6)、人白介素10(IL-10)和人肿瘤坏死因子α(TNF-α)的ELISA 试剂盒购于上海仁捷生物;BCA法蛋白质定量检测试剂盒、CCK-8 试剂盒和TUNEL 染色试剂盒购自碧云天生物公司;逆转录试剂盒(P312)和实时荧光定量PCR(Q331)购于南京诺唯赞生物;Beclin1 和LC-3 一抗购自Abcam 公司;二抗购自武汉博士德生物工程有限公司;双荧光素酶报告基因购自上海吉玛基因(GenePharma)。
1.2 16HBE 细胞培养
16HBE 细胞在含有10%胎牛血清的MEM 培养基中进行培养,保持恒定的37 ℃和5%CO2气体条件。细胞每2~3 d 传一次代。
1.3 miR-873 mimic 转染16HBE 细胞
将16HBE 细胞以2 × 105个/孔的密度接种于6孔板,置于37 ℃和5%CO2培养24 h 后,miR-873 mimic(150 ng)使用100 μL 无血清MEM 稀释,制成终浓度5 nmol 的溶液。然后将其与12 μL HiPer-Fect 转染试剂混合,室温下静置10 min,形成转染复合物。将得到的转染溶液加入每个含有2 mL 培养基孔中。细胞在37 °C 下培养72 h 后进行后续实验。
1.4 qRT-PCR 检测
转染后的16HBE 细胞使用Trizol 试剂提取综RNA,用NanoDrop 2000 (美国赛默飞)评估提取RNA 的浓度和纯度。使用逆转录试剂盒将RNA 逆转录成cDNA,在ABI 7500QPCR 仪上进行qPCR反应,反应条件为:95 ℃预变性5 min,95 ℃变性5 s,62 ℃复性20 s,72 ℃延伸30 s,40 个循环。分别以U6 和GAPDH 为内参,采用2-ΔΔct法计算miR-873 和Beclin1的表达量。miR-873 上游引物:5′-GCAGGAACUUGUGAGUCUCCU-3′,miR-873 下游引物:5′-AGGAGACUCACAAGUUCCUGC-3′;U6上游引物:5′-GCTTCGGCAGCACATATACTAA-3′;U6 下游引物:5′-AACGCTTCACGAATTTGCGT-3′;GAPDH 上游引物:5′-TGTGTCCGTCGTGGATCTGA-3′;下 游 引 物 :5′-CCTGCTTCACCACCTTCTTGA-3′;Beclin1上游引物:5′-CAGTACCAGCGGAGTAGTGA-3′;Beclin1 下游引物:5′-TGTGGAAGGTGGCATTGA AGA-3′。
1.5 CCK-8 法检测16HBE 增殖
将转染后的16HBE 和对照组细胞以1 000 个/孔的密度接种于96 孔板,置于37 ℃、5% CO2的培养箱中培养48 h。然后向每个孔中加入10 μL CCK-8 试剂(注意设置对照孔和空白背景孔),在避光条件下37 ℃孵育2 h。使用分光光度计,在450 nm 波长下测量各孔的吸光度值。计算细胞增殖率时,采用以下公式:细胞增殖率 = (实验组吸光度值 - 背景值)/(对照组吸光度值 - 背景值)×100%。
1.6 ELISA 试剂盒检测
将转染后的16HBE 和对照组细胞以2 × 105个/孔的密度接种于6 孔板,置于37 ℃和5%CO2培养48 h,使用蛋白裂解液收集细胞上清备用。提前30 min 取出试剂盒平衡至室温。实验时,标准品加入100 μL 的标准品;空白对照孔加入100 μL 的蒸馏水;其余微孔中加入100 μL 的细胞上清液,按照ELISA 试剂盒说明书进行操作,在450 nm 波长读取各孔的OD 值。
1.7 TUNEL 染色检测凋亡
将经75%酒精浸泡处理并晾干的载玻片放置于6 孔板中,以每孔2 × 105个细胞密度接种转染后的16HBE 细胞和对照组细胞。在37 ℃和5%CO2的培养条件下孵育48 h,随后用PBS 进行冲洗,并使用4% PFA 进行固定20 min。加入含有0.1%Triton X-100/0.1%钠柠檬酸的溶液孵育10 min,接着使用蛋白酶K 孵育10 min。将TdT 反应混合液滴加到样品中进行孵育1 h,该混合液包括TdT 酶、dUTP-biotin 标记物和缓冲液,孵育温度为37 ℃。最后,在样品中滴加streptavidin-荧光素进行避光室温孵育15 min。使用PBS 进行洗涤后,使用荧光显微镜观察样品并记录结果。
1.8 免疫荧光检测LC-3 表达
细胞处理方法参考TUNEL 染色,使用0.1%Triton X-100 打孔后,随后使用3%BSA 溶液室温孵育1 h 对细胞进行封闭处理。处理完毕后用PBS 进行冲洗,并加入LC-3 一抗于样品中4℃过夜孵育。第二天使用PBST 溶液4 次冲洗样品,每次5 min。然后在室温下加入荧光素标记的二抗,进行为期2 h的孵育。最后,使用DAPI 避光37 ℃染色15 min,再次洗涤后封片,置于荧光显微镜下观察样品并记录结果。
1.9 Western blot 检测Beclin1 表达
将转染后的16HBE 和对照组细胞以3×105个/孔的密度接种于6 孔板,置于37 ℃和5%CO2培养48 h,使用PBS 冲洗细胞一次,每孔加入150 μL 体积含1%蛋白酶和磷酸酶抑制剂的裂解液来裂解细胞,并使用BCA 法检测蛋白质的浓度。随后,使用5X SDS-PAGE loading buffer 将蛋白变性,并置于100 ℃水浴10 min。接着,蛋白经SDS-PAGE 电泳分离,并将其转移至硝酸纤维素膜(PVDF)上,置于5%脱脂牛奶室温封闭2 h,加入Beclin1一抗置于4 ℃过夜孵育。第2 天,回收一抗,PBST 清洗6 次,每次8 min。接着用二抗室温孵育蛋白条带1 h。回收二抗PBST 清洗后,通过ECL 显色技术进行信号检测。使用Quantity One 4.52 图像分析软件进行图像分析,以GAPDH 为内参计算蛋白的相对表达量。
1.10 双荧光素酶报告基因实验
本研究在293T 细胞中进行双荧光素酶报告基因实验,将Beclin1的野生型3'非翻译区(UTR)及其突变体插入到pMIR-RB-REPORT ™荧光素酶mRNA 表达报告载体中。接着,以5×104个/孔的密度将293T 细胞接种在6 孔板中,并使用Lipofectamine 2000 转染以下4 组:Beclin1-WT 和miR-NC、Beclin1-WT 和miR-873、Beclin1-MUT 和miR-NC、Beclin1-MUT 和miR-873。转染48 h 后,使用荧光分光光度计对Firefly 和Renilla 荧光素酶活性进行评估,并将其归一化为Renilla 荧光素酶活性。
1.11 统计学处理
使用统计软件GraphPad Prism 9.0 进行数据统计分析时,对于符合正态分布的计量资料,采用样本均值±标准差(±s)的方式进行表示。两组样品比较采用t检验,多组样品比较采用单因素方差分析。若数据符合正态分布且方差齐,则使用最小显著性差异法(LSD)进行两两比较;若方差不齐,则采用Dunnett’s T3 法进行多重比较。P<0.05 表示差异具有统计学意义。
2 结果
2.1 miR-873 抑制支气管上皮细胞增殖并促进其炎症反应
使用miR-873 mimic 转染16HBE 细胞24 h,使用qRT-PCR 检测显示,与对照组相比,miR-873 mimic 转染组16HBE 细胞中miR-873 的mRNA 水平显著上升(3.44±0.10vs1.03±0.09,P<0.001,t=24.42),见图1A,表明miR-873 mimic 成功转染16HBE 细胞。
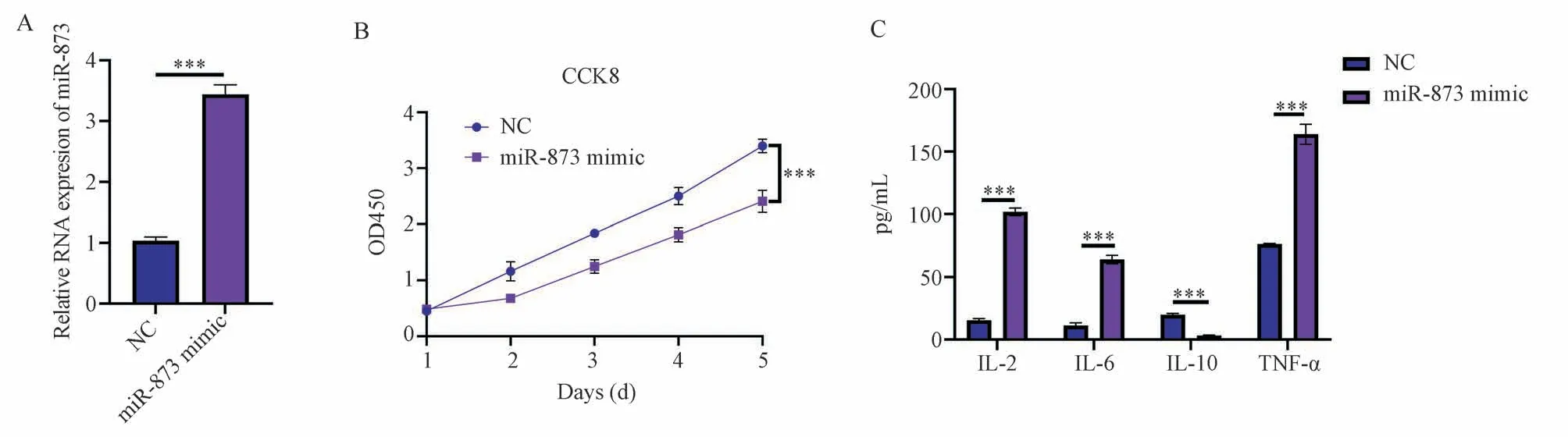
图1 miR-873 上调促进支气管上皮细胞炎症Fig 1 Upregulation of miR-873 promotes inflammation in bronchial epithelial cells
使用miR-873 mimic 转染16HBE 细胞24 h,使用CCK-8 检测16HBE 细胞活性。CCK-8 检测结果显示,与对照组相比,miR-873 mimic 转染组16HBE细胞从第二天开始增殖活性显著下降(第2 天:0.68±0.06vs1.16±0.170,P<0.001,t=6.39;第3天:1.25±0.12vs1.84±0.05,P<0.001,t=7.86;第4 天:1.81±0.13vs2.5±0.16,P<0.001,t=9.10;第5 天:2.41±0.20vs3.40±0.12,P<0.001,t=13.11),见图1B,表明miR-873 mimic 抑制支气管上皮细胞增殖活性。
使用miR-873 mimic 转染16HBE 细胞24 h,ELISA 检测16HBE 细胞上清液中炎症因子IL-2、IL-6、IL-10、TNF-α 的表达。结果显示,与对照组相比,miR-873 mimic 转染组16HBE 细胞上清中炎症因子 IL-2(101.84±3.15vs15.36±1.422,P<0.001,t=30.65)、IL-6(64.01±3.43vs11.19±2,21,P<0.001,t=18.72)、TNF-α(163.93±8.01vs76.37±0.56,P<0.001,t=31.04)的表达量显著上升,而IL-10(3.3±0.21vs19.72±1.26,P<0.001,t=5.82)的表达量显著下降,见图1C,表明miR-873 mimic 诱导支气管上皮细胞炎症反应。
2.2 miR-873 促进支气管上皮细胞凋亡
TUNEL 染色结果显示,与对照组相比,miR-873 mimic 转染16HBE 细胞24 h 明显提高16HBE 细胞的凋亡数量,见图2,表明miR-873 mimic 促进支气管上皮细胞凋亡。

图2 miR-873 上调促进支气管上皮细胞凋亡Fig 2 Upregulation of miR-873 promotes apoptosis in bronchial epithelial cells
2.3 miR-873 促进支气管上皮细胞自噬
免疫荧光染色结果显示,与对照组相比,miR-873 mimic 转染16HBE 细胞24 h 明显降低16HBE 细胞中LC-3 染色,见图3,表明miR-873 mimic 抑制支气管上皮细胞发生自噬。
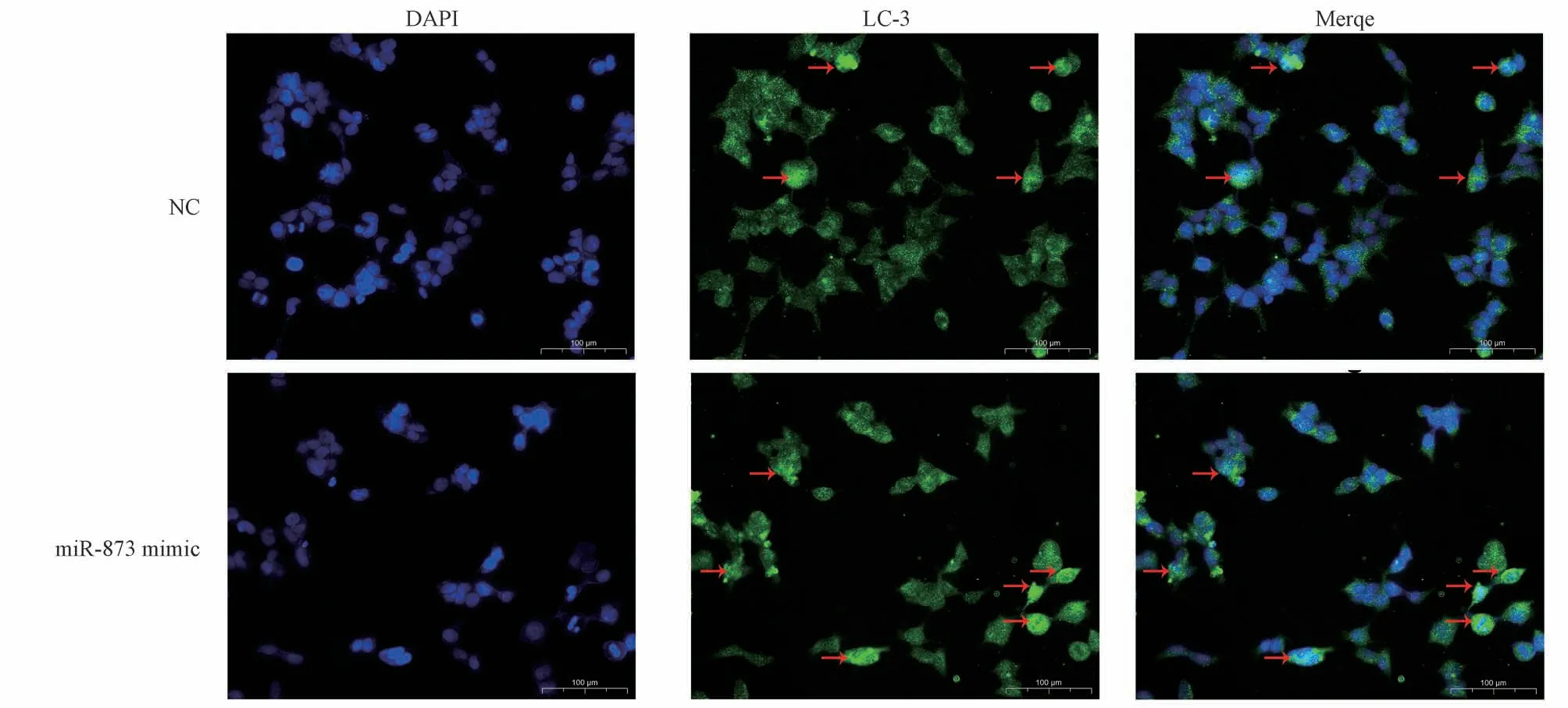
图3 miR-873 上调达抑制支气管上皮细胞自噬Fig 3 Upregulation of miR-873 suppresses autophagy in bronchial epithelial cells
2.4 miR-873 靶向结合Beclin1 并抑制其表达
使用miR-873 mimic 转染16HBE 细胞24 h,qRT-PCR 检测显示miR-873 mimic 转染组16HBE细胞中Beclin1 的mRNA 水平显著下降,(0.41±0.08vs1.02±0.13,P<0.001,t=21.67),见图4A。Western blot 检测显示,与对照组相比,miR-873 mimic 转染16HBE 细胞24 h 显著抑制Beclin1的蛋白表达(0.34±0.04vs0.78±0.09,P<0.001,t=14.48),见图4B。上述结果说明miR-873 能够靶向调控Beclin1 的mRNA 和蛋白表达。

图4 miR-873 靶向结合Beclin1 抑制Beclin1 表达Fig 4 miR-873 binds to Beclin1 to inhibit its expression
Targetscan 数据库预测显示miR-873 与Beclin1的3'UTR 存在互补结合位点,见图4C。将含有Beclin1 3'UTR 结合位点的荧光素酶报告载体分别与miR-873 模拟物、miR-873 抑制剂共转染到16-HBE细胞中,培养24 h 共同测试荧光素酶活性,结果显示,Beclin13'-UTR-WT 和miR-873 的共转染显著抑制了荧光素酶活性(0.35±0.06vs1.03±0.26,P<0.001,t=11.17),而Beclin1 3'-UTR-MUT 和miR-873 共转染对荧光素酶活性无明显影响,见图4D,表明Beclin1的3'UTR 与miR-873 存在结合位点。上述结果提示,miR-873 通过靶向结合Beclin1抑制其mRNA 和蛋白表达。
3 讨论
COPD 是一种常见的呼吸系统疾病,其发病机制非常复杂[2]。近年来,越来越多研究表明microRNA(miRNA)在COPD 进展中起到重要作用。研究证实,miR-21 可通过下调SATB1/S100A9/NF-κB信号通路诱导巨噬细胞、中性粒细胞和淋巴细胞活化,激活炎症反应,加剧COPD 的进展[10]。miR-223在COPD 患者和烟雾诱导的小鼠肺中高表达,通过调免疫细胞浸润介导COPD 的进展[11]。同时,miR-125a-5p 通过抑制Sp1/SIRT1/HIF-1a 通路抑制吸烟诱导的COPD/肺气肿肺上皮细胞衰老,从而加速COPD 的进展[12]。miR-150 对烟雾诱导的肺部炎症具有保护作用,能减弱香烟提取物诱导的气道上皮凋亡[8]。miR-125b 作为低氧调节的miRNA 通过调节呼吸道上皮细胞的凋亡诱导肺组织损伤,参与慢阻肺病的急性加重[9]。miR-126 促进炎症因子的释放,导致急性和慢性呼吸道炎症,引起可逆性气道限制、气道重塑和气道高反应性等病理生理变化,从而加重慢阻肺病患者的疾病严重程度[13]。本研究中发现miR-873 mimic 转染支气管上皮细胞16HBE 后,显著抑制其增殖活性,促进其凋亡,并诱导炎症因子IL-2、IL-6 和TNF-α 的分泌,同时抑制IL-10 的分泌。这些结果表明,miR-873 通过调控支气管上皮细胞的凋亡和炎症反应参与调控COPD进展。
自噬是一种保守的溶酶体降解途径,其特点是通过动态降解和再加工细胞成分来维持生理内稳态[14]。自噬作为一种细胞保护机制,可以保护多种疾病,尤其是肿瘤、心血管疾病、神经退行性疾病和感染性疾病。但过度激活的自噬会扰乱细胞内稳态并导致细胞死亡[15]。此外,有研究表明自噬在呼吸系统疾病的发病机制中也起到了一定作用,如COPD、哮喘和肺功能衰竭[16]。miRNA 作为调节基本生物学过程的重要因子之一,也参与了自噬的调控。例如,miR-214-3p 通过直接靶向ATG5 的3'UTR,调节HUVECs 细胞中ox-LDL 引发的自噬,从而参与了动脉粥样硬化的调控[17]。上调miR-93则通过抑制自噬增强IR 和TMZ 对脑胶质母细胞瘤的杀伤作用[18]。此外,上调miR-29c-3p 通过靶向调控FOXP1/ATG14 来抑制自噬增强顺铂对卵巢癌的杀伤作用[19]。在本研究中发现上调miR-873 能够显著减少支气管上皮细胞中LC-3 的表达,这表明miR-873 也具有抑制自噬的功能。
miRNA 是一类通过与mRNA 结合来影响靶基因表达的小分子RNA,参与调节细胞生命活动和发育等多个生理过程[20]。miRNA 通过与Argonaute蛋白结合形成RISC 复合物,在细胞质中与mRNA的3'非翻译区(3' UTR)相互结合。一方面,miRNA-RISC 复合物可以促进mRNA 降解,导致靶基因的表达量下降;另一方面,miRNA-RISC 复合物也可以抑制mRNA 的翻译过程,使靶基因的蛋白质合成减少[21]。Beclin1不仅参与自噬体的形成,还可通过调节自噬活性对肿瘤发生、发展起着重要作用[22]。Bcl-2 家族蛋白Bcl-2、Bcl-xL 和Mcl-1 是抗凋亡蛋白,可以结合Beclin 1的Bcl-2 同源3(硼烷)结构域,对自噬发挥变阻器作用。在正常情况下,Beclin 1与Bcl-2 结合。当与Bcl-2 分离时,Beclin 1可以与Vps15、Vps34(也称为Ⅲ型PI3K)和其他蛋白如Ambra1 形成PI3KC3 复合物,以调节自噬的起始[23]。研究表明,miR-837-5p 可通过靶向抑制Beclin1的水平抑制肺癌细胞的生长、侵袭和血管生成,从而发挥抑制肺癌转移的作用[24]。本研究利用Targetscan 数据库预测和双荧光素酶报告基因验证了miR-873 与Beclin1的结合位点,并证实miR-873 mimic 能够靶向抑制Beclin1的mRNA 和蛋白表达。得出结论:miR-873 可能通过靶向抑制Beclin1基因,抑制支气管上皮细胞的自噬,促进支气管上皮细胞炎症和细胞凋亡,参与COPD 的发生和发展。
作者贡献度说明:
陈洁:双荧光素酶实验与写稿;林凌桑:细胞培养与转入;李思广:细胞增殖、凋亡与自噬检测;莫濡冰:RT-PCR 与western blot 检测;丁毅鹏:审稿与经费支持。
所有作者声明不存在利益冲突关系。

