牛蒡多糖酶法提取工艺及其体外抗氧化活性
陈飞 ,丁朋,丁利,付婷伟,陈安徽,邵颖*
1. 徐州工程学院食品(生物)工程学院(徐州 221111);2. 江苏诺普乐生物科技有限公司(徐州 221116);3. 徐州天益食品科技研究院有限公司(徐州 210009)
牛蒡,菊科牛蒡属草本植物,俗称“东洋参”“大力子”“牛鞭菜”,是具有较高营养价值的药食用食材,享有“蔬菜之王”的美誉[1-2]。牛蒡根中富含膳食纤维、胡萝卜素、蛋白质、钙、铁等营养成分,及多糖、多酚、黄酮等生物活性因子,具有抗菌、降糖降脂、抗突变、利尿、促胆汁分泌等功效,可用于治疗风湿、痛风等血液性疾病及皮肤炎症[3-5]。牛蒡根因丰富的营养价值及多效的生理活性而越来越受到关注,作为在我国具有较高产量的蔬菜,牛蒡显现出巨大的开发利用潜力,其食用、保健、药用等方面的系统研究也逐渐成为研究热点[6-7]。
牛蒡多糖是牛蒡根中主要的生物活性成分,在抗氧化、防衰老、抗炎、免疫调节、抗癌、降血糖、调节肠道菌群平衡等方面均有一定功效[8-10],其常用提取方法包括热水浸提法、超声辅助提取法、微波辅助提取法、酸碱浸提法和酶解法[11]。酶解法的高效、温和、节能、不易破坏活性物质等优点使其在蛋白质、多肽、多糖等活性物质的提取中被广泛使用[12-13]。试验优化牛蒡根多糖的酶法提取工艺并探讨牛蒡根多糖的体外抗氧化活性,为牛蒡的精深加工开拓路径,同时为牛蒡多糖的产业化提供技术支撑。
1 材料与方法
1.1 材料与试剂
新鲜带皮牛蒡干燥切片[天益食品(徐州)有限公司];纤维素酶(10万 U/g,食品级);葡萄糖标准品(分析纯,天津市福晨化学试剂厂);DPPH试剂(美国Sigma公司);菲咯嗪(Ferrozine,分析纯,上海市源叶生物科技有限公司);浓硫酸(分析纯,上海华科试剂有限公司);氯化亚铁(分析纯,广东光华化学厂);氯仿、正丁醇(分析纯,国药集团化学试剂有限公司);苯酚(分析纯,西陇科学股份有限公司);30%过氧化氢(H2O2,Aladdin公司)。其余试剂均为分析纯。
1.2 仪器与设备
紫外-可见光分光光度计(UV2802PC,上海精密仪器仪表有限公司);高速离心机(TUMEN TL-15,江苏图门离心机厂);电子天平(梅特勒AE200,上海分析仪器厂);循环水式多用真空泵(SHB-ⅢS,郑州长城科工贸有限公司);旋转蒸发仪(R501,上海申胜生物技术有限公司);真空冷冻干燥机(LGJ-10,上海比朗仪器有限公司)。
1.3 试验方法
1.3.1 牛蒡多糖提取率的测定
1.3.1.1 葡萄糖标准曲线的绘制
准确称取100 mg高温烘干至无水恒重的葡萄糖于100 mL容量瓶中,配成1 mg/mL的标准溶液,继而用蒸馏水分别配成0,0.02,0.04,0.06,0.08,0.10,0.12和0.14 mg/mL的葡萄糖溶液。分别取1 mL不同质量浓度的葡萄糖标准溶液于刻度试管中,分别加入1 mL 6%苯酚溶液,并迅速加入5 mL浓硫酸,静置10 min,摇匀后室温下静置20 min,用蒸馏水替代葡萄糖标准溶液做空白对照。测定各溶液在波长490 nm条件下的吸光度,以葡萄糖标准溶液质量浓度为横坐标,吸光度为纵坐标,制作标准曲线。标准曲线如图1所示,曲线回归方程为y=6.926 4x+0.156,相关系数R2=0.998 4,样品质量浓度在0.02~0.14 mg/mL范围内呈线性相关。
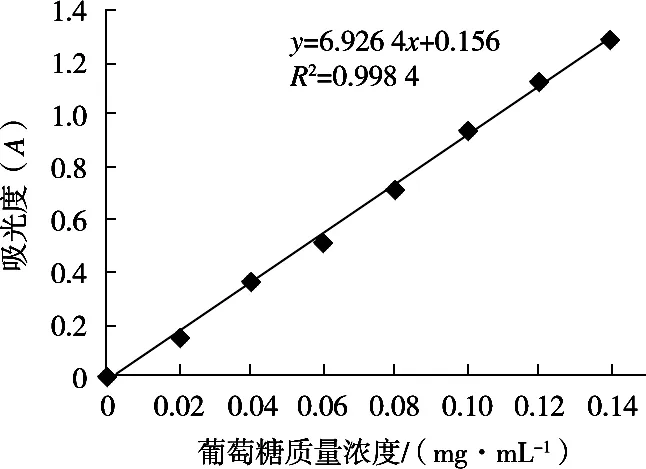
图1 葡萄糖标准曲线
1.3.1.2 牛蒡多糖提取率的测定
将牛蒡干切片研磨过0.850 mm孔径(20目)筛。牛蒡粉采用酶解、离心、醇沉、离心、复溶、去蛋白、醇沉、离心、冷冻干燥的流程获取牛蒡粗多糖。准确称取50 mg牛蒡粗多糖,准确定容至500 mL容量瓶。取1 mL粗多糖溶液于试管中,加入1 mL的6%苯酚,迅速加入5 mL浓硫酸,静置10 min后摇匀。将试管于40 ℃恒温水浴锅中水浴保温15 min,然后测定溶液于490 nm波长处的吸光度。每个样品设置3个重复,将测定出的溶液吸光度代入葡萄糖标准曲线计算多糖的质量浓度,并按照式(1)计算多糖的提取率。
式中:W为牛蒡粉质量,g;C为牛蒡多糖质量浓度,mg/mL;V为牛蒡多糖溶液体积,mL;F为测定用牛蒡多糖溶液的稀释倍数;0.9为葡萄糖换算成多糖的校正系数。
1.3.2 牛蒡多糖提取工艺优化
1.3.2.1 酶解时间对牛蒡多糖提取率的影响
准确称取5份牛蒡粉,按照1∶20(g/mL)的比例加入蒸馏水,根据牛蒡粉质量加入0.4%的10万 U/g纤维素酶,并于40 ℃恒温水浴锅中酶解40,60,80,100和120 min。获得的酶解液于沸水浴中灭酶处理并冷却后在4 000 r/min的条件下离心10 min,收集上清液。将加入95%乙醇且终浓度达到80%的上清液在4 ℃条件下静置10 h。在4 000 r/min条件下离心10 min后收集沉淀,沉淀冷冻干燥后复溶,加入除蛋白试剂(V正丁醇∶V氯仿=1∶4),使其最终浓度达到25%,充分振荡1 h左右,在4 000 r/min条件下离心10 min,收集水层。再次加入95%乙醇使其终浓度达到80%,并在4 ℃条件下静置10 h,在4 000 r/min条件下离心10 min,收集沉淀,沉淀冷冻干燥后测定多糖提取率。每个样品设置3个重复。
1.3.2.2 料液比对牛蒡多糖提取率的影响
准确称取5份牛蒡粉,分别按照料液比为1∶10,1∶15,1∶20,1∶25和1∶30(g/mL)的比例加入蒸馏水,根据牛蒡粉质量加入0.4%的10万 U/g的纤维素酶并于40 ℃恒温水浴锅中酶解80 min。获得的酶解液于沸水浴中灭酶处理并冷却后在4 000 r/min的条件下离心10 min,收集上清液。后续提取及测定流程同1.3.2.1的方法。
1.3.2.3 加酶量对牛蒡多糖提取率的影响
准确称取5份牛蒡粉,按照1∶20(g/mL)料液比加入蒸馏水,根据牛蒡粉质量分别加入0.2%,0.4%,0.6%,0.8%和1.0%的10万 U/g的纤维素酶并于40 ℃恒温水浴锅中酶解80 min。获得的酶解液于沸水浴中灭酶处理并冷却后在4 000 r/min的条件下离心10 min,收集上清液。后续提取及测定流程同1.3.2.1的方法。
1.3.2.4 酶解温度对牛蒡多糖提取率的影响
准确称取5份牛蒡粉,按照1∶20(g/mL)料液比加入蒸馏水,根据牛蒡粉质量加入0.4%的10万 U/g的纤维素酶并分别于30,40,50,60和70 ℃恒温水浴锅中酶解80 min。获得的酶解液于沸水浴中灭酶处理并冷却后在4 000 r/min的条件下离心10 min,收集上清液。后续提取及测定流程同1.3.2.1的方法。
1.3.2.5 牛蒡多糖提取工艺优化
采用正交试验法优化牛蒡多糖提取工艺。在单因素试验基础上,以酶解时间(min)、料液比(g/mL)、加酶量(%)和酶解温度(℃)为因素,采用正交设计软件设计四因素三水平的正交试验方案L9(34)以确定多糖的最佳提取条件。试验因素与水平表如表1所示。每个样品设置3个重复。

表1 正交试验因素水平表
1.3.3 牛蒡多糖体外抗氧化活性测定
1.3.3.1 还原力的测定
将冻干的牛蒡粗多糖配制成梯度浓度的多糖溶液(0.2~1.4 mg/mL),取2 mL各浓度的多糖溶液,加入2 mL 0.2 mol/L pH 6.6的磷酸缓冲液,加入2 mL 1%(W/W)铁氰化钾溶液,振荡摇匀,置于50 ℃水浴锅中保温20 min后加入2 mL 10%(W/W)三氯乙酸溶液,混匀后以3 000 r/min离心10 min。离心后吸取2 mL的上清液,加2 mL去离子水和0.4 mL 0.1%(W/W)FeCl3溶液,振荡摇匀后在50 ℃水浴条件下保温10 min,体系溶液的颜色由黄色变成蓝色时,测定溶液于波长700 nm处的吸光度A700nm。空白对照用蒸馏水代替样品,以稀释至不同质量浓度(0.02~0.1 g/L)的VC作为阳性对照。
1.3.3.2 DPPH自由基清除能力测定
将牛蒡粗多糖配制成梯度浓度(0.2~1.4 mg/mL)的溶液。准确量取1.5 mL各浓度多糖溶液,加入1.5 mL含0.2 mmol/L DPPH的95%乙醇,充分混匀后在室温下避光静置30 min,于波长517 nm处测定溶液吸光度。以稀释至不同质量浓度(0.01~0.5 g/L)的VC作阳性对照。DPPH自由基清除率按照式(2)计算。
式中:Ac为对照组吸光度,即1.5 mL蒸馏水+1.5 mL含 DPPH的95%乙醇;Ai为样品组吸光度,即1.5 mL多糖溶液+1.5 mL含DPPH的95%乙醇;Aj为空白组吸光度,即1.5 mL多糖溶液+1.5 mL 95%乙醇。
1.3.3.3 超氧阴离子清除能力测定
量取6 mL pH 8的Tris-HCl缓冲液,在25 ℃水浴条件下预热20 min,加入1 mL配制好的不同梯度浓度的多糖溶液和1 mL 6 mmoL/L的邻苯三酚溶液并充分混匀,混合液在40 ℃水浴条件下保温10 min,加入1 mL浓盐酸终止反应。测定溶液于波长325 nm处吸光度。以蒸馏水代替多糖溶液作为空白组。O2-清除率按式(3)计算。
式中:Aj为空白组吸光度,即未加多糖样品的溶液吸光度;Ai为样品组吸光度,即加入多糖样品的溶液吸光度。
1.3.3.4 羟自由基清除能力测定
采用邻二氮菲比色法测定。损伤组:量取0.5 mL 0.75 mmol/L邻二氮菲无水乙醇溶液,加入1 mL 0.2 mol/L pH 7.40的磷酸盐缓冲液,加入0.5 mL去离子水,振荡混匀后加入0.5 mL 0.75 mmol/L的FeSO4,混匀后加入0.5 mL 0.01%(V/V)的H2O2,在37 ℃条件下水浴保温60 min,测定波长536 nm处的吸光度,记为A损。未损伤组:以0.5 mL的去离子水代替损伤管中的H2O2重复上述操作步骤,测定的吸光度记为A未损。样品组:量取0.5 mL 0.75 mmol/L邻二氮菲无水乙醇溶液,加入1 mL 0.2 mol/L pH 7.40的磷酸盐缓冲液,加入0.5 mL去离子水,振荡混匀后加入0.5 mL 0.75 mmol/L的FeSO4,充分混匀后加入0.5 mL 0.01%(V/V)的H2O2,在37 ℃条件下水浴保温60 min,测定波长536 nm处的吸光度,记为A样。
样品参比溶液:取1 mL 0.2 mol/L pH 7.40的磷酸盐缓冲液,加入0.5 mL多糖溶液,混合后加入1.5 mL去离子水,测定波长536 nm处的吸光度,记为A参。空白参比溶液:取1 mL 0.2 mol/L pH 7.40的磷酸盐缓冲液,加入2 mL去离子水,作为空白管,用于调零,其在536 nm波长处的吸光度记为A空。羟基自由基清除率按式(4)计算。
式中:A样为样品组吸光度;A参为样品参比溶液吸光度;A损为损伤组吸光度;A未损为未损伤组吸光度;A空为空白对照组吸光度。
1.4 数据处理
使用SPSS 24.0软件对数据进行处理。试验数据均以平均值±标准差的形式表示。
2 结果与分析
2.1 牛蒡多糖提取工艺优化
2.1.1 酶解时间对多糖提取的影响
采用1.2.3.1的方法探讨酶解时间对牛蒡多糖提取的影响,试验结果如图2所示。
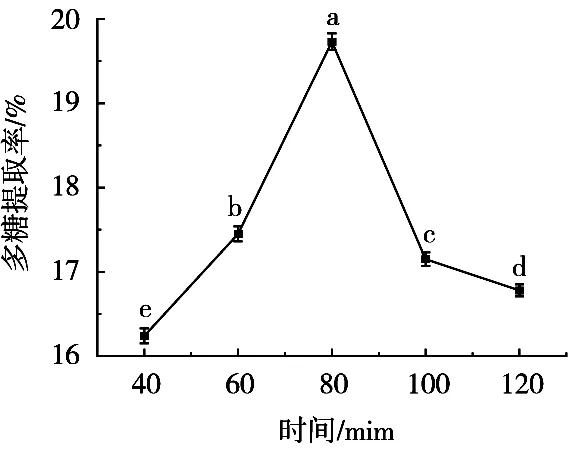
图2 酶解时间对牛蒡多糖提取的影响
酶解时间会对牛蒡多糖的提取产生显著的影响。酶解时间在40~120 min范围内,多糖提取率呈现先升高后降低趋势,酶解时间80 min时,牛蒡多糖提取率达到最大19.78%±0.63%,显著高于其他条件下的提取率(P<0.5)。这可能是因为80 min时酶解反应和浸提效果达到最佳状态,而超过80 min酶解体系中纤维素酶的活性受到影响而导致多糖提取率下降。
2.1.2 料液比对多糖提取的影响
提取料液比对牛蒡多糖提取率的影响如图3所示。提取料液比对多糖提取率的影响较明显。随着提取溶剂的增加,多糖提取率先上升后降低,料液比1∶20(g/mL)时提取率最高,达到20.49%±0.46%,显著高于其他料液比条件的多糖提取率(P<0.05)。因此多糖提取的最优料液比为1∶20(g/mL)。
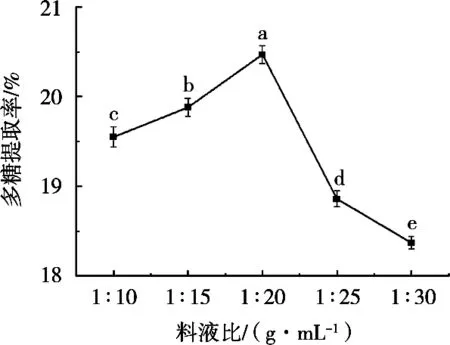
图3 料液比对牛蒡多糖提取的影响
2.1.3 加酶量对多糖提取的影响
加酶量对牛蒡多糖提取率的影响结果如图4所示。纤维素酶添加剂量在0.2%~1.0%范围内,牛蒡多糖的提取率呈先升高后降低的变化趋势。酶添加剂量0.4%时,多糖提取率最高,为20.12%±0.35%,继续增加纤维素酶的使用剂量反而会降低多糖的提取率。因此适宜的牛蒡多糖提取的酶的最佳添加剂量为0.4%。
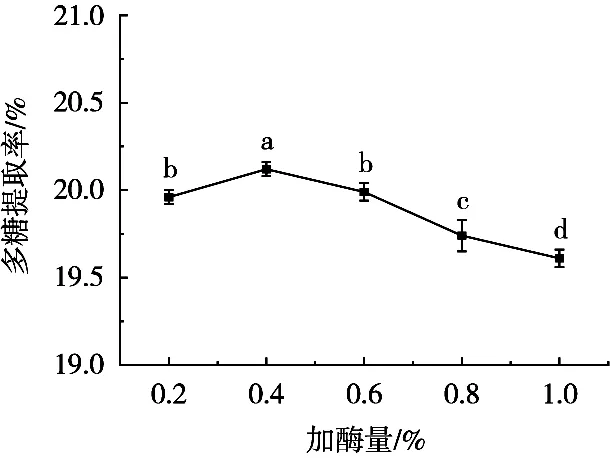
图4 加酶量对牛蒡多糖提取的影响
2.1.4 酶解温度对多糖提取的影响
酶解温度对牛蒡多糖提取的影响结果如图5所示。在30~70 ℃的温度范围内,起初随着酶解温度的升高,牛蒡多糖提取率显著提高,在40 ℃时提取率为21.67%±0.81%,达到最高,随着酶解温度继续升高,多糖提取率显著下降。出现这种现象的原因应该与温度对酶影响特点有关,40 ℃应该是酶的最适酶解温度,温度超过60 ℃后,酶会随着温度的升高而逐渐失活,酶解能力也会随之显著下降。

图5 酶解温度对牛蒡多糖提取的影响
2.1.5 牛蒡多糖提取正交试验
在料液比、加酶量、酶解温度、酶解时间的单因素试验基础上,设计以牛蒡多糖提取率为指标的正交试验。试验结果及正交分析表如表2和表3所示。

表2 正交试验表
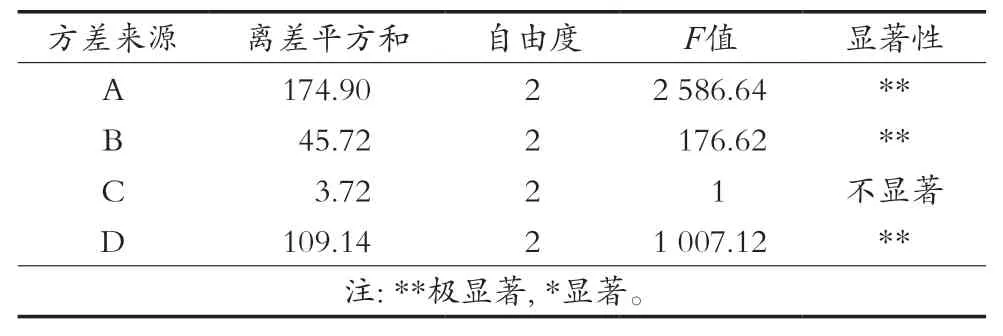
表3 方差分析表
由表2的结果可知,影响牛蒡多糖提取率的因素次序为A>D>B>C,即料液比>酶解时间>加酶量>酶解温度,最佳的提取组合为A3B2C2D3,即料液比1∶20(g/mL)、酶解时间80 min、加酶量0.4%、酶解温度40 ℃。方差分析表显示影响因素料液比、酶解时间和加酶量对牛蒡多糖提取率的影响均达到极显著水平(P<0.01)。在最优组合下进行验证试验,牛蒡多糖提取率达到39.55%±1.32%,显著高于正交试验结果最大值36.17%±0.91%(P<0.05)。因此,牛蒡多糖的最佳提取工艺为料液比1∶20(g/mL)、酶解时间80 min、加酶量0.4%、酶解温度40 ℃。
2.2 牛蒡多糖体外抗氧化活性
2.2.1 牛蒡多糖还原力的测定
牛蒡多糖还原能力的结果如图6所示。牛蒡多糖在0.2~1.4 mg/mL质量浓度范围内,多糖还原力随着多糖浓度的提高而逐渐增加,多糖质量浓度1.4 mg/mL时,吸光度为0.84,且还原力与多糖浓度间呈现一定正相关性。说明牛蒡多糖具有还原能力。
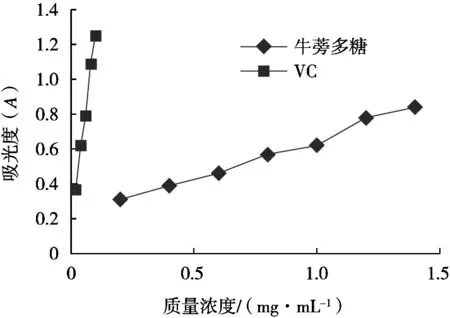
图6 牛蒡多糖的还原力
2.2.2 牛蒡多糖DPPH自由基清除活性
以VC为阳性对照测定牛蒡多糖对DPPH自由基清除活性的影响,结果如图7所示。

图7 牛蒡多糖对DPPH自由基清除率的影响
牛蒡多糖对DPPH自由基具有明显的清除作用。多糖质量浓度在0~1.4 mg/mL范围内,DPPH自由清除率随着牛蒡多糖质量浓度的提高而上升。多糖质量浓度1.4 mg/mL时,自由基清除率达到66.86%,且清除率曲线的走势总体呈现上升趋势。
2.2.3 牛蒡多糖对超氧阴离子的清除活性
牛蒡多糖对超氧阴离子清除率的影响结果如图8所示。所示。牛蒡多糖质量浓度在0.2~1.4 mg/mL 范围内,随着牛蒡多糖浓度的提高,其对超氧阴离子的清除率随之增强,说明牛蒡多糖具有一定的超氧阴离子清除能力。从曲线趋势还可看出,牛蒡多糖的超氧阴离子清除率与多糖浓度间还呈现一定剂量效应关系,经分析计算牛蒡多糖对超氧阴离子的IC50为1.09 mg/mL。
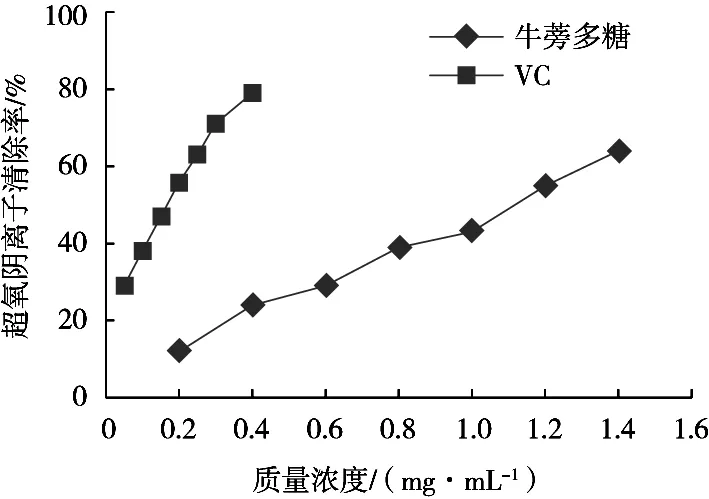
图8 牛蒡多糖对超氧阴离子清除率的影响
2.2.4 牛蒡多糖对羟自由基的清除能力
牛蒡多糖对羟自由基清除率的影响结果如图9所示。牛蒡多糖质量浓度在0.2~1.4 mg/mL范围内,牛蒡多糖对羟自由基清除率随着多糖浓度的提高而增加,且二者之间还呈现一定量效关系。说明牛蒡多糖具有羟自由基清除活性,牛蒡多糖对羟自由基的IC50为0.79 mg/mL。

图9 牛蒡多糖对羟自由基清除率的影响
3 结论
以牛蒡多糖提取率为指标,采用正交试验法优化牛蒡多糖的纤维素酶酶法提取工艺,确定牛蒡多糖的酶法提取最佳工艺:料液比1∶20(g/mL)、酶解时间80 min、纤维素酶添加量0.4%、酶解温度40 ℃。在此工艺下,牛蒡多糖提取率达39.55%±1.32%。对提取到的牛蒡多糖进行抗氧化活性分析,结果发现牛蒡多糖具有显著的抗氧化活性。牛蒡多糖质量浓度1.4 mg/mL时,还原力测定中A700nm达到0.84,多糖对DPPH自由基、超氧阴离子及羟基自由基的清除率分别达到66.86%±1.26%,64.23%±2.05%和71.94%±2.18%,经统计分析其对超氧阴离子及羟基自由基半抑制浓度IC50分别为1.09和0.79 mg/mL。说明牛蒡多糖具有较好的体外抗氧化活性,值得对其进行挖掘应用。

