低温胁迫下烟草开花调控基因表达分析
姜习振 杨晨凯 邹湘香 李洋洋 张庆富 任晓敏 晏伟杰 姚未远 贺新颖 胡日生 户正荣


摘要:为了探究低温胁迫诱导烟草早花的分子机制,以低温敏感品种云烟87为试验材料,在12 ℃低温条件下处理烟苗14 d ,取茎顶端组织进行烟草开花调控基因分析,并调查统计了烟株中心花开放时间和叶数。结果显示,与对照相比,低温胁迫导致烟株中心花开放时间平均提前7 d,叶数平均减少5片。基因表达分析结果表明,低温胁迫下开花调控基因NtMADS4, NtMADS11,NtAP1,NtSOC1,NtFUL,NtNFL1,NtFT1,NtFT3,NtFT4,NtFT5表达水平明显高于对照,在正常环境中恢复生长7~14 d,表达量下降至与对照相近的水平。以上结果表明,低温诱发烟草早花可能与这些基因上调表达有关。
关键词:烟草;低温胁迫;早花; MADS-box 家族;NtFTs;基因表达
中图分类号: S572.03 文獻标识码: A 文章编号:1007-5119(2023)03-0010-06
Expression Analysis of Flowering Regulatory Genes in Tobacco under Low Temperature Stress
JIANG Xizhen1, YANG Chenkai1,2, ZOU Xiangxiang3, LI Yangyang2, ZHANG Qingfu4, REN Xiaomin5, YAN Weijie6, YAO Weiyuan4, HE Xinying4, HU Risheng2, HU Zhengrong2*
(1. College of Agronomy, Hunan Agricultural University, Changsha 410128, China;2. Hunan Tobacco Research Institute, Changsha410004, China;3. China Tobacco Hunan Industrial Co., Ltd., Changsha 410007, China;4. Ningxiang Branch of Changsha TobaccoCompany, Changsha 410600, China;5. Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha 410205,China;6. Shimen County Branch of Changde Tobacco Company, Changde, Hunan 415300, China)
Abstract: To investigate the molecular regulatory mechanism of low temperature induced early flowering, a cold-sensitive tobacco cultivar Yunyan 87 was treated with cold stress of 12 ℃ for 14 days. The shoot apical tissues of plants were collected for flowering-regulatory gene expression analysis. The time of central flower opening and the total number of leaves were investigated. The results showed that central flower opening date of the cold-treated tobacco plants was 7 days earlier than that of the control, and total leaf number of the treated plants was 5 leaves less than that of the control. Besides, the expression levels of 10 flowering-regulatory genes were increased by cold stress when compared to the control, including NtMADS4, NtMADS11, NtAP1, NtSOC1, NtFUL, NtNFL1, NtFT1, NtFT3, NtFT4 and NtFT5; and then decreased to similar levels of the control after recovery under normal conditions for 7-14 days. These results suggested that cold-induced tobacco early flowering may be related to the up-regulation of these flowering regulatory genes.
Keywords: tobacco; low temperature stress; early flowering; MADS-box family; NtFTs; gene expression
烟草属喜温作物,连续低温会导致其早花[1],达不到应有的株高、叶数和叶片大小[2],严重影响烟草产质量[3]。探索低温胁迫下烟草基因表达变化,阐明低温早花的分子调控机理,对选育耐低温抗早花烟草品种具有重要意义。
MADS-box 家族基因在生殖生长调控中起到了非常重要的作用[4-5]。AGL2亚家族的 NtMADS4基因和 SQUA(squamosa)亚家族的 NtMADS11基因参与花分生组织和花器官的识别。过表达NtMADS4和 NtMADS11基因均会导致烟草提前开花[6-8]。 SOC1 (suppressor of overexpression of constans 1)也属于 MADS-box 基因家族,在拟南芥中过表达白菜 BrcSOC1导致转基因植株开花时间显著早于野生型[9]。由 FT(flowering locus T)基因编码的 FT 蛋白是成花素的主要成分[10],Harig 等[11] 在烟草中鉴定到4个FT 基因NtFT1、NtFT2、NtFT3、NtFT4,发现 NtFT1、NtFT2、NtFT3抑制烟草开花,而 NtFT4则诱导开花。高玉龙等[12]发现拟南芥 FT 基因在烤煙品种中的瞬时表达导致烟草早花。AP1(apetala1)和 FUL(fruitfull)在花分生组织转换过程中起着重要的调控作用[13],研究发现在烟草中过表达NtFUL和杨树 PsnAP1基因,均能导致烟草早花[14]。烟草 NtNFL1是拟南芥 LFY (leafy)的同源基因,NtNFL1与NtAP1都是分生组织特异性基因,并且 NtNFL1基因起着调控花器官形成和茎侧端分生组织形成腋芽的作用[15]。目前关于低温胁迫下烟草开花调控基因表达模式的相关研究却少有报道。
烤烟品种云烟87易受低温诱导开花[16],本研究以云烟87为试验材料,利用qRT-PCR 技术对 NtMADS4、NtMADS11、NtSOC1、NtFT1、NtFT3、 NtFT4、NtFT5、NtAP1、NtFUL、NtNFL1共10个烟草开花调控基因在正常条件和低温胁迫下的表达模式进行分析,旨在探究烟草低温早花调控机制,为培育耐低温抗早花烤烟新品种提供理论参考。
1 材料与方法
1.1 试验材料及种植培养
本试验采用的烟草品种为云烟87,由中国烟草中南农业试验站提供。种植于湖南省烟草科学研究所人工气候室。种子清洗后放入2 mL 离心管中,加入1.5 mL 无菌水,于4℃冰箱中处理2 d,以促进种子发芽同步化。在容积为1 L 的底部有透水孔的方盒中装入烟草育苗基质,放置于水中,让基质充分吸收水分。种子在冰箱中处理完成后,均匀地撒播于基质上。种子萌发并生长至两片子叶完全展开时,选取健康幼苗定植于上述基质盒中,在25℃、相对湿度65%、光照16 h/d 条件下培养至苗龄41 d (7叶),开始处理。
1.2 试验处理
挑选长势一致的烟苗,分为2组。处理组:烟苗在人工气候室中12℃低温处理14 d,然后在常温25℃条件下恢复14 d,期间相对湿度保持在65%、光照16 h/d。对照组:烟苗一直在正常条件下(25℃ , 相对湿度65%、光照16 h/d)培养。处理组和对照组的烟苗每7 d 取一次样用于基因表达分析。具体取样方法:取烟苗茎顶端组织(包含顶端3片幼叶),迅速用锡纸包好并放入液氮速冻,立即于-80℃冰箱中保存。每3株混合作为一个生物学重复,每组3个生物学重复。其他烟株(处理组和对照组均预留15株)用于开花期和叶数的调查统计。
1.3 RNA 提取和反转录
采用朱晓宇等[17]改进的 CTAB 法提取 RNA 。 RNA 反转录参照iScript? gDNA Clear cDNA Synthesis Kit 说明书进行。
1.4 qRT-PCR 相对定量
采用 ABI 公司生产的QuantStudio 6 Flex 荧光定量 PCR 仪,使用 Takara 公司生产的 SYBR Premix EX Taq 对各基因的表达量进行 qPCR 检测,以NtActin为内参基因。 qPCR 所用引物信息见表1。
qRT-PCR 反应体系:2×qPCR Mix 10?L、上下游引物(10?mol/L)各0.5?L、cDNA 0.5?L,ddH2O 补足至20?L。反应条件:95℃预变性5 min;95℃变性10 s、60℃退火延伸30 s,40个循环;溶解曲线采集阶段95℃15 s ,60℃60 s ,95℃15 s。
1.5 数据分析和处理
用 SPSS 19软件进行数据多重比较及差异显著性检测,p<0.05,用 Excel 2016作图。
2 结果
2.1 低温胁迫后开花期及叶数
由图1可见,云烟87在经过14 d 的低温处理后,平均提前7 d 开花,显著早于对照。同时,低温处理的叶片平均减少5片,显著少于对照。表明,低温胁迫会导致敏感烟草品种提前开花,叶数减少。
2.2 低温胁迫后开花调控基因表达分析
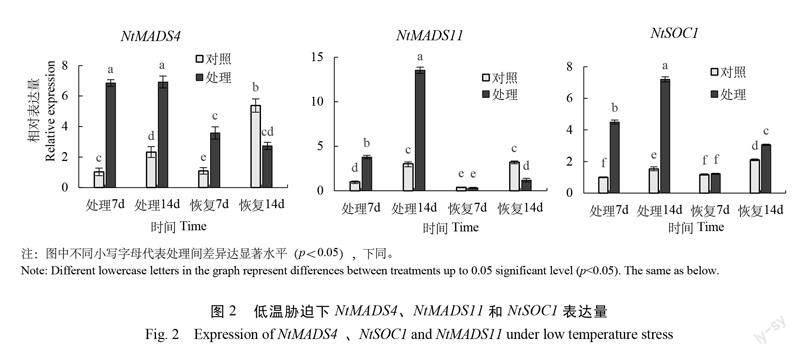
以常温为对照,对烟株低温(12℃)处理7 d、14 d 和常温(25℃)恢复后7 d、14 d 进行表达量测定。结果显示(图2),对照组 NtMADS4的表达量前期一直处于较低水平,后期明显升高。与对照组相比,NtMADS4受低温胁迫显著上调表达,恢复7 d 时表达量有所下降但仍高于对照,恢复14 d 后其表达水平明显低于对照。NtMADS11在低温处理时表达量上调并于14 d 时达到峰值,是对照组的4.5倍,常温恢复后表达量明显下降,在恢复14 d 时其表达水平显著低于对照。此外, NtSOC1在低温处理后上调表达,在处理14 d 时达到峰值,其表达量是对照组的4.7倍,常温恢复后 NtSOC1表达量下降,与对照的差值逐渐减小。综合来看,在低温处理下 NtMADS4、NtMADS11和 NtSOC1的表达量均显著高于对照,而常温恢复后其表达量便明显降低。表明,正常条件下 NtMADS4、NtMADS11和 NtSOC1在苗期维持在较低水平,但低温胁迫会诱导上调表达。
如图3所示,对照组的 NtFT1、NtFT3、NtFT5在4个时间点的表达量均处于较低水平, NtFT4在7 d 时的表达量较高,随后也降至较低水平。但与对照组相比,低温处理组 NtFT1、NtFT3、NtFT4和 NtFT5表达量明显升高,其中 NtFT1、NtFT4和 NtFT5在低温处理7 d 时达到峰值, NtFT3在处理14 d 时达到峰值。在正常条件下恢复后,这4个NtFT基因的表达量明显下降至与对照组相近的水平。以上结果表明,正常条件下4个 FT 基因的表达量维持在较低水平,但低温胁迫会特异性激活其表达。
如图4所示,与对照组相比,低温处理后 NtAP1、NtFUL和 NtNFL1表达量均升高, NtAP1、NtFUL在处理14 d 时达到峰值,NtNFL1在处理7 d 达到峰值。3个基因表达量在常温恢复后下降至与对照组相近水平。该结果表明,低温胁迫会激活 NtAP1、NtFUL和 NtFL1基因表达,在常温恢复后其表达量会恢复至正常水平。 AP1、FUL 同属于 MADS-box 基因家族中的 AP1/FUL 亚家族,处于开花调控途径的下游,起着整合开花信息的作用。
3 讨论
植物根据内源和环境信号调整花期转换[18],一些 MADS-box 基因的过表达会增强其他内源开花相关基因的表达,诱导烟草提前开花[19]。前人研究发现,过表达 PsnAP1 的烟株中 NtMADS4 和 NtMADS11的表达量均比野生型高出10倍[14]。本研究结果发现,NtMADS4和 NtMADS11基因均受低温胁迫上调表达,其中 NtMADS11在低温处理14 d 时的表达量上调了14倍。因此,推测 NtMADAS4和 NtMADS11可能参与了低温诱导烟草早花调控过程,但其具体的作用机理还需进一步探究。SOC1作为开花调控整合因子,既受 FLC(flowering locus C)调控参与春化成花途径,亦受 FT 和 FD 蛋白结合的复合体调控参与光周期成花途径[20]。本研究发现 NtSOC1基因表达量在低温处理后上调,处理14 d 时达到峰值,但常温恢复后其表达量又迅速降低,这充分说明 NtSOC1的表达受低温诱导。
FT 基因受 CO 信号和 FLC 调控,进而激活 SOC1和 AP1的表达诱导植物开花,在光周期途径和春化途径促进开花过程中起到关键作用[21]。前人研究表明,NtFT1、NtFT2和 NtFT3是开花抑制子,仅有 NtFT4为开花诱导子[11]。本研究发现,在低温胁迫下,NtFT1、NtFT3、NtFT4的表达量迅速上调,且NtFT1、NtFT3和NtFT5的表达量明显高于NtFT4,但 FT 下游的 SOC1却上调表达,且植株开花明显提前。NtFT1、NtFT3和 NtFT4通过竞争 FD 蛋白来共同调控下游基因[11],研究发现, FD 蛋白会更倾向于与开花诱导子NtFT4结合来激活下游基因的表达,进而使 NtFT4在蛋白质水平上比其他抑制子更具有竞争力[22]。本试验中低温处理阶段 NtFT4的表達量在7 d 时达到峰值后呈下降趋势,而 NtSOC1 则是逐步上调表达,在14 d 达到峰值,推测 NtFT4 迅速响应低温并先于 NtSOC1上调表达。 NtFT5也是开花诱导基因,它的表达几乎不受光周期的影响,在开花过程中起着比 NtFT4更重要的作用[22]。本研究发现,NtFT5在低温处理时有较高的表达量,常温恢复后表达量下降至对照水平,说明 NtFT5同样受低温诱导,与 NtFT4共同激活下游基因表达,促进植物成花。
AP1处于各种成花途径调控的下游,并在诱导开花的调控中起到核心作用。AP1可以被 FT-FD 和 LFY 激活表达,从而促进成花[23]。FUL 基因编码一个含有 MADS 结构域的转录因子,来促进花分生组织识别和花期转换[24]。NtFUL基因受 FT-FD 复合体的诱导表达参与成花,且其表达量会随着烟株的生长发育逐渐升高,并在成花阶段维持较高表达量[14,25],在本试验中, NtAP1、NtFUL基因均受低温胁迫上调表达,其表达水平显著高于对照;正常温度恢复后,其表达量与对照之间的差值缩小且保持上升趋势,推测低温会诱导 NtAP1和NtFUL的表达,并且其表达量随着烟株生长发育而逐步上调,在进入花器官的识别和建成阶段时达到最高水平,从而促进植物开花。 NtNFL1同样受低温诱导而高量表达,并在正常温度恢复后表达量降低至对照水平,其变化趋势与 NtFT4和 NtFT5相似,不同于 NtSOC1、NtAP1和NtFUL。NtNFL1的表达受 FT-FD 复合物和NtSOC1的调控,相比于NtAP1和NtFUL, NtNFL1可能更易被NtFTs基因激活。
4 结论
本研究验证了低温胁迫会诱导敏感烟草品种提前开花导致叶数减少,发现低温胁迫会诱导开花调控基因 NtMADS4,NtMADS11,NtSOC1,NtFT1, NtFT3,NtFT4,NtFT5,NtAP1,NtFUL,NtNFL1的表达。低温诱导烟草早花具体的调控机制还需要通过基因敲除或过表达等方式来进一步探究。
参考文献
[1] 白戈,杨大海,姚恒,等.烟草耐低温胁迫早花突变体材料的筛选[J].分子植物育种,2019,17(13):4410-4415.
BAI G, YANG D H, YAO H, et al. Screening of tobacco early flowering mutants resistant to low temperature stress[J]. Molecular Plant Breeding, 17(13):4410-4415.
[2] 金磊,晋艳,周冀衡,等.苗期低温对烤烟花芽分化及发育进程的影响[J].中国烟草科学,2007(6):1-5.
JIN L, JIN Y, ZHOU J H, et al. Effects of low temperature in seedling stage on floral differentiation and development of flue-cured tobacco[J]. Chinese Tobacco Science, 2007(6):1-5.
[3] HU Z R, YAN W J, YANG C K, et al. Integrative analysis of transcriptome and metabolome provides insights into the underlying mechanism of cold stress response and recovery in two tobacco cultivars[J]. Environmental and experimental botany, 2022, 200:104920.
[4] ZHANG J Y, MO Z H, LI Y R, et al. Cloning and functional analysis of the MADS-box CiMADS9 gene from Carya illinoinensis[J] Horticultural Plant Journal , 2015, 1(1):11-16.
[5] LIU X Y, ZHANG D D, YU Z F, et al. Genome-wide identification and analysis of the MADS-Box gene family in almond reveal its expression features in different flowering periods[J]. Genes, 2022, 13(10):1764
[6] SMYKAL P, GENNEN J, DE B S, et al. Flowering of strict photoperiodic Nicotiana varieties in non-inductive conditions by transgenic approaches[J]. Plant Molecular Biology, 2007, 65(3):233-242.
[7] JANG S, AN K, LEE S, et al. Characterization of tobacco MADS-box genes involved in floral initiation[J]. Plant & cell physiology, 2002, 43(2):230-238.
[8] LIAO W Y, LIN L F, LIN M D, et al. Overexpression of Lilium formosanum MADS-box (LFMADS) causing floral defects while promoting flowering in Arabidopsis thaliana, whereas only affecting floral transition time in Nicotiana tabacum[J]. International Journal of Molecular Sciences, 2018, 19(8):2217.
[9] LI X, AMIN P, QI X H, et al. Cloning, expression and functional analysis of the SOC1 homologous gene in pak choi (Brassica rapa ssp. Chinensis makino)[J]. Biotechnology & Biotechnological Equipment,2022, 36(1):848-857.
[10] TAOKA K, KOJIMA C, TSUJI H, et al. Structure and function of florigen and the receptor complex[J]. Trends in Plant Science, 2013, 18(5):287-294.
[11] HARIG L, BEINECKE F A, OLTMANNS J, et al. Proteins from the FLOWERING LOCUS T-like subclade of the PEBP family act antagonistically to regulate floral initiation in tobacco[J]. The Plant Journal, 2012, 72(6):908-921.
[12] 高玉龍,肖炳光, RALPH E D.诱导烟草早花的 PVX-FT 系统的建立[J].中国烟草学报,2013,19(6):102-105.
GAO Y L, XIAO B G, RALPH E D. Construction of PVX-FT system that inducing early flowering in tobacco[J]. Acta Tabacaria Sinica, 2013, 19(6):102-105.
[13] ZHANG C L, SUN Y L, YU X M, et al. Functional conservation and divergence of five AP1/FUL-like genes in Marigold (Tagetes erectaL.)[J]. Genes, 2021, 12(12):2011.
[14] ZHENG T C, LI S, ZANG L N, et al. Overexpression of two PsnAP1 genes from Populus simonii × P. nigra causes early flowering in transgenic tobacco and Arabidopsis[J]. PLoS One, 2014, 9(10): e11175
[15] AHEARN K P, JOHNSON H A, WEIGEL D, et al. NFL1, a Nicotiana tabacum LEAFY-like gene, controls meristem initiation and floral structure[J]. Plant & Cell Physiology, 2001, 42(10):1130-1139.
[16] 王欣亞,吴委林,南桂仙,等.25份烟草品种(系)低温诱导早花耐易性鉴定及分类[J].延边大学农学学报,2019,41(1):30-40. WANG X Y, WU W L, NAN G X, et al. Identifications and classifications of tolerance of 25 tobacco varieties (strains) induced by low temperature premature premature flowering[J]. Agricultural Science Journal of Yanbian University, 2019, 41(1):30-40.
[17] 朱晓宇,姚珊珊,赵二卫,等.烟草叶片总 RNA 提取方法的比较[J].安徽农业科学,2010,38(15):7821-7823.
ZHU X Y, YAO S S, ZHAO E W, et al. Comparison on total RNA extraction methods from tobacco leaves[J]. Journal of Anhui Agricultural Sciences, 2010, 38(15):7821-7823.
[18] DAI G Y, CHEN D K, SUN Y P, et al. The Arabidopsis KH-domain protein FLOWERING LOCUS Y delays flowering by upregulating FLOWERING LOCUS C family members[J]. Plant Cell Reports, 2020, 39(12):1705-1717.
[19] MA G Y, NING G G, ZHANG W, et al. Overexpression of Petunia SOC1-like gene FBP21 in tobacco promotes flowering without decreasing flower or fruit quantity[J]. Plant molecular biology reporter, 2011, 29(3):573-581.
[20] ABE M, KOBAYASHI Y, YAMAMOTO S, et al. FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J]. Science, 2005, 309(5737):1052-1056.
[21] PIN P A, NILSSON O. The multifaceted roles of FLOWERING LOCUS T in plant development[J]. Plant, cell & environment, 2012, 35(10):1742-1755.
[22] BEINECKE F A, GRUNDMANN L, WIEDMANN D R, et al. The FT/FD-dependent initiation of flowering under long-day conditions in the day-neutral species Nicotiana tabacum originates from the facultative short-day ancestor Nicotiana tomentosiformis[J]. The Plant Journal, 2018, 96(2):329-342.
[23] WELLMER F, RIECHMANN J L. Gene networks controlling the initiation of flower development[J]. Trends in Genetics, 2010, 26(12):519-527.
[24] BALANZà V, MARTíNEZ I, SATO S, et al. Genetic control of meristem arrest and life span in Arabidopsis by a FRUITFULL-APETALA2 pathway[J]. Nature Communications, 2018, 9:565.
[25] ANDRES F, COUPLAND G. The genetic basis of flowering responses to seasonal cues[J]. Nature Reviews: Genetics, 2012, 13(9):627-639.

