摩加夫芽孢杆菌产酶条件优化及对烟叶品质的影响
李正风 张鹏 王萝萍 胡巍耀 端凯 高丽伟 张忠锋 夏玉珍


摘要:纤维素、果胶、淀粉和蛋白质是烟叶中含量较高的生物大分子,对烟叶品质的影响较为显著。本研究对烟叶醇化过程中的微生物进行筛选,并对其产酶条件和作用效果进行研究,旨在发掘对烟叶品质有促进效果的功能微生物资源。研究筛选得到2-4A 菌株,能够同时分泌淀粉酶、果胶酶、纤维素酶和蛋白酶,经鉴定为摩加夫芽孢杆菌(Bacillus mojavensis)。对2-4A 菌株的发酵时间、发酵温度、培养基 pH 及接种量进行优化后,该菌株的淀粉酶、果胶酶、纤维素酶和蛋白酶的活力分别增加至41.36、3.64、5.14和72.13 U/mL。用发酵液处理烟叶,能够对烟叶中的4种大分子物质进行降解,其中蛋白质的降解率达到37.8%,淀粉的降解率超过30%,果胶和纤维素的降解率均超过10%。经过2-4A 菌株发酵液处理,烟叶中酮类、酸类、酯类、杂环类、醇类和醛类等香气物质的含量在整体上均得到提升,酸类和醇类物质提升最多。就单种致香物质而言,对烟叶香气有较大影响的茄尼酮含量比发酵前提高了0.51百分点,叶绿醇含量提高了15.83百分点,3-甲基丁酸含量提高了6.85百分点。摩加夫芽孢杆菌在协调烟叶化学组分和增加致香物质含量方面具有較好的效果,在提升烟叶品质方面具有应用潜力。
关键词:芽孢杆菌;降解酶;烟叶;品质改善;烟叶醇化
中图分类号: TS41+1 文献标识码: A 文章编号:1007-5119(2023)03-0069-08
Condition Optimization of Enzyme Production from Bacillus mojavensis in Tobacco Leaf and Its Effect for Improving Tobacco Quality
LI Zhengfeng1, ZHANG Peng2, WANG Luoping1, HU Weiyao1, DUAN Kai1, GAO Liwei2, ZHANG Zhongfeng2, XIA Yuzhen1*
(1. China Tobacco Yunnan Industrial Co., Ltd., Kunming 650201, China;2. Tobacco Research Institute of Chinese Academy ofAgricultural Sciences, Qingdao 266101, China)
Abstract: Cellulose, pectin, starch and protein are some macromolecules with high content in tobacco leaf, which greatly affect the quality of tobacco leaf. In this study, bacteria were isolated from mellow tobacco leaves, and their enzyme production conditions and effects were studied, providing a new theoretical basis for microbial enzyme production in tobacco leaves and improving tobacco quality. In this study, strain 2-4A was screened, which was capable of producing amylase, pectinase, cellulase and protease at the same time. The strain was identified as Bacillus mojavensis. The activities of amylase, pectinase, cellulase and protease were increased to 41.36L, 3.64, 5.14 and 72.13 U/mL by optimizing the fermentation time, fermentation temperature, pH of medium and inoculum volume of strain 2-4A, respectively. After 72 h treatment with fermentation solution, the four macromolecular substances in tobacco leaves were degraded. The degradation rate of protein reached 37.8% and that of starch was over 30%. The degradation effects of pectin and cellulose were slightly weaker, but both were more than 10%. The contents of ketones, acids, esters, heterocycles, alcohols,aldehydes and other aroma substances in tobacco leaves were improved by the fermentation solution of strain 2-4A. Among them, acid and alcohol substances increased the most. In terms of single substance, the content of solanidone, phytol and 3-methylbutyric acid increased by 0.51%, 15.83% and 6.85% compared with that before fermentation. Bacillus mojavensis obtained in this study has the potential to be applied in improving the quality of tobacco leaves, and can be applied in the large-scale alcoholization process of tobacco leaves in the future.
Keywords: Bacillus; degrading enzymes; tobacco leaf; tobacco quality; tobacco mellowing
烟叶的品质是由烟叶内部化学成分所决定的。大量研究证实,烟叶香型风格与内在化学成分间存在着必然的联系[1-2]。低次烟叶由于内在成分比例不协调,烟叶杂气重,风格特征弱化。烟叶醇化能使烟叶内化学成分及其比例发生变化,进而改善烟叶品质[3-4]。然而,自然醇化周期过长且反应不可控,具有占用仓储面积大、积压资金多等诸多缺点。此外,醇化后的低档次烟叶刺激性、杂气仍然较高,不足以从根本上提升低次烟叶的品质[4-6]。
在烟叶醇化过程中,微生物在烟叶上繁殖富集,品质越高的烟叶其微生物的数量和种类越丰富[2]。微生物分泌生物酶对烟叶化学组分进行转化,在烟叶的自然醇化阶段发挥了重要作用[5]。生物酶可以对烟叶中的淀粉、蛋白质、纤维素、果胶等大分子物质进行降解,同时加速烟叶中色素、多酚类物质、萜烯类物质向小分子香气物质转化,进而提高烟草中酮、醛、酸、酯、萜烯类和低级脂肪酸类的含量[7-9]。微生物的作用可以在整體上加快醇化过程,促进烟叶化学成分的改变和产香物质的积累,最终改变烟草的品质[10-11]。
近年来,烟叶醇化过程中的微生物得到分离和研究。在醇化过程之外培养微生物,将微生物加到烟叶中,已经成为加速醇化过程、提升烟叶品质的新手段[11-12]。研究者发现,利用从烟草中分离的微生物混合添加处理,醇化过程从3年缩短到7个月。从烟叶中分离产酶微生物也得到重视,培养来源于晾晒烟叶表面的产酶微生物,将其通过一定方式添加至烟叶进行发酵,可以显著提高烟叶的吸食性[11]。
纤维素、果胶、淀粉和蛋白质是烟叶中含量较高的几种大分子,其含量极大影响烟叶的品质[13-15]。为了获得可同时降解淀粉、蛋白质、纤维素、果胶的菌株,本研究从不同产地、不同品种的烟叶中分离细菌,并对其产酶条件及作用效果进行研究,为烟叶醇化微生物的应用和烟叶品质的提升提供新的理论基础。
1 材料与方法
1.1 试验材料
供试烟叶为山东省莒县库山乡种植的 B3F 等级烟叶。
1.2 试剂和培养基
1.2.1 主要试剂纤维素、果胶、酪蛋白、木质素购自索莱宝科技有限公司,其他试剂均购买自国药集团。木质素和果胶含量测试试剂盒购买自索莱宝科技有限公司。细菌基因组提取试剂盒购买自天根生化科技(北京)有限公司。
1.2.2 培养基淀粉酶筛选培养基:可溶性淀粉20.0 g,蛋白胨10.0 g,酵母粉5.0 g,氯化钠5.0 g,琼脂20.0 g ,1 L 蒸馏水, pH 7.0,121℃灭菌20 min。
纤维素酶筛选培养基:硫酸铵4.0 g,蛋白胨1.0 g,七水硫酸镁0.5 g,羧甲基纤维素钠10.0 g,磷酸二氢钾1.0 g,琼脂20.0 g,1 L 蒸馏水,pH 7.0,121℃灭菌20 min。
蛋白酶筛选培养基:酪蛋白5 g,酵母粉3 g,蛋白胨10 g,氯化钠5.0 g,琼脂20 g,1 L 蒸馏水, pH 7.0,121℃灭菌20 min。
果胶酶筛选培养基:果胶4.0 g,七水硫酸镁2.0 g,磷酸二氢钾1.0 g,氯化铵0.4 g,硫酸亚铁0.01 g ,1 L 蒸馏水, pH 7.0,121℃灭菌20 min。
LB 培养基:蛋白胨10 g,酵母粉5 g,氯化钠10 g,琼脂20.0 g,1 L 蒸馏水,121℃灭菌20 min。
1.3 试验方法
1.3.1 烟叶中细菌的分离取50 g 醇化过程中的烟叶样品,剪碎放于50 mL 1%氯化钠溶液中,30℃、180 r/min 培养1 h。取培养悬液用1%氯化钠溶液进行梯度稀释,取100μL 稀释液涂布于LB 平板,37℃培养48 h,挑选形态不同的单菌落进行划线纯化。1.3.2 菌株降解大分子物质能力初筛纯化后的细菌,挑取单菌落分别在淀粉酶筛选平板、果胶酶筛选平板、纤维素酶筛选平板和蛋白酶筛选平板上点种,于37℃培养36 h。在蛋白酶筛选平板上,直接观察细菌菌落周围的透明圈。果胶酶[13]、淀粉酶[14]和纤维素酶[15]筛选平板,先用卢戈氏碘液染色,然后观察菌落周围是否有透明圈的产生,以判断细菌是否降解相应大分子,根据透明圈的直径可以初步比较产酶能力。综合4种培养基上透明圈的情况,挑选出可同时生产多种酶和降解相应大分子的菌株。
1.3.3 菌株发酵培养和降解酶活力测定初筛得到的2-4A 菌株在37℃、180 r/min 条件下振荡培养12 h,得种子液。种子液接种于 LB 液体培养基中,37℃、180 r/min 培养48 h,6000 r/min 离心10 min 弃掉菌体,即为发酵液。纤维素酶、果胶酶和淀粉酶活力的测定分别以0.5%羧甲基纤维素钠溶液、0.5%果胶溶液、0.5%可溶性淀粉溶液为底物,在37℃和 pH 7.0条件下,反应30 min。反应结束用 DNS 法测定还原糖的增加量,酶活力单位 U 定义为每分钟生成1μmol 还原糖需要的酶量[16]。蛋白酶活力的测定以0.2%酪蛋白溶液为底物,在上述同样的条件下进行反应,进而用福林酚试剂染色,通过吸光度的增加量计量蛋白酶活力。酶活力单位 U 定义为每分钟生成1μg 酪氨酸需要的酶量。
1.3.4 菌株的鉴定将2-4A 菌株接种于LB 平板上于37℃培养24 h,观察菌落形态,并在显微镜下观察菌株的细胞形态[9, 17-18]。对培养好的菌液进行硝酸盐肉汤、淀粉水解、西蒙氏柠檬酸盐、V-P 、葡萄糖、溶菌酶、甘露醇、动力培养基、明胶液化和3%过氧化氢酶等生理生化鉴定。适量刮取平板上的菌落,利用细菌基因组提取试剂盒提取基因组 DNA,以此为模板 PCR 扩增16S rDNA 序列[19]。引物分别为27F(AGAGTTTGATCCTGGCTCAG)和1429R(GGTTACCTTGTTACGACTT)。PCR 扩增条件为:96℃预变性10.0 min;96℃变性1.0 min,50℃退火1.0 min ,72℃延伸2.0 min 变性,72℃充分延伸8.0 min ,30个循环;4.0℃保温。送青岛擎科生物科技公司测序。将16S rDNA 序列在 NCBI 基因库中进行比对。然后依据相似细菌物种的16SrDNA 序列,使用 MEGA 7.0进行同源比对,并构建系统进化树。
1.3.5 菌株产酶条件的单因素优化菌株在 LB 液体培养基中37℃培养12 h 作为种子液,以4%的接种量转接到 LB 液体培养基中,37℃、摇床转速180 r/min 继续培养60 h。每隔12 h 取样1 mL,测定4种降解酶的活力,获得最佳的发酵时间。培养温度分别设置为31、34、37、40和43℃ , 发酵培养60 h,得到最佳的产酶温度条件。将培养基调整 pH 至5.0、6.0、7.0、8.0和9.0,以4%的接种量将菌株种子液接种于100 mL LB 液体培养基中振荡培养,测定酶活力,获得菌株产酶的最佳 pH 条件。设置5个不同的接种量梯度,在37℃和180 r/min 下振荡培养,测定酶活力,获得菌株产酶的最佳的接种量。每个试验重复3次。
1.3.6 菌株产酶条件的正交优化基于单因素产酶条件优化的结果,进行4因素3水平的正交试验。正交试验方案如表1所示,1、2、3代表各因素的3个水平,分别设置为:培养时间24、36、48 h ,温度34、37、40℃;培养基 pH 6.0、7.0、8.0;接种量4%、6%、8%。
1.3.7 菌株酶液对烟叶中大分子物质含量的影响将2-4A 菌株于最佳的培养条件下进行发酵培养,6000 r/min 离心10 min ,获得发酵液。将30 mL 发酵液均匀喷洒在100 g 烟叶表面,在37℃、65%湿度的恒温恒湿箱中处理72 h,对照喷洒等量的无菌水。每个样品做3次重复。处理完毕后,测定处理对烟叶成分的影响。利用碘显色法测定淀粉含量, BCA 法测定蛋白质含量,蒽酮比色法测定纤维素含量,木质素和果胶含量使用试剂盒进行测定(索莱宝科技)。
1.3.8 烟叶中香气成分的测定将烟叶粉碎,用二氯甲烷进行萃取,然后根据参考文献[20-21]利用气质联用色谱(岛津, GCMS-QP2010 SE )检测,每个样品做3次重复。色谱检测色谱柱:DB-5MS(30 m×0.25 mm×0.25μm);程序升温:60℃保持5 min,以4℃/min 的速度升至135℃;以1℃/min,升至175℃;再以10℃/min,升至310℃,并保持10 min。进样温度250℃;载气纯 He,载气流速1 mL/min;分流比10∶1;进样量1μL。根据质谱结果,在数据库中搜索确定小分子化合物的种类和结构,依据峰面积计算出每种分子的含量和比例。
2 结果
2.1 产酶菌株初步筛选
经 LB 平板培养和划线分离,共筛选得到59株细菌。从 LB 平板上挑取单个细菌,分别点种到4种产酶筛选平板上培养36 h,经观察透明圈及其直径,共筛选出5株可以同时降解4种大分子的细菌,如图1所示。菌株2-4A 在果胶酶、纤维素酶和淀粉酶筛选平板上均出现透明圈,直径分别是22、23、24和30 mm,同时测定到4种酶活力都处于较高水平。说明具有较强的降解能力,具有提高烟叶品质的潜力,选出该菌株进行后续试验。
2.2 菌株的鉴定
如图2所示,2-4A 菌株可以在 LB 培养基上生长36 h 即出现较大菌落。菌落为纯白色,不透明,边缘光滑无凸起,细胞呈杆状。提取菌株的基因组 DNA ,使用通用引物1492R 和27F 扩增得到16S rDNA 片段,产物测序后得到16S rDNA 的序列,與 NCBI 数据库中多个已知细菌物种的16S rDNA 序列进行 Blast 比对分析,并利用 Neighbor-Joining 法构建系统进化树。如图2所示,2-4A 菌株与摩加夫芽孢杆菌(Bacillus mojavensis)距离最近,位于进化树的同一支,且它们的16S rDNA 序列的相似度超过了99%。综合菌落形态和分子生物学鉴定结果,2-4A 菌株是摩加夫芽孢杆菌。
2.3 培养条件对菌株产酶的影响
2.3.1 最佳产酶时间如图3所示,2-4A 菌株的淀粉酶、纤维素酶、果胶酶和蛋白酶活力均随发酵时间延长升高。当发酵至36 h ,4种酶活力均达到最高值,分别为36.12、4.30、2.30和67.34 U/mL。随着发酵时间继续增加,各种降解酶的活力开始下降。通常细菌发酵产酶的最佳时间在稳定中期,而到稳定后期菌株受限于营养物质含量的降低,自身的生长和代谢受到抑制,产酶量降低。因此最佳的发酵产酶时间是36 h。
2.3.2 最佳产酶温度如图4所示,2-4A 菌株的淀粉酶、纤维素酶和蛋白酶活力在发酵温度为37℃时达到最大值,分别为37.92、4.47和68.53 U/mL ,而果胶酶活力在40℃达到最大值2.63 U/mL。当温度升至43℃, 酶活力都显著下降。在较低的温度条件下,菌株细胞内的代谢处于较低水平,对物质的利用速度也较慢,生物量降低,产酶量也较少。而超过菌株的适宜生长温度时,细胞内的代谢会随之发生改变,过快的生长速度会加速营养物质的消耗,使衰亡期提前,反而使得酶活力降低。因此,2-4A 菌株的最佳产酶培养温度是37℃。
2.3.3 最佳产酶培养基 pH pH是保证菌株正常生长和代谢的重要条件,芽孢杆菌属一般在 pH 6.0~9.0的范围内能够正常生长。pH 超出耐受范围的,则会影响胞内的代谢酶,从而抑制菌株的生长,不利于各种代谢产物的积累。如图5所示,pH 对4种降解酶活力的影响趋势基本相同。随着 pH 升高,4种降解酶的活力均是先升高后降低。当 pH 为6.0时,淀粉酶和纤维素酶的活力达到最大,分别为43.16和5.88 U/mL;而当 pH 为7.0时,蛋白酶和果胶酶的活力达到最大值,分别为17.13和25.91 U/mL。说明芽孢杆菌来源的蛋白酶和果胶酶更适合在中性条件下发挥作用,而淀粉酶和纤维素酶更适合在弱酸条件下合成和分泌。因此,2-4A 菌株的最佳产酶培养基的 pH 为7.0。
2.3.4 最佳产酶接种量在细菌培养过程中,接种量也能影响到菌株的生长和代谢。接种量越大,菌株适应培养基和培养条件越快,生物量增加得越快。如图6所示,随着接种量从2%升高到6%,淀粉酶、果胶酶和纤维素酶的活力分别增加到41.36、3.64和5.14 U/mL,蛋白酶的活力比在4%接种量略有下降,为72.13 U/mL。整体而言,6%的接种量为最佳条件。
2.4 菌株产酶条件的正交优化
正交条件优化用于优化多个因素对一个目标的影响。在进行产酶的正交条件优化时,通过对以上因素进行正交条件优化试验,可以找到最佳的产酝条件组合,从而提高细菌产酝效果。如图7所示,按照5号正交方案培养,菌株产酝量达到最佳。淀粉酝、果胶酝、蛋白酝和纤维素酝的活力分别增加到44.26、3.76、75.26和5.43 U/mL,高于通过单因素试验得到的活力。因此菌株最佳的产酝培养条件为37校下培养36 h,培养基初始 pH 为8.0,接种量为4%。
2.5 菌株发酵液对烟叶中大分子的降解效果
2-4A 菌株发酵液对处理72 h 后,烟叶中4种大分子物质均得到降解(表2)。其中蛋白质的降解率达到37.8%,淀粉的降解率也超过30%;果胶和纤维素的降解效果稍弱,但也均超过10%。烟叶中木质素含量几乎不变,这与菌株未检测到木质素降解酝活性对应。
2.6 烟叶香气成分的测定
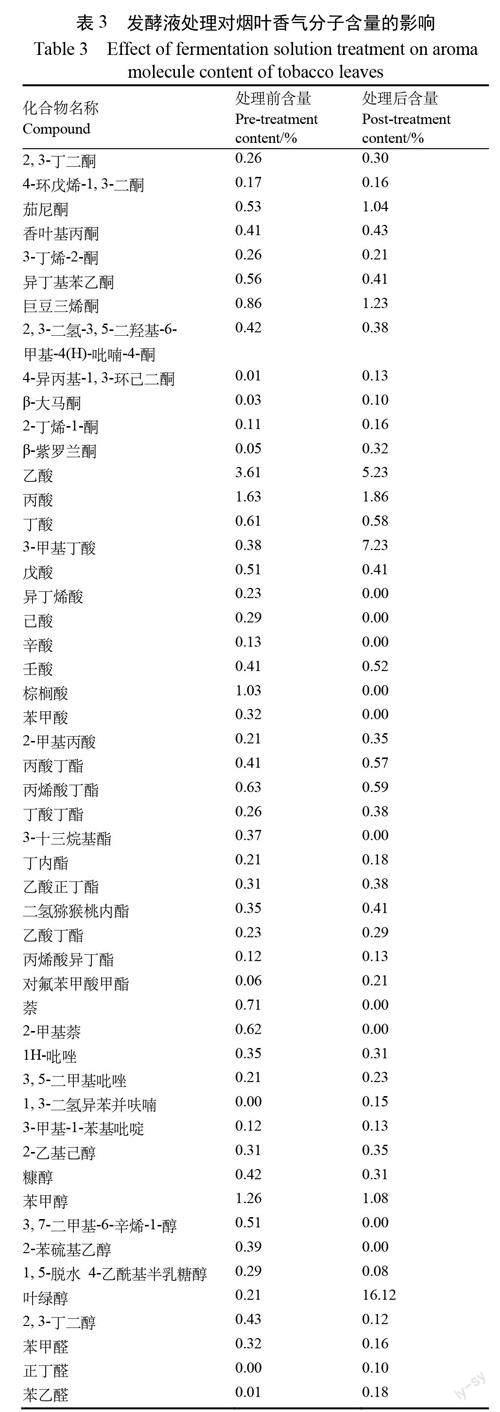
经过2-4A 菌株发酵液的处理,烟叶中丽类、酸类、酷类、杂环类、醇类和睦类等香气物质的含量在整体上均得到提升(表3)。其中含量提升最多的是酸类和醇类物质。就单种物质而言,对烟叶香气有较大影响的茄尼丽、叶绿醇和3-甲基丁酸的含量相比发酵前分别提高了0.51、15.83和6.85百分点。
3 讨论
烟叶中大分子在醇化过程中可以降解成小分子,是香气物质的前体成分,促进大分子降解是提升烟叶品质的重要手段[22-25]。烟草行业醇化过程中的自然发酵周期过长且反应不可控,醇化后的低档次烟叶仍带有刺激性、杂气,所以自然醇化不足以从根本上提升低次烟叶的品质[26]。添加外源微生物进行发酵,能够显著提升转化效率,大大缩短发酵时间。近年来,人工添加微生物发酵成为重要的辅助手段,可以增加烟叶中香气成分的含量[27]。
研究者最早使用小球菌和芽孢杆菌来改善烟叶香气,此后有越来越多关于利用微生物提高烟叶香气的研究。黄文静等[28]发现短时间的芽孢杆菌处理烟叶香气显著提高、刺激性降低、卷烟吸味改善。于少藤等[1]将菌株 yc10接种于烟叶表面,发现发酵烟叶中蛋白质、淀粉、木质素、果胶等含量降低,且致香成分的含量以及总糖含量增加,其中煙叶中的糖分在热分解时使烟气呈酸性,促进烟碱中和,降低了刺激性,使烟气更加平衡。此外,还有研究发现按一定比例使用多种微生物共同处理烟叶也可提高烟叶香气[29]。采用解淀粉芽孢杆菌单一处理烟叶后,烟叶甜度、香气品质均显著提高,但是烟气的柔和度和刺激性变化不明显,用地赤芽孢杆菌单一处理烟叶也有类似的趋势。当把解淀粉芽孢杆菌和地赤芽孢杆菌按3∶1比例混合处理烟叶2 d 后,烟叶的香气、甜度、刺激性等不同指标均表现出更全面的改善,表明两个菌株对烟叶的香气品质具有协同作用。以上研究表明,醇化发酵过程中选择合适的微生物和适宜的发酵条件均可显著改善烟叶的香气品质,提高烟叶的质量。
本研究筛选出1株能同时产生纤维素酶、果胶酶、淀粉酶和蛋白酶的菌株,优化产酶条件之后,添加发酵液到烟叶可以同时降解烟叶中的4种大分子,仅仅处理72 h 就能显著降低上述4种大分子的含量。烟叶经2-4A 菌株酶液处理后,从整体上看,酮类、醇类、醛类、酸类和酯类等香气物质的含量均有所增加。含量提升最为显著的是茄尼酮、叶绿醇和3-甲基丁酸。茄尼酮具有烤烟精油的香气,能够提高烟草的吸味品质,丰富香气特征。叶绿醇自身具有类似于花香的香气,随着烟叶的调制转化为新植二烯,形成浓郁的烤香[30-31]。3-甲基丁酸能够中和烟草的酸碱度,使吸味平和,减弱烟气的刺激性。其他酯类、杂环类化合物、醇类及醛类成分均为重要的致香物质,具有明显的香味特征。同时,2-4A 菌株产生的淀粉酶和纤维素酶催化降解产生单糖分子,增加还原糖的量,还原糖分解可以使烟气 pH 降低,并缓和烟气刺激性。
4 结论
本研究通过对烟叶醇化过程中的微生物进行分离筛选,得到一株2-4A 菌株具有同时分泌淀粉酶、果胶酶、纤维素酶和蛋白酶的能力,经鉴定为摩加夫芽孢杆菌。对菌株发酵条件进行优化,显著提高了该菌株分泌上述4种生物酶的能力。将该菌株的发酵液施用于烟叶发酵72 h 后,能够有效减少烟叶中淀粉、果胶、纤维素和蛋白质等生物大分子的含量,同时增加酮类、酸类、酯类、杂环类、醇类和醛类等致香物质含量。本研究获得的摩加夫芽孢杆菌在提升烟叶品质方面具有较大潜力。
参考文献
[1] 于少藤,毛淑蕊,胡安妥,等.改善烟叶品质微生物的筛选及其作用效果研究[J].南京农业大学学报,2021,44(4):766-777.
YU S T, MAO S R, HU A T, et al. Study on screening of microorganisms for improving tobacco leaf quality and their effects [J]. Journal of Nanjing Agricultural University, 2021, 44(4):766-777.
[2] 郝捷,季嫱,李力群,等.生物酶和微生物技术改善烟叶香气的研究进展[J].生物技术进展,2022,12(6):817-824.
HAO J, JI Q, LI L Q, et al. Research progress of enzyme and microbial technology to improve tobacco aroma[J]. Progress of Biotechnology, 2022, 12(6):817-824.
[3] POLOSA R ,FARSALINOS K ,PRISCO D. Health impact of electronic cigarettes and heated tobacco systems[J]. Internal and Emergency Medicine, 2019, 14(6):817-820.
[4] 李秀妮,李猛,万德建,等.烟叶微生物及其在烟叶发酵和醇化中的作用研究进展[J].微生物学通报,2019,46(6):1520-1529.
LI X N, LI M, WAN D J, et al. Role of microorganisms in tobacco fermentation and alcoholization: a review[J]. Microbiology China, 2019, 46(6):1520-1529.
[5] LI J J, ZHAO Y Y, QIN Y Q, et al. Influence of microbiota and metabolites on the quality of tobacco during fermentation[J]. BMC Microbiology, 2020, 20(1):356.
[6] 沙云菲,董惠忠,张耀,等. 降解上部烟叶大分子物质的复合酶配制与条件优化[J].中国烟草科学,2018,39(3):80-88,97.
SHA Y F, DONG H Z, ZHANG Y, et al. Preparation of multienzyme complex and condition optimization for degradation of macromolecules in upper tobacco leaves[J]. Chinese Tobacco Science, 2018, 39(3):80-88, 97.
[7] FABRE C E, DUVIAU V J, BLANC P J, et al. Identification of volatile flavour compounds obtained in culture of Kluyveromycesmarxianus[J]. Biotechnology Letters, 1995, 17(11):1207-1212.
[8] 巩效伟,刀娅,赵伟,等.产香酵母菌筛选、条件优化及發酵产物在电子烟烟液中的应用[J].烟草科技,2020,53(2):62-71.
GONG X W, KOU Y, ZHAO W, et al. Aroma-producing yeasts: screening, optimization and application in e-liquids[J]. Tobacco Science & Technology, 2020, 53(2):62-71.
[9] 杨霄,崔志峰.酵母生物转化生产2-苯乙醇的研究进展[J].应用与环境生物学报,2006,12(1):140-144.
YANG X, CUI Z F. Progress in 2-phenylethanol production by biotransformation with yeast [J]. Chinese Journal of Applied and Environmental Biology, 2006, 12(1):140-144.
[10] YANG Y, PENG Q R, OU M Y, et al. Research progress in tobaccofermentation[J]. Journal of Biosciences and Medicines, 2018, 6(6):105-114.
[11] 崔钰杰,邹克兴,陈义昌,等.微生物和酶技术促进烟叶醇化的研究进展[J].农技服务,2022,39(7):66-71.
CUI Y J, ZOU K X, CHEN Y C, et al. Research progress of promoting tobacco leaf maturation by microorganism and enzyme technology[J]. Agricultural Technology Services, 2022, 39(7):66-71.
[12] 马科,蒋登科,龚霜,等.不同酶处理浓缩液对贵州烟草薄片品质的影响研究[J].轻工学报,2022,37(1):62-67.
MA K, JIANG D K, GONG S, et al. Effects of different enzyme treatment concentrate on the quality of Guizhou tobacco flake[J]. Journal of Light Industry, 2022, 37(1):62-67.
[13] 范晓静,杨瑞先,邱思鑫,等.果胶酶基因在内生芽孢杆菌中的过表达及其对定殖的影响[J].应用与环境生物学报,2013,19(5):805-810.
FAN X J, YANG R X, QIU S X, et al. Overexpression of pectinase gene in Endogenic Bacillus and its effect on colonization[J]. Chinese Journal of Applied & Environmental Biology, 2013, 19(5):805-810.
[14] 王娟,王帆,张鸽,等.烤烟烟叶淀粉含量5种测定方法的比较[J].分子植物育种,2019,17(5):1673-1678.
WANG J, WANG F, ZHANG G, et al. Comparison of five methods for starch measurement in tobaccos[J]. Molecular Plant Breeding, 2019, 17(5):1673-1678.
[15] 安玉民,王菊葵,黄烨,等.马铃薯秸秆中纤维素与半纤维素含量的测定[J].现代农业科技,2016(17):159-160.
AN Y M, WANG J K, HUANG Y, et al. Determination of cellulose and hemicellulose content in potato stalk[J]. Modern Agricultural Science and Technology, 2016(17):159-160.
[16] 曾春函,王传华.我国主要蜜环菌生物种胞外酶活性对温度的种特异性响应[J].菌物学报,2019,38(2):195-209.
ZENG C H, WANG C H. Specificity response of extracellular enzyme activities to temperature of eight Armillaria species in China [J]. Mycosys Tema, 2019, 38(2):195-209.
[17] 胡申才,李良,李俊薇,等.清香型白酒酿造核心功能微生物的研究与应用[J].中国酿造,2021,40(2):16-19.
HU S C, LI L, LI J W, et al. Research and application of core functional microorganisms in light-flavor Baijiu brewing[J]. China Brewing, 2021, 40(2):16-19.
[18] WANG Z M, LU Z M, SHI J S, et al. Exploring flavour-producingcore microbiota in multispecies solidstate fermentation of traditional Chinese vinegar [J]. Scientific Reports, 2016, 6(1):1-10.
[19] SUKRAMA I D M, FRANCISKA J, SUARDANA I W. Evaluationof the bacteriocin produced by strain 9 lactic acid bacteria isolate for biopreservation [J]. Veterinary World, 2020, 13(9):2012-2019.
[20] 杜飞,喻阑清,周家喜,等.两种产香微生物分离鉴定及其发酵液增香烟草研究[J].山地农业生物学报,2021,40(1):14-21.
DU F, YU L Q, ZHOU J X, et al. Isolation and identification of two aroma-producing microorganisms and their fermented liquid to increase the aroma of tobacco[J]. Journal of Mountain Agriculture and Biology, 2021, 40(1):14-21.
[21] 郭林青,朴永革,朱春阳,等.烟草产香酵母 YG-4的筛选鉴定及香气成分分析[J].轻工学报,2019(5):27-31.
GUO L Q, PU Y G, ZHU C Y, et al. Marin screening and identification of aroma-producing yeast YG-4 and analysis of its aroma components[J]. Journal of Light Industry, 2019(5):27-31.
[22] 薛云,宁振兴,苏赞,等.基于芽孢杆菌固态发酵技术提高广西河池 C4F 烟叶品质的研究[J].轻工学报,2022,37(5):76-84.
XUE Y, NING Z X, SU Z, et al. Study on improving the quality of C4F tobacco leaf in Hechi, Guangxi Province based on Bacillus solid fermentation technology[J]. Journal of light Industry, 2022, 37(5):76-84.
[23] 張倩颖,罗诚,李东亮,等.雪茄烟叶调制及发酵技术研究进展[J].中国烟草学报,2020,26(4):1-6.
ZHANG QY, LUO C, LI D L, et al. Research progress in curing and fermentation technology for cigar tobacco leaf production[J]. Acta TabacariaSinica, 2020, 26(4):1-6.
[24] 叶建斌,王璐,杨峰,等.原烟发酵过程化学成分的变化规律[J].江苏农业科学,2019,47(20):212-217.
YE J B, WANG L, YANG F, et al. Chemical composition changes in process of raw tobacco fermentation[J]. Jiangsu Agricultural Sciences, 2019, 47(20):212-217.
[25] 杨娟,米其利,熊文,等.食源性乳酸菌在改善烟叶品质中的应用[J].浙江农业学报,2018,30(5):854-862.
YANG J, MI Q L, XIONG W, et al. Application of foodborne lactic acid bacteria in improving tobacco quality[J]. Acta AgriculturaeZhejiangensis, 2018, 30(5):854-862.
[26] 胡逸超,苏赞,雷薇,等.一株具有烟草甲毒杀作用的苏云金芽孢杆菌对烟叶的影响[J].南方农业学报,2022,53(6):1568-1576.
HU Y C, SU Z, LEI W, et al. Effects of a strain of Bacillus thuringiensis on tobacco leaves[J]. Journal of Southern Agriculture, 2022, 53(6):1568-1576.
[27] 王金棒,邱纪青,汪志波,等.生物技术在烟草发酵领域的专利布局现状及热点分析[J].烟草科技,2021,54(10):96-112.
WANG J B, QIU J Q, WANG Z B, et al. Analysis of patent distribution status and hot spots of biotechnology in tobacco fermentation field[J]. Tobacco Science and Technology, 2021, 54(10):96-112.
[28] 黄静文,段焰青,者为,等.短小芽孢杆菌改善烟叶品质的研究[J].烟草科技,2010,8(277):61-64.
HUANG J W, DUAN Y Q, ZHE W, et al. Improvement of flue-cured tobacco quality with Bacillus pumilus[J]. Tobacco Science and Technology, 2010, 8(277):61-64.
[29] WU X, ZHU P, LI D, et al. Bioaugmentation of Bacillusamyloliquefaciens-Bacillus kochii co-cultivation to improve sensory quality of flue-cured tobacco[J]. Arch. Microbiol., 2021, 203(9):5723-5733.
[30] 刘绍华,曲利利,白家峰,等.反应温度对以香荚兰为原料的美拉德产物分布及卷烟加香的影响[J].南方农业学报,2020,51(1):183-193.
LIU S H, QU L L, BAI J F, et al . Effects of reaction temperature on distribution of Maillard reaction products and tobacco flavoring with Vanilla as raw material[J]. Journal of Southern Agriculture ,2020,51(1):183-193.
[31] 龍章德,陈皓睿,刘鸿,等.来自六堡茶的3株散囊菌属真菌对烟草的发酵效果分析[J].南方农业学报,2018,49(10):2055-2061.
LONG Z D, CHEN H R, LIU H, et al. Fermentation effects of three Aspergillus spp. fungi derived from Liupao tea on the application in tobacco[J]. Journal of Southern Agriculture, 2018, 49(10):2055-2061.

