低聚木糖对泡菜理化性质、细菌群落动态影响研究
汤回花 李宏 刘毕琴 陈骏飞 任洪冰 王怡瑾 史巧


摘要:為探究低聚木糖(xylooligosaccharides,XOS)对泡菜发酵过程中细菌群落变化及产品品质的影响,对比了XOS和蔗糖分别作为底物时自然发酵卷心菜理化特性和代谢产物的变化。结果显示,发酵第6天时,相较于蔗糖泡菜(SF),低聚木糖泡菜(XF)具有更好的脆度(P<0.05);发酵第19天时,XF总酸含量仍为0.61 g/100 g,显著低于SF(P<0.05);XOS有助于延长泡菜最适口感的维持期。采用高通量测序技术对泡菜发酵过程中的细菌群落进行分析,共获得17个细菌门和210个细菌属,发酵第2天时,SF中魏斯氏菌属(Weissella)、肠杆菌属(Enterobacter)和乳球菌属(Lactococcus)的相对丰度较高,分别为37.60%、32.86%和19.26%,XF中魏斯氏菌属和肠杆菌属的相对丰度较高,分别为70.64%和20.51%;发酵第10天时,SF中主要以植物乳植杆菌属(Lactiplantibacillus plantarum,76.65%)、明串珠菌属(Leuconstoc,8.80%)为主,XF优势菌属为植物乳植杆菌属(89.97%)。RDA相关性分析显示魏斯氏菌属与泡菜的pH、脆度呈正相关,与总酸呈负相关;植物乳植杆菌属与pH、脆度呈负相关,与总酸呈正相关。XOS可能通过调控泡菜的细菌群落结构,提高泡菜的品质,为定向调控蔬菜发酵提供了参考。
关键词:低聚木糖;细菌多样性;质构;魏斯氏菌;泡菜
中图分类号:TS255.54 文献标志码:A 文章编号:1000-9973(2023)08-0098-08
Effects of Xylooligosaccharides on Physicochemical Properties and Bacterial Community Dynamics of Pickles
TANG Hui-hua1,2, LI Hong1,2, LIU Bi-qin1,2, CHEN Jun-fei1,2,
REN Hong-bing2, WANG Yi-jin2, SHI Qiao1,2*
(1.Institute of Agro-products Processing, Yunnan Academy of Agricultural Sciences, Kunming 650223,
China; 2.Yunnan Key Laboratory of Fermented Vegetables, Honghe 654300, China)
Abstract: In order to study the effects of xylooligosaccharides (XOS) on bacterial community change and product quality during pickle fermentation, the changes of physicochemical properties and metabolites of naturally fermented cabbage are compared when XOS and sucrose are used as the substrates respectively. The results show that the crispness of xylooligosaccharide pickles (XF) is better than that of sucrose pickles (SF) on the 6th day of fermentation (P<0.05), and the total acid content of XF is still 0.61 g/100 g on the 19th day of fermentation, which is significantly lower than that of SF (P<0.05); XOS is helpful to prolong the maintenance period of pickle optimum taste. High-throughput sequencing technology is used to analyze the bacterial community during pickle fermentation, and a total of 17 bacterial phyla and 210 bacterial genera are obtained.On the 2nd day of fermentation, the relative abundance of Weissella, Enterobacter and Lactococcus in SF is higher, which is 37.60%, 32.86% and 19.26% respectively; the relative abundance of Weissella and Enterobacter is higher in XF, which is 70.64% and 20.51% respectively. On the 10th day of
fermentation, Lactiplantibacillus plantarum (76.65%) and Leuconstoc (8.80%) are the main genera of SF, and the dominant genus of XF is Lactiplantibacillus plantarum(89.97%). RDA correlation analysis shows that Weissella is positively correlated with pH and brittleness of pickles, and negatively correlated with total acid; Lactiplantibacillus plantarum is negatively correlated with pH and brittleness, and positively correlated with total acid. XOS may improve the quality of pickles by regulating the bacterial community structure of pickles, which has provided references for targeted regulation of vegetable fermentation.
Key words: xylooligosaccharides (XOS); bacterial diversity; texture; Weissella; pickle
收稿日期:2023-03-03
基金项目:云南省科技厅重大科技专项(202002AE320006,202205AG070001)
作者简介:汤回花(1994—),女,助理研究员,硕士,研究方向:食品发酵。
通信作者:史巧(1983—),女,副研究员,博士,研究方向:食品发酵。
泡菜是我国一种广泛食用的传统发酵蔬菜。目前大多数关于发酵蔬菜的研究都强调了乳酸菌(lactic acid bacteria,LAB)在发酵中的重要性,即以明串珠菌属(Leuconostoc)、魏斯氏菌属(Weisella)为主的异型发酵阶段和以植物乳植杆菌属(Lactobacillus plantarum)为主的同型发酵阶段[1-2]。与同型发酵相比,异型发酵产生 CO2、甘露醇和乙醇等代谢产物,总酸较少,被认为有利于提高泡菜的感官品质[3-4]。四川泡菜采用明串珠菌和魏斯氏菌的混合发酵剂,可以加快发酵速度,减少总酸量,改善泡菜的感官特性[5]。
低聚木糖(XOS)是木糖单元组成的低聚糖,通常,XOS是通过由β-1,4糖苷键连接的木糖残基形成的寡糖混合物。参与其形成的木糖残基数量在2~10个之间,是一类潜在的益生元,具有免疫调节、抗癌、抗菌、生长调节、抗氧化等生物活性[6]。由于β-1,4糖苷键的存在,XOS 对宿主肠道的胃酶具有抗性,并促进益生菌的生长和增殖[7-8]。添加了XOS的食品可以滿足消费者对健康食品的需求,提升产品的附加值,扩宽XOS在食品中的应用领域[9]。 然而,到目前为止,XOS作为功能性低聚糖对泡菜理化品质和细菌群落的影响鲜有报道。本试验研究了XOS对泡菜的理化特性、总酸、质构、原果胶含量、代谢产物小分子糖含量、有机酸含量的影响,通过高通量测序技术探讨XOS对菌群多样性的影响,解析低聚木糖泡菜中细菌群落的变化规律,可为XOS在发酵蔬菜中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜卷心菜、白砂糖、相关辅料:购于昆明市售超市;低聚木糖:纯度94.81%,购于山东龙力生物科技股份有限责任公司(高相液相自测,采用面积归一化法);木二糖~木五糖各组分占比分别为53.99%、32.55%、6.72%和1.55%,聚合度范围为2~5。
葡萄糖、果糖、蔗糖(均为标准品) 德国DRE公司;木糖、木二糖、木三糖、木四糖、木五糖(均为标准品) Megazyme公司;乙酸、乳酸(均为标准品) 北京索莱宝科技有限公司;50%氢氧化钠溶液 赛默飞世尔科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
Five Easy Plus pH计 梅特勒-托利多仪器(上海)有限公司;TMS-Touch食品质构测定仪 美国FTC公司;Dionex ICS-5000+型离子色谱仪 美国Dionex公司;LC-20AT高效液相色谱仪(配有可变波长紫外检测器和示差检测器) 日本岛津公司。
1.3 方法
1.3.1 泡菜制备及样品处理
将卷心菜洗净,切成1 cm×10 cm左右的条状,装入密封罐中加入2.5倍体积的2%食盐水,其他配料(按食盐水计)为生姜5%、大蒜5%、辣椒0.3%、花椒0.5%。将泡菜分为2组:对照组加入2%蔗糖(SF),处理组加入4%低聚木糖(XF)。在25 ℃恒温条件下密封发酵。
样品处理:分别于第0,2,4,6,8,10,14,19天取泡菜水和泡菜。泡菜制作3个批次,每批次样品为2个重复的混样。在-80 ℃保存,以备后续分析。
1.3.2 pH值的测定
泡菜水的pH值直接用pH计测定。
1.3.3 总酸(TA)的测定
泡菜总酸测定参考GB/T 12456-2008《食品中总酸的测定》。
1.3.4 乳酸菌数的测定
泡菜水乳酸菌的测定参考GB 4789.35-2010《食品安全国家标准 食品微生物学检验 乳酸菌检验》[10]。
1.3.5 质构特性的测定
取长25 mm、厚10 mm的泡菜置于质构仪上进行压缩测试。选用P/6探头,以2.0 mm/s的恒定速度,压缩距离为6 mm,触发值为0.075 N。每组随机取10个样品进行测定,得到脆度值。
1.3.6 原果胶含量的测定
泡菜原果胶的测定根据原果胶试剂盒(上海索桥生物科技有限公司)方法进行。
1.3.7 小分子糖含量的测定
参考文献[11]的方法。取2.0 g泡菜水,以12 000 r/min离心15 min,上清液过0.22 μm滤膜,备用。 色谱条件:采用色谱柱CarboPac PA1(250 mm×4 mm),保护柱Carbo PacPA1(50 mm×4 mm);流动相A:H2O;流动相B:200 mmol/L NaOH,流速1 mL/min;梯度洗脱程序:50 mmol/L氢氧化钠水溶液(0~10 min)→200 mmol/L氢氧化钠水溶液(10~13 min)→200 mmol/L氢氧化钠水溶液(13~25 min)→50 mmol/L氢氧化钠水溶液(25~30 min);积分脉冲安培检测器,Au工作电极,AgCl参比电极,选用四波形电位采样;柱温30 ℃, 进样量25 μL。对泡菜水中葡萄糖、果糖、蔗糖、木糖、木二糖、木三糖含量进行测定。
1.3.8 有机酸含量的测定
参考文献[11]的方法。取1.0 g沥干的泡菜,加入5 mL流动相混合,制备成匀浆,于60 ℃超声处理30 min,再以12 000 r/min离心15 min,上清液过0.22 μm滤膜,备用。色谱条件:C18色谱柱(250 mm×4.6 mm, 5 μm),紫外检测器,流动相为0.01 mol/L磷酸二氢钾-水(3∶97,pH 2.8),流速1 mL/min,柱温40 ℃, 进样量25 μL,波长210 nm。
1.3.9 感官评价
由15名专业人员组成感官评价小组,对发酵6 d的样品进行盲评打分。实行25分制,采用分段计分,从色泽、香气、滋味、口感4个方面进行评定,具体评定标准见表1。
1.3.10 DNA提取、测序和分析
采用PowerSoil DNA Isolation Kit 试剂盒提取泡菜水的总DNA,PCR扩增16S rRNA基因全长用于SMRT测序,使用正向引物27F(5'-AGGTTTGATYNTGGCTCAG-3')和反向引物1492 R(5'-TASGGHTACCTTGTTASGACTT-3')。PCR程序:扩增程序:95 ℃预变性5 min,30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s),然后72 ℃稳定延伸7 min。之后用 1%琼脂糖凝胶电泳检测 DNA 的纯度和浓度。高通量测序由北京百迈客生物科技有限公司基于PacBio测序平台完成。使用Smart Link V8.0软件,按照 min Passes(最小循环数)≥5,min Predicted Accuracy(最小准确度)≥0.9 识别CCS序列,进行序列预处理。然后使用Lima V1.7.0软件通过 Barcode 序列识别不同样品的CCS序列并去除嵌合体,得到 Effective CCS序列。使用Usearch v10.0在相似度97%的水平上将Effective CCS 序列聚类为OTUs;通过QIIME 2(https://qiime2.org/)计算ACE、Chao 1、Shannon、Simpson指数,使用R软件分析样品稀释曲线、Alpha多样性指数差异。通过QIIME 2测定Beta多样性,采用主坐标分析(PCA)对Beta多样性进行分析。多级物种差异判别分析(LEfSe)分析菌群组成,LDA Score筛选值为3.5,R软件分析组间差异显著物种。采用冗余分析(RDA)方法探讨不同因素间微生物组成的差异,进行相关性分析。以上分析内容均在 BMKCloud(www.biocloud.net)上完成。
1.3.11 数据处理
采用统计学软件SPSS 17.0对试验数据进行统计分析,采用Origin 8.5软件作图,每个试验重复3次。
2 结果与分析
2.1 理化指标
2.1.1 pH和总酸
pH和总酸是影响泡菜风味品质的重要指标[12]。泡菜的 pH 在发酵初始阶段迅速下降并在随后几天趋于稳定(见图1),与SF相比,XF的pH 后期下降较慢,pH在发酵第10天时达到3.57,而SF在发酵第8天时达到3.55,且从第8天开始不同处理间差异显著(P<0.05)。 Iliev等[13]研究了3种乳杆菌在不同碳源培养基上的生长情况,结果表明在以XOS为唯一碳源时,发酵终点时pH显著高于葡萄糖对照组。总酸的变化趋势与pH相反,在整个发酵过程中均呈上升趋势。随着低盐低酸泡菜产品在市场上大受欢迎,泡菜过酸是一个需要解决的问题,有研究表明泡菜总酸在0.6 g/100 g左右风味最佳[14]。SF在发酵第6天时总酸含量为0.61 g/100 g,XF在发酵第8天时总酸含量为0.61 g/100 g。随着发酵的继续,在第19天时,SF总酸含量增加至0.75 g/100 g,XF总酸含量仍然为0.61 g/100 g(P<0.05)。Park等[15]对比了黄原胶对泡菜pH和总酸的影响,发现添加黄原胶发酵泡菜的pH高于空白对照组,总酸低于空白对照组,表明该多糖的添加有助于减少总酸的生成。
注:SF表示蔗糖发酵泡菜,XF表示低聚木糖发酵泡菜。不同字母表示不同发酵时间下差异显著(P<0.05),下图同。
2.1.2 发酵过程中乳酸菌数变化
泡菜发酵过程中乳酸菌数的变化见表2,随着发酵的进行,乳酸菌数逐渐增加,发酵第4天后,乳酸菌数开始减少,其变化趋势与Yang等[16]的研究结果一致。对比整个发酵过程,可发现XF的乳酸菌数总体低于SF泡菜,与pH、总酸的变化趋势一致。
2.1.3 质构和原果胶含量
质构是反映泡菜品质的重要指标。质构软化和脆度下降主要是由于蔬菜加工过程中细胞壁结构和组成的变化,尤其是果胶多糖的变化[17]。由图2可知,发酵第2天时,SF和XF的脆度由新鲜样品的58.87 N显著下降为29.16 N和31.92 N,XF的脆度在發酵第4天时略有增加但不显著,在随后的发酵过程中逐渐下降。然而,从第4天起,XF的脆度总是显著高于SF(P<0.05)。
原果胶是果蔬细胞壁的重要成分,与纤维素和半纤维素等交联,在黏结细胞和维持组织脆度方面起着重要作用[18]。原果胶含量越多,样品越容易保持其质构。由图2可知,原果胶的变化趋势与脆度一致,发酵前4 d原果胶含量呈明显下降趋势,SF和XF中原果胶含量由新鲜样品的29.50 μmol/g分别下降至1.73 μmol/g和2.32 μmol/g,这可能是由于在发酵前期产果胶酶细菌如果胶杆菌(Pectobacterium)、不动杆菌属(Acinetobacter)和假单胞菌属(Pseudomonas)快速生长,原果胶的酶水解作用较快[19-20],因此,在发酵前期样品中原果胶迅速下降,在发酵中后期含量变化不大。但从发酵第6天开始,XF的原果胶含量显著高于SF(P<0.05),推测XF前期产酸迅速,可抑制产果胶酶细菌的生长。
2.1.4 小分子糖含量
游离糖、有机酸等泡菜代谢物对泡菜的感官特性影响很大。在发酵过程中,这些泡菜代谢物的变化会受到微生物群落的显著影响。葡萄糖和果糖是泡菜中发现的主要游离糖,在发酵过程中对乳酸菌的生长发挥着重要作用[21]。通过测定发酵液中糖含量的变化反映泡菜发酵程度,由表3可知,SF中的葡萄糖含量在发酵开始时迅速增加,可能源于蔗糖的水解。发酵第2天时,蔗糖消耗量为64.62%,葡萄糖增长量为54.94%,果糖增长量为14.08%,随着发酵至第6天,糖变化趋于平缓,结合表2可知,乳酸菌数逐步下降,表明泡菜乳酸菌发酵基本结束。对XF而言,与第0天相比,发酵第2天时,泡菜内源葡萄糖、果糖渗出量大于微生物生长消耗量,木二糖和木三糖消耗量分别为31.77%和25.06%;发酵第4天起,葡萄糖、果糖浓度下降相较于低聚木糖更快,表明后续发酵过程中微生物快速利用葡萄糖和果糖,对木二糖和木三糖的利用速率不显著,这一结果可归因于发酵后期pH较低,能利用XOS的耐酸性微生物减少,其次单糖作为碳源更易被多数微生物消耗。木糖在整个发酵过程中含量逐渐增加,木四糖和木五糖在发酵过程中峰面积没有减小,表明微生物可分解木二糖和木三糖生成木糖,与前人的报道一致。Kanpiengjai等[22]研究多种乳酸菌对XOS的利用效果,发现乳酸乳球菌、植物乳植杆菌属优先利用木二糖、木三糖,产生木糖,Hernndez等[23]通过HPAEC-PAD和薄层层析分析了食窦魏斯氏菌株WcL17对XOS的消耗动力学,其优先分解短链XOS(木二糖、木三糖)以及生成木糖。SF与XF相比较,易于利用的碳源多,与乳酸菌数总体高的趋势一致。
2.1.5 有机酸含量
泡菜发酵过程中有机酸含量的变化见图3,乳酸菌可以通过同型发酵和异型发酵途径分解糖类从而产生有机酸。其中,乳酸为主要代谢产物,其含量最高且具有温和的酸味;乙酸具有强烈的刺激作用,能增强泡菜的香气和酸度,改善食欲[24-25]。发酵前2 d,SF和XF中乙酸和乳酸含量无明显差异,SF在发酵第6天时乳酸和乙酸含量分别为4.82,1.59 mg/g,XF分别为3.76,1.42 mg/g。随着发酵的进行,发酵第19天时,SF的乳酸和乙酸含量分别为8.95,1.91 mg/g,XF分别为8.23,1.69 mg/g,发酵终点时SF的乳酸含量显著高于XF(P<0.05),这与其发酵后期低pH和高总酸的趋势一致。在整个发酵周期,SF乳酸含量均高于XF,这可能是由于泡菜相关乳酸菌以蔗糖为底物产乳酸率高[26-27]。XOS虽然也能产乳酸,但由于糖代谢途径存在差异,仅产β-d-木糖苷酶和 endo-1,4-β-木聚糖酶的乳酸菌才能进行水解,因而产乳酸率较低[28]。
2.2 感官评价结果
泡菜的感官品质直接决定了消费者的饮食偏好。因此,感官评价对泡菜的品质极其重要。由表4可知,在色泽、滋味、口感方面,XF显著优于SF(P<0.05),相关文献报道XOS具有优异的羟基自由基清除能力[29-30],对泡菜可能具有护色作用。其次,XF感官品质与pH、质构等指标一致。
2.3 细菌Alpha多样性
对24个样本进行高通量16S rDNA V1~V9区域测序,获得312 791个原始序列。经过质量控制,获得307 494个序列。样本的平均覆盖率为98.31%。样本序列长度主要集中在1 450~1 492 bp。根据97%的序列相似度水平,将样本分类为可操作分类单元(OTU)。24个样本细菌分类统计数目为17个门、29个纲、66个目、121个科、210个属、265种、311个OTU。
稀释曲线(Shannon指数)接近平台期达到饱和(见图4),表明测序数据足以代表整个种群。Alpha指数评估微生物群落丰度和多样性见表5,Chao 1和Ace指数用于衡量物种丰度即物种数量的多少,Shannon和Simpson指数用于衡量物种多样性。在这项研究中,所有样品在发酵开始时都具有最高的细菌多样性,随着发酵的进行逐渐减少,SF的Simpson指数和Shannon指数减少慢于XF,反映XF可以快速形成优势菌群,增加发酵过程的稳定性。
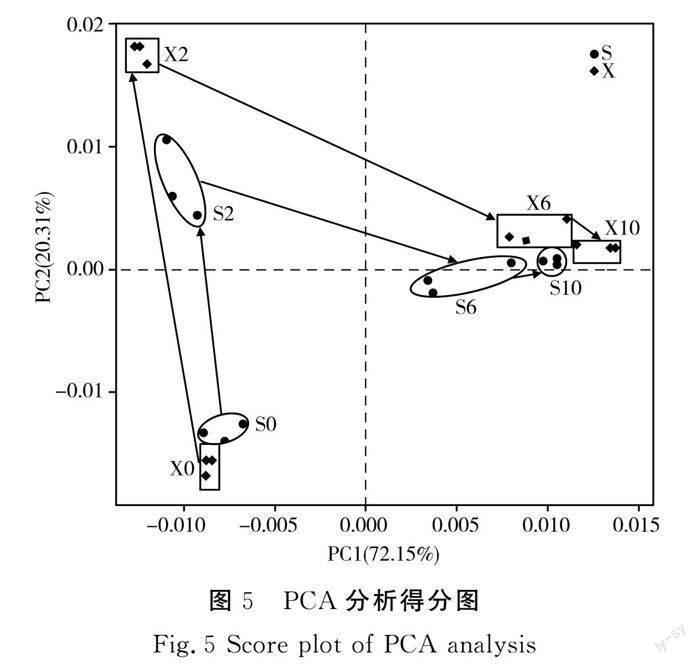
2.4 细菌β多样性
由图5可知,第一主成分(PC1)和第二主成分(PC2)可以解释92.46%的原始变量信息,很大程度上可以反映添加两种不同碳源与发酵时间变化引起的细菌多样性差异。SF和XF根据发酵时间不同分为3个发酵阶段,包括2个快速转变和1个缓慢转变。第一次快速转变发生在第0~2天,推测随着发酵的开始菌落组成发生明显变化;第二次快速转变发生在第2~6天,乳酸菌发酵从异型发酵向同型发酵过渡,从而导致变化较大;第三次缓慢转变发生在第6~10天,由于发酵进入后期直至发酵结束,细菌变化较小。由图5可知,两组起点接近,变化趋势一致,XF发酵过程中细菌组成变化更大,表明碳源在一定程度上影响发酵过程中微生物菌落组成。
2.5 细菌组成
由图6可知,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)在发酵早期阶段作为主要门存在。在发酵第0天,SF中主要的门相对丰度占比分别为变形菌门89.91%、厚壁菌门5.04%和拟杆菌门2.16%。XF分别为变形菌门96.04%和厚壁菌门2.26%。随后,在发酵前2 d期间,厚壁菌门的相对丰度显著增加,而其他门占比较小。相较于SF,XF中厚壁菌门在前2 d内从2.26%迅速增加至79.29%,而SF则从5.04%增加为66.94%。发酵结束时,厚壁菌门在两组中是最主要的门,SF的相对丰度为92.27%,XF的相对丰度为95.74%。其次是变形菌门,相对丰度分别为7.71%和4.22%。
由图7可知,发酵第0天的SF中主要的属相对丰度占比分别为肠杆菌属(Enterobacter)25.41%、Paucibacter属25.01%和不动杆菌属(Acinetobacter)22.50%,而XF中相对丰度占比高的为不动杆菌属(41.42%)、肠杆菌属(22.93%)。随后,魏斯氏菌属的相对丰度迅速增加,然后下降直至发酵完成,峰值出现在第2天,分别为SF 37.60%和XF 70.64%,乳球菌属(Lactococcus)在第2天时也达到峰值,分别为SF 19.26%和XF 8.62%,明串珠菌属峰值出现在第6天,分别为SF 12.25%和XF 0.28%。XF 魏斯氏菌属在发酵第2天时的相对丰度明显高于SF,推测XOS促进发酵早期魏斯氏菌属增殖。在菌属水平上采用LEfSe分析,发现明串珠菌属为组间差异微生物。谷新晰等[31]研究了壳寡糖对泡菜微生物多样的影响,发现壳寡糖试验组的优势菌为乳球菌属,蔗糖组为成团泛菌属、明串珠菌属等,表明特定碳源对菌群生长存在差异。文献报道XOS 由于其寡聚糖结构仅能被特定乳酸菌利用,从而影响菌群结构[32],研究表明拟杆菌属、魏斯氏菌属、植物乳植杆菌属、短乳杆菌属可利用XOS[33-35]。结合表3可推断,在发酵前期,魏斯氏菌属通过利用木二糖和木三糖形成优势,而其他部分明串珠菌属不能利用低聚木糖底物[36],XF组不占优势。随着发酵的进行,葡萄糖被快速利用,伴随着植物乳植杆菌属的生长。发酵结束时SF中主要以植物乳植杆菌属(76.65%)、明串珠菌属(8.80%)为主,XF的相对丰度主要为植物乳植杆菌属89.97%。
在菌属水平上,SF和XF的pH、總酸(TA)、脆度(B)与细菌群落相关性分析结果见图8。
RDA分析共解釋了59.44%的微生物菌群与环境因子之间的关系。在所示乳酸菌属中,魏斯氏菌属与pH、脆度呈正相关,与总酸呈负相关,植物乳植杆菌属与pH、脆度呈负相关,与总酸呈正相关。Herna'ndez等[23]研究表明5株魏斯氏菌种均有代谢XOS的能力,还具备β-葡萄糖苷酶和β-半乳糖苷酶活性。因此,XOS有助于提高泡菜发酵中魏斯氏菌属的丰度,从而改变泡菜微生物菌群组成,促使泡菜具有更佳的感官品质。Wang等[37]研究表明,接种Weissella cibaria CPTCC 1R15 可增强泡菜的风味。Gupta等[32]研究表明,以XOS 作为唯一碳源改良MRS 中培养植物乳植杆菌 M-13,获得的无细胞上清液对多种病原细菌表现出高抑制潜力,此外,乳酸菌利用XOS可产生短链脂肪酸,影响菌群结构。XOS可以选择性促进特定乳酸菌增殖,从而调控发酵过程,提高泡菜品质。
3 结论
本试验研究XOS对泡菜自然发酵过程中细菌群落变化及产品品质的影响。pH、总酸结果显示,XOS有助于减少总酸的生成量,延缓发酵后期pH的下降;保持泡菜的脆度、原果胶含量。感官结果表明,XOS有助于延长泡菜最适口感的维持期。相较于蔗糖,添加XOS促使发酵早期魏斯氏菌属成为优势菌属,发酵后期植物乳植杆菌属成为优势菌属;明串珠菌属在菌落组成中不占优势,为组间差异微生物。推测XOS通过调控泡菜的细菌群落结构,提高泡菜的品质。本研究可为提高发酵蔬菜生产的可控性提供理论依据。
参考文献:
[1]GUAN Q Q, ZHENG W D, HUANG T, et al. Comparison of microbial communities and physiochemical characteristics of two traditionally fermented vegetables[J].Food Research International,2020,128:108755.
[2]LIANG H P, CHEN H Y, ZHANG W X, et al. Investigation on microbial diversity of industrial Zhacai paocai during fermentation using high-throughput sequencing and their functional characterization[J].LWT-Food Science and Technology,2018,91(2):460-466.
[3]MOON S, KIM C, CHANG H. Heterofermentative lactic acid bacteria as a starter culture to control kimchi fermentation[J].LWT-Food Science and Technology,2017,88:181-188.
[4]朱孔亮.泡菜用乳酸菌的筛选、高密度培养及菌剂配方的研究[D].无锡:江南大学,2014.
[5]LUO Y L, LIU Y L, REN T, et al. Sichuan paocai fermented by mixed-starter culture of lactic acid bacteria[J].Food Science & Nutrition,2020,8(10):5402-5409.
[6]YANG J, XU Y X. Functional Carbohydrate Polymers: Prebiotics[M]//Polymers for Food Applications,Berlin:Springer,2018:651-691.
[7]HOLSCHER H D.Dietary fiber and prebiotics and the gastrointestinal microbiota[J].Gut Microbes,2017,8(2):172-184.
[8]ZHANG S S, HU H J, WANG L F, et al. Preparation and prebiotic potential of pectin oligosaccharides obtained from citrus peel pectin[J].Food Chemistry,2018,244:232-237.
[9]PALANI A, ANTONY U, EMMAMBUX M N. Current status of xylooligosaccharides: production, characterization, health benefits and food application[J].Trends in Food Science & Technology,2021,111:506-519.
[10]中国人民共和国卫生部.食品安全国家标准 食品微生物学检验 乳酸菌检验:GB 4789.35-2010[S].北京:中国标准出版社,2010.
[11]ZHANG C C, ZHANG J M, LIU D Q. Biochemical changes and microbial community dynamics during spontaneous fermentation of Zhacai, a traditional pickled mustard tuber from China[J].International Journal of Food Microbiology,2021,347(2):109199.
[12]AN F Y, SUN H J, WU J R, et al. Investigating the core microbiota and its influencing factors in traditional Chinese pickles[J].Food Research International,2021,147:110543.
[13]ILIEV I, VASILEVA T, BIVOLARSKI V, et al. Metabolic profiling of xylooligosaccharides by lactobacilli[J].Polymers,2020,12(10):2387.
[14]MHEEN T I, KWON T W. Effect of temperature and salt concentrations on kimchi fermentation[J].Korean Journal of Food Science and Technology,1984,16(4):443-450.
[15]PARK W P. The quality characteristics of kimchi as affected by the addition of xanthan gum[J].Journal of the Korean Society of Food Science and Nutrition,2002,31(3):423-427.
[16]YANG X T, SONG X L, WANG Y Y, et al. Effects of glycine and lactic acid bacteria starter on the quality, function and bacterial community of pickles[J].Function and Bacterial Community of Pickles,2021:508.
[17]WANG D, MA Y, SUN X, et al. Effect of dense phase carbon dioxide treatment on physicochemical and textural properties of pickled carrot[J].CyTA-Journal of Food,2019,17(1):988-996.
[18]DONG W, LI L, CAO R X, et al. Changes in cell wall components and polysaccharide-degrading enzymes in relation to differences in texture during sweetpotato storage root growth[J].Journal of Plant Physiology,2020,254:153282.
[19]张菊,薛永常.细菌果胶酶的研究进展[J].生物技术通报,2011(2):56-60.
[20]DAI X Y, KONG M, WANG X L, et al. Preparation, characterization and catalytic behavior of pectinase covalently immobilized onto sodium alginate/graphene oxide composite beads[J].Food Chemistry,2018,253(1):185-193.
[21]HA J H, HAWER W S, KIM Y J, et al. Changes of free sugars in kimchi during fermentation[J].Korean Journal of Food Science and Technology,1989,21(5):633-638.
[22]KANPIENGJAI A, NUNTIKAEW P, WONGSANITTAYARAK J, et al. Isolation of efficient xylooligosaccharides—fermenting probiotic lactic acid bacteria from ethnic pickled bamboo shoot products[J].Biology,2022,11(5):638.
[23]HERNNDEZ O D, LPEZ S R, LOZANO L, et al. Diversity of Weissella confusa in pozol and its carbohydrate metabolism[J].Frontiers in Microbiology,2021,12:629449.
[24]郝懿.加鹽量对自然发酵香椿泡菜的品质及微生物菌群的影响[D].咸阳:西北农林科技大学,2021.
[25]OGUNTOYINB F A, FUSCO V, CHO G S, et al. Produce from Africa's gardens: potential for leafy vegetable and fruit fermentations[J].Frontiers in Microbiology,2016,7:981.
[26]MACORI G, COTTER P D. Novel insights into the microbiology of fermented dairy foods[J].Current Opinion in Biotechnology,2018,49:172-178.
[27]ZHENG J S, WITTOUCK S, SALVETTI E, et al. A taxonomic note on the genus Lactobacillus: description of 23 novel genera, emended description of the genus Lactobacillus beijerinck 1901,and union of Lactobacillaceae and Leuconostocaceae[J].International Journal of Systematic and Evolutionary Microbiology,2020,70(4):2782-2858.
[28]SANCHEZ J I, MARZORATI M, GROOTAERT C, et al. Arabinoxylanoligosaccharides (AXOS) affect the protein/carbohydrate fermentation balance and microbial population dynamics of the Simulator of Human Intestinal Microbial Ecosystem[J].Microbial Biotechnology,2009,2:101-113.
[29]ZHOU T, XUE Y M, REN F J, et al. Antioxidant activity of xylooligosaccharides prepared from Thermotoga maritima using recombinant enzyme cocktail of β-xylanase and α-glucuronidase[J].Journal of Carbohydrate Chemistry,2018,37(4):210-224.
[30]KHANGKHACHIT W, SUYOTHA W, LEAMDUM C, et al.Production of thermostable xylanase using Streptomyces thermocarboxydus ME742 and application in enzymatic conversion of xylan from oil palm empty fruit bunch to xylooligosaccharides[J].Biocatalysis and Agricultural Biotechnology,2021,37:102180.
[31]谷新晰,王晨笑,于宏偉,等.壳寡糖对泡菜品质、微生物多样及演替规律的影响[J].中国食品学报,2021,21(10):125-132.
[32]GUPTA M, BANGOTRA R, SHARMA S, et al. Bioprocess development for production of xylooligosaccharides prebiotics from sugarcane bagasse with high bioactivity potential[J].Industrial Crops and Products,2022,178:114591.
[33]ACHARY A A, PRAPULLA S G. Xylooligosaccharides (XOS) as an emerging prebiotic: microbial synthesis, utilization, structural characterization, bioactive properties, and applications[J].Comprehensive Reviews in Food Science and Food Safety,2011,10(1):2-16.
[34]JAICHAKAN P, NAKPHAICHIT M, RUNGCHANG S, et al.Two-stage processing for xylooligosaccharide recovery from rice by-products and evaluation of products: promotion of lactic acid-producing bacterial growth and food application in a high-pressure process[J].Food Research International,2021,147:110529.
[35]IMMERZEEL P, FALCK P, GALBE M, et al. Extraction of water-soluble xylan from wheat bran and utilization of enzymatically produced xylooligosaccharides by Lactobacillus, Bifidobacterium and Weissella spp.[J].LWT-Food Science and Technology,2014,56(2):321-327.
[36]SHARMA A, SHARMA N, GUPTA D, et al. Comparative genome analysis of four Leuconostoc strains with a focus on carbohydrate-active enzymes and oligosaccharide utilization pathways[J].Computational and Structural Biotechnology Journal,2022,20:4771-4785.
[37]WANG D D, CHEN G, TANG Y, et al. Study of bacterial community succession and reconstruction of the core lactic acid bacteria to enhance the flavor of paocai[J].International Journal of Food Microbiology,2022,375:109702.

