虎尾草多糖提取工艺优化及其抗氧化研究
■ 陈建福
(1.漳州职业技术学院石油化工学院,福建漳州363000;2.福建省精细化工应用技术协同创新中心,福建漳州363000)
虎尾草(Chloris virgataSw.)又名盘草、棒锤草等,为禾本科一年生草本植物[1]。虎尾草种群生态位较宽,为农田常见的杂草之一,在全国各地均有分布[2-3]。虎尾草茎叶柔软、营养丰富,是放牧家畜重要的饲草来源之一[4]。另外,虎尾草还是盐碱地的先锋植物之一,在改良碱化荒地和碱化草原中具有重要的作用。目前,虎尾草的研究主要集中在分类、生态应用、抗盐碱性等[5],关于虎尾草有效成分提取工艺的研究还较少。多糖是一种存在于动植物体内、由多个单糖聚合而成的天然生物活性大分子,因其具有多种活性功能而成为研究的热点。目前多糖提取方法主要有溶剂提取、微波辅助、超声波辅助和酶辅助等几种提取方法[6],其中超声波法是利用超声波的空化、机械和剪切等作用,提高溶剂分子与植物组织细胞的碰撞频率和速率,以促进细胞破壁或变形,从而增加多糖溶出的一种方法,具有操作方便、提取时间短、提取效率高、无污染等优点[7]。蜗牛酶是从蜗牛消化道和嗉囊中提取的一种由淀粉酶、果胶酶、纤维素酶等20 多种酶所组成的复合酶,具有同时破坏细胞壁上果胶和纤维素,以达到提高细胞通透能力[8]。目前关于超声协同蜗牛酶辅助提取虎尾草多糖的工艺还有待进一步研究。文章设计了超声协同蜗牛酶辅助提取虎尾草多糖工艺的单因素试验,并利用响应面法确定了最佳的提取工艺,再进一步利用红外光谱(FTIR)对所提取虎尾草多糖进行表征,最后探讨了虎尾草多糖对油脂的抗氧化性能,该研究为虎尾草开发成油脂产品添加剂提供应用参考。
1 材料与方法
1.1 试验材料
虎尾草:采于漳州市马鞍山;蜗牛酶:生物试剂,福州飞净生物科技有限公司;大豆油:实验室压榨;猪油,自制;特丁基对苯二酚(TBHQ):食品级,江西凯泰食品科技有限公司;其他试剂为市售分析纯。
1.2 试验方法
1.2.1 虎尾草多糖的提取工艺
将采摘的新鲜虎尾草洗净,自然干燥,切碎,冷冻后放入LGJ10-C 型冷冻干燥机(北京四环科学仪器厂)中干燥,粉碎过滤备用。取5 g 虎尾草粉,加入无水乙醇浸泡,过滤后,继续加入石油醚浸泡脱脂脱色,过滤后,滤渣加入烧瓶中,并按工艺要求设置,继续加入蒸馏水、缓冲溶液、蜗牛酶,在KQ-100DE 型超声波清洗器(昆山市超声仪器有限公司)中加热提取,结束后,加入一定比例的氯仿和正丁醇混合液进行振荡,然后去除蛋白质及有机溶剂并过滤,滤液定容至250 mL,测量多糖含量,然后醇沉,干燥,得虎尾草多糖。
1.2.2 虎尾草多糖含量的测定
以葡萄糖为标准品,测定虎尾草多糖的含量,配制一系列浓度梯度的葡萄糖溶液,按苯酚-硫酸法[9]要求加入相应试剂后在UV-1800PC-DS2型分光光度计(上海美谱达仪器有限公司)上测定溶液的吸光度(波长490 nm),绘制曲线并回归得到方程。y=0.110 9x-0.001 1[x为质量浓度(mg/L),y为吸光度],R2=0.999 7。
虎尾草多糖提取率由下式计算得:

式中:b——多糖质量浓度(mg/L);
V——提取液的体积(mL);
m——虎尾草质量(g)。
1.2.3 虎尾草多糖的红外光谱分析
采用德国Bruker 公司的Vertex70 型傅立叶红外光谱仪,利用κBr 压片法在500~4 000/cm 的波长范围内对多糖进行红外光谱测试。
1.2.4 虎尾草多糖对油脂的抗氧化能力测定
在5 个烧杯中分别加入50 g 的油脂(大豆油/猪油),任选一份为空白(CK),一份添加0.02%(以油脂质量为基准)的TBHQ,剩下三份依次添加0.02%、0.04%和0.06%的虎尾草多糖,搅拌均匀后存放于60 ℃的烘箱中,定期取样测定油脂的过氧化值,做三组平行试验,取均值。
1.3 单因素试验
固定单因素的基础条件为超声温度50 ℃、酶用量1.5%、超声时间40 min 和pH 5.0,在固定其他条件不变的情况下,分别考察各单因素(5 个水平)对虎尾草多糖提取率的影响,具体如下:超声温度(40、45、50、55、60 ℃)、酶用量(0.5%、1.0%、1.5%、2.0%、2.5%)、超声时间(20、30、40、50、60 min)和pH(4.0、4.5、5.0、5.5、6.0),每个水平试验做3次平行,取均值。
1.4 响应面试验设计
根据单因素的最佳取值范围,再通过Box-Behnk‐en 试验方法,以虎尾草多糖提取率为指标,设计超声温度(A)、酶用量(B)、超声时间(C)和pH(D)四因素三水平的响应面试验,具体如表1所示。

表1 Box-Bohnken因素与水平
2 结果与分析
2.1 单因素试验
2.1.1 超声温度对虎尾草多糖提取率的影响
由图1 可知,超声温度在50 ℃时,虎尾草多糖提取率达到峰值。虎尾草多糖提取体系在一定的超声温度作用下,可以促进蜗牛酶对虎尾草颗粒细胞膜和细胞壁的作用,提高了虎尾草多糖提取率,但超声温度过高时,蜗牛酶的酶活性逐渐下降,虎尾草多糖提取率也下降[10],因此超声温度选择为50 ℃。

图1 超声温度对虎尾草多糖提取率的影响
2.1.2 酶用量对虎尾草多糖提取率的影响
由图2 可知,当蜗牛酶用量在1.5%时,虎尾草多糖提取率达到峰值。虎尾草多糖提取体系在一定蜗牛酶用量范围内,增加蜗牛酶的用量,蜗牛酶与虎尾草多糖颗粒的作用面积增加,水解更加彻底,提高了虎尾草多糖的溶出,但酶用量过大时,过多的蜗牛酶将虎尾草多糖颗粒完全包裹,使得虎尾草多糖提取率下降[11],因此蜗牛酶用量选择为1.5%。

图2 酶用量对虎尾草多糖提取率的影响
2.1.3 超声时间对虎尾草多糖提取率的影响
由图3 可知,超声时间在40 min 时,虎尾草多糖提取率达到峰值。虎尾草多糖提取体系在蜗牛酶和超声波双重作用一定的时间后,虎尾草颗粒细胞膜及细胞壁充分受损而使得虎尾草多糖溶出增加,提高了虎尾草多糖提取率,但作用时间过长时,虎尾草多糖内结构较不稳定的化学键会断裂,使得虎尾草多糖提取率的下降[12]。因此超声时间选择为40 min。

图3 超声时间对虎尾草多糖提取率的影响
2.1.4 pH对虎尾草多糖提取率的影响
由图4可知,pH在5.0时,虎尾草多糖提取率达到峰值。虎尾草多糖提取体系在一定的pH环境下,蜗牛酶具有最高的活性,此时蜗牛酶与虎尾草颗粒作用的效率最高,虎尾草多糖提取率最大,而过高或过低的pH均使得蜗牛酶结构发生变化,而影响了蜗牛酶的活性,导致了虎尾草多糖提取率的下降[13],因此pH选择为5.0。
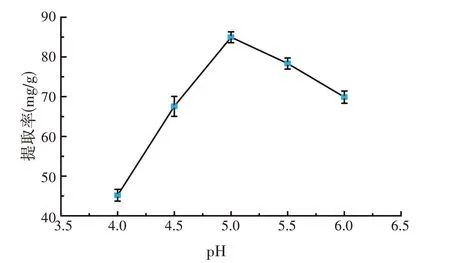
图4 pH对虎尾草多糖提取率的影响
2.2 超声协同蜗牛酶辅助提取虎尾草多糖工艺
2.2.1 响应面及回归模型分析
采用Design Expert 8.05b软件中的Box-Benhnken方法对影响虎尾草多糖提取率的超声温度(A)、酶用量(B)、超声时间(C)和pH(D)四个因素进行响应面试验设计,具体试验方案和试验结果如表2,分析结果如表3。
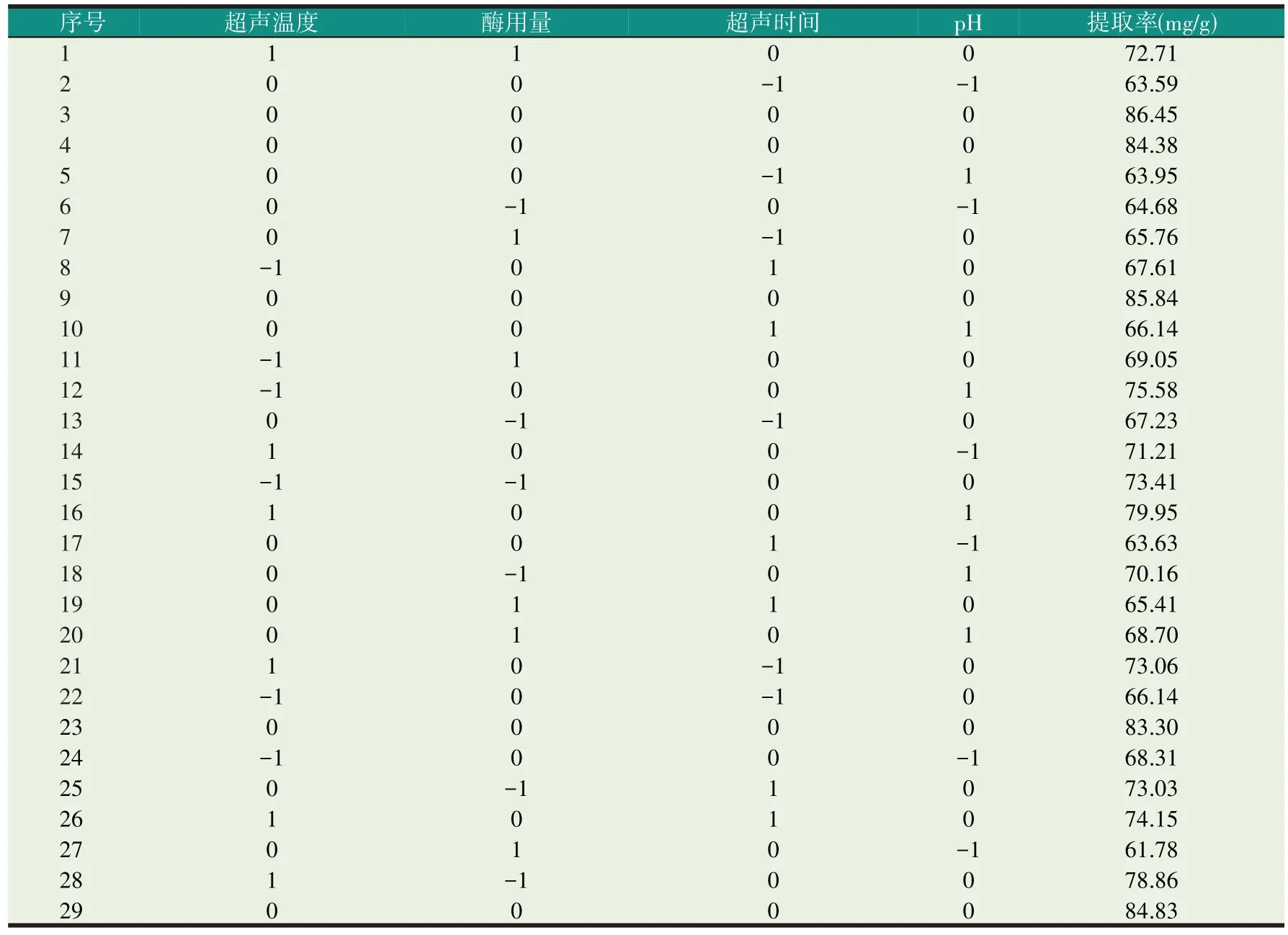
表2 响应面试验设计及结果
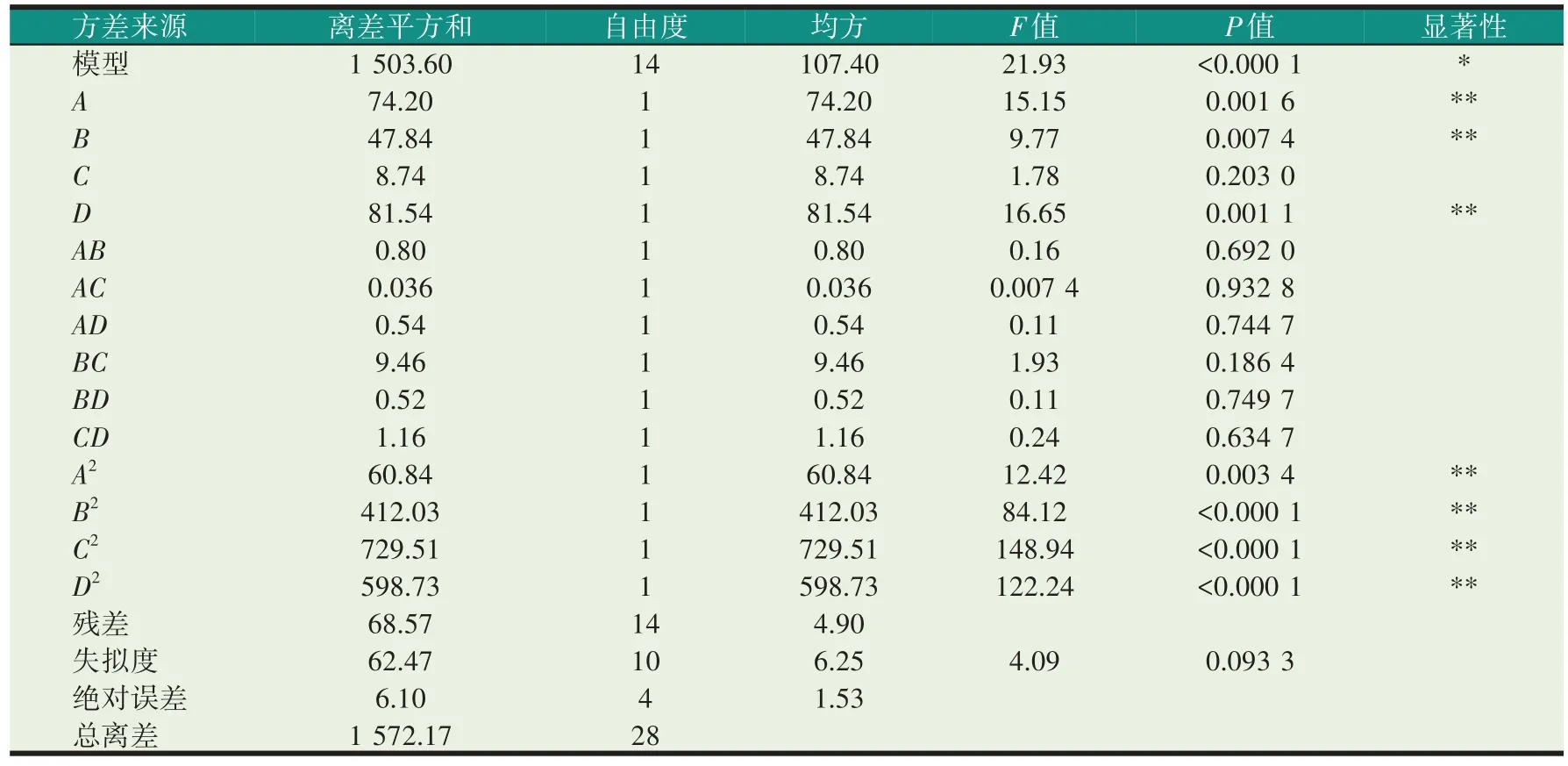
表3 方差分析结果
通过Design-Expert 8.05b 软件对表2 的试验结果进行处理,确定了超声温度(A)、酶用量(B)、超声时间(C)和pH(D)对虎尾草多糖提取率(Y)的四元二次回归方程。
回归方程的方差分析可得到回归方程的显著性及各工艺因素与提取率的影响关系,通过表3 可知该回归方程F=21.93,P<0.000 1,相关系数R2=0.956 4,表明该回归方程差异极显著;虎尾草多糖提取率的变化数据有95%以上可以用该回归方程来描述。失拟项F=4.09,P=0.093 3>0.05,差异不显著,说明该回归方程的预测值与试验的真实值具有较好的拟合度,综上分析,通过该回归方程来预测与分析试验的真实值具有一定的可信度和准确性。在回归方程中,各因素对虎尾草多糖提取率的影响程度不一,其中对虎尾草多糖提取率影响极显著的分别有一次项A、B、D,交互项BC、BD和二次项A2、B2、C2、D2;其余的均对虎尾草多糖提取率影响不显著,说明超声温度、酶用量、超声时间和pH 等工艺与虎尾草多糖提取率之间是特定的数学关系而不是简单的线性关系。通过方差分析中的参数可以直观地得到工艺对多糖提取率影响的大小顺序为:pH>超声温度>酶用量> 超声时间。
2.2.2 响应面分析
超声温度、酶用量、超声时间和pH四个工艺因素之间交互作用可通过Design-Expert 8.05b软件绘制出,并以响应曲面和等高线的图形呈现,如图5所考察的四个工艺因素中固定任意两因素时,剩余两因素间的交互作用程度,并可以通过响应曲面的坡度和等高线的圆率来判断两因素交互作用对多糖提取率的显著程度。通过分析和对比六个响应面曲面图和等高线可知,各因素间的交互作用对多糖提取率的影响均不显著,另外各因素间的显著程度顺序为:BC>CD>AB>AD>BD>AC。

图5 各工艺因素间交互作用关系
2.2.3 工艺验证试验
为进一步确定回归方程的可预测性,通过工艺试验对预测值进行验证,软件得到的预测最佳工艺条件为:超声温度52.12 ℃、酶用量1.43%,超声时间40.52 min和pH 5.07,在此条件下,从软件中得到多糖的最大提取率预测值为85.83 mg/g。通过对软件中最佳的工艺条件进行分析并结合试验条件,将工艺修正为:超声温度52 ℃、酶用量1.4%,超声时间41 min 和pH 5.1,最后进行3 次平行试验以便对修正后的工艺进行验证,得到虎尾草多糖提取率为85.12 mg/g,与最大的多糖提取率预测值的相对误差为0.83%,说明该回归方程误差小,准确性好,因此该方法应用于超声协同蜗牛酶辅助提取虎尾草多糖工艺的优化具有一定的应用意义。
2.3 虎尾草多糖的红外光谱
由图6可知,所提取的样品具有多糖的基本特征,在3 286/cm处的宽峰是多糖分子中O—H基团的伸缩振动特征吸收峰[14];2 875/cm处的吸收峰是多糖分子结构中饱和碳上的C—H的伸缩振动峰;1 650/cm是多糖分子中少量C=O的伸缩振动峰,1 413/cm是多糖分子中C—H变角的吸收峰,1 028/cm处的强吸收峰是多糖中β—吡喃糖环上醚键C—O—C和C—O—H的拉伸振动峰,923/cm和850/cm处的双峰是多糖中β-吡喃糖基的特征峰[15],因此虎尾草多糖中存在β-吡喃糖基。
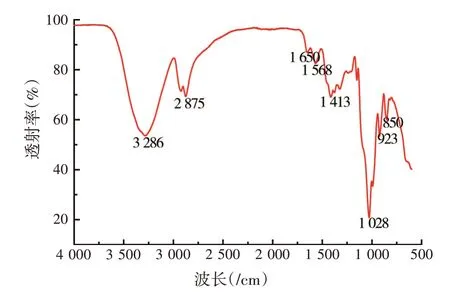
图6 虎尾草多糖的红外光谱
2.4 虎尾草多糖对油脂的抗氧化性能
食用油脂主要分为植物油脂和动物油脂,其中植物油脂中含有丰富的不饱和脂肪酸,暴露在空气中容易产生过氧自由基,而过氧自由基会进一步分解生成活性氧自由基或抢夺其他分子的氢原子生成碳自由基,进而产生自由基链式反应,导致油脂酸败[16]。而动物油脂则以饱和脂肪酸为主,与植物油脂相比,化学性质较为稳定,但在光照或高温环境下,油脂上羧基的α氢原子易被氧化成碳自由基,导致油脂酸败。作为活性氢供体,抗氧化剂能有效抑制或钝化油脂酸败过程产生的自由基,以达到延缓或阻断油脂酸败的目的[17]。
2.4.1 虎尾草多糖对大豆油的抗氧化性能影响
由图7 可知,各组大豆油的过氧化值均随着氧化时间的增加而增大,与空白(CK)样品相比,添加虎尾草多糖的大豆油其过氧化值均有不同程度的降低,并且随着虎尾草多糖用量的增加,其过氧化值降低越多,说明虎尾草多糖用量与大豆油的过氧化值呈现负向的量效关系,当虎尾草多糖添加量为0.04%时,大豆油的过氧化值略大于添加量为0.02%的TBHQ,而当虎尾草多糖添加量为0.06%时,虎尾草多糖对大豆油的抗氧化能力超过了添加量为0.02%的TBHQ,说明虎尾草多糖具有一定的抗氧化能力,能有效地降低大豆油过氧化值。

图7 虎尾草多糖对大豆油的抗氧化影响
2.4.2 虎尾草多糖对猪油的抗氧化性能影响
由图8 可知,各组猪油的过氧化值均随着强行氧化时间的增加而增大,与空白(CK)样品相比,添加虎尾草多糖的猪油其过氧化值均有不同程度的降低,并且随着虎尾草多糖用量的增加,其过氧化值降低越多,说明虎尾草多糖用量与猪油的过氧化值呈现负向的量效关系,当虎尾草多糖添加量为0.04%时,猪油的过氧化值略大于添加量为0.02%的TBHQ,而当虎尾草多糖添加量为0.06%时,虎尾草多糖对猪油的抗氧化能力超过了添加量为0.02%的TBHQ,说明虎尾草多糖具有一定的抗氧化能力,能有效地降低猪油过氧化值。

图8 虎尾草多糖对猪油的抗氧化影响
综上分析,虎尾草多糖对植物油脂和动物油脂均表现出一定的脂质抗氧化作用,其用量与油脂的过氧化值呈现出负向的量效关系,表明虎尾草多糖可作为提高油脂产品货架期的添加剂。
3 讨论
细胞壁破碎和多糖溶出是植物多糖提取的两个关键步骤,其中细胞壁破碎是提取过程的关键步骤。细胞壁主要由果胶、纤维素和半纤维素组成,要破碎细胞壁,就得采用一定的破壁方法,而不同的破壁方法有不同的提取效率。因此,通过多种提取方法的结合,可以兼具各种提取方法的优点,而使得提取方法具有省时、节能,多糖提取率高和生物活性好等优势。本研究利用超声协同蜗牛酶辅助对虎尾草多糖进行提取,确定了最佳的提取工艺为:超声温度52 ℃、酶用量1.4%,超声时间41 min 和pH 5.1,得到虎尾草多糖提取率为85.12 mg/g,与多糖提取率预测值的相对误差为0.83%。油脂是动物饲料中仅次于蛋白质的第二大营养素,在饲料的生产、加工和贮存过程中,油脂容易会发生氧化,摄入氧化酸败的油脂会对动物机体造成严重危害。本研究发现虎尾草多糖对植物油脂和动物油脂均表现出一定的脂质抗氧化作用,其用量与油脂的过氧化值呈现出负向的量效关系,表明虎尾草多糖可作为提高油脂产品货架期的添加剂。
4 结论
采用响应面法优化的超声协同蜗牛酶辅助提取工艺的条件可用于虎尾草多糖的提取,且提取的多糖中存在β-吡喃糖基,并表现出一定的脂质抗氧化作用,可作为油脂产品添加剂。

