瘤胃源牛链球菌提高紫花苜蓿的青贮品质
■ 蒋 慧 胡光辉 刘晓芳 林 淼*
(1.扬州大学动物科技学院,江苏扬州 225009;2.江苏省兴化市畜牧兽医站,江苏兴化 225700)
苜蓿(Medicago sativa)是奶牛的主要饲料原料之一,由于紫花苜蓿中水溶性碳水化合物(WSCs)含量低、缓冲能力强、附着乳酸菌含量低,导致紫花苜蓿青贮效果往往不理想,乳酸菌因其对健康有益、成本低、能耗低、产量高、具有“公认安全”(GRAS)等优点,而被用于解决苜蓿青贮的问题[1-2]。乳酸菌作为苜蓿青贮饲料中的添加剂,可将苜蓿中的WSCs 转化为乳酸和少量乙酸,从而降低青贮饲料的pH,抑制丁酸梭菌(Clostridium butyricum)等有害微生物的增殖,减少对饲料营养物质的消耗[3]。对于青贮来说,理想的发酵方式是乳酸菌产生足够的乳酸,因为在发酵过程中乳酸含量高意味着气体等次生代谢产物的减少。此外,还需要一定量的乙酸来保证饲料的好氧稳定性。然而,并不是所有的乳酸菌都能产生足够的乳酸来保证青贮饲料的质量,这通常与饲料与乳酸菌的相容性有关[4]。因此,筛选产乳酸能力强、能提高青贮苜蓿好氧稳定性的乳酸菌菌株是很有必要的。
牛链球菌(S.equinus)被认为是青贮的乳酸菌接种剂,特点是来自瘤胃而不是饲料,另一个特点是在20 min 内数量可翻倍,比青贮中使用的乳酸菌要快,是潜在的优良青贮菌株[5]。前期研究表明,添加牛链球菌能显著降低象草的pH 和氨态氮(NH3-N)含量(P<0.05),显著提高粗蛋白(CP)和干物质(DM)含量(P<0.05)[6]。坦桑尼亚草中添加牛链球菌也显著降低了pH、NH3-N、霉菌含量和肠杆菌含量(P<0.05),显著提高了干物质含量(P<0.05)[7]。
Streptococcus bovis 实验室前期研究从奶牛瘤胃中分离出6 株牛链球菌,并对其生物学特性进行了测定(https://doi.org/10.3390/fermentation8080385)。将菌株的16S rRNA 序列提交给NCBI(National Center for Biotechnology Information),获得登录编号。从获得的菌株中选择菌株ON182139、ON182142 和 ON221850作为乳酸青贮菌进行添加。
本研究旨在评价苜蓿中添加牛链球菌对紫花苜蓿青贮品质的影响,填补奶牛主要饲料原料中添加牛链球菌研究的空白。
1 材料与方法
1.1 试验菌株的获取
从扬州大学高邮实验农场选取3 头健康中国荷斯坦奶牛,分离到3株牛链球菌。3头健康中国荷斯坦奶牛均带有永久性瘤胃瘘管,体重[(625±25)kg]和生理状态相似。植物乳杆菌(L.plantarum)FE-1 购自宁夏大北农科技实业有限公司。
1.2 紫花苜蓿的获得
紫花苜蓿采自扬州大学江都实验农场,在现蕾期至初花期,第一茬收获。
1.3 青贮的处理
苜蓿收获后,在田间晾至表面无水分,然后运回实验室。用铡刀切成1~2 cm的小段后,均匀分成5部分,其中1 组不接种乳酸菌为对照组(CON),其余4 组按106CFU/g 的标准分别添加植物乳杆菌FE-1(CB 组)、牛链球菌ON182156(S1 组)、牛链球菌ON182157(S2组)、牛链球菌ON221872(S3 组)[8]。混合均匀后,按每个青贮袋(Hiryu KN 型,240 mm×360 mm;Asahika‐sei,东京,日本)1 kg的标准装袋进行青贮,每组设3个平行。5组分别在第3、6、12、30、60天开袋。用封口机(得力集团有限公司)密封后,置于室内通风阴暗处。
1.4 营养成分分析
1.4.1 青贮常规养分的测定
青贮料在65 ℃的烘箱(爱思瑞仪器科技有限公司)中烘烤48 h,测定干物质(DM)含量;青贮料在马弗炉(上海立辰仪器科技有限公司)以550 ℃灼烧3 h,测定饲料粗灰分(Ash)含量;粗蛋白(CP)含量采用凯氏定氮法测定;粗脂肪(EE)含量采用AOAC 法检测(1990)[9];中性洗涤纤维(NDF)含量和酸性洗涤纤维(ADF)含量按照Van Soest的方法测定;蒽酮法测定可溶性碳水化合物(WSC)含量。
1.4.2 青贮发酵品质的测定
取20 g 青贮料放入180 mL 纯化水中,轻轻摇晃混合1 min,然后用四层纱布过滤,并用pH 计(仪电科学仪器有限公司)测定滤液的pH;气相色谱法测定VFAs(华夏科创仪器有限公司),使用CP-WAX 毛细管柱(30 mm×0.53 mm×1 μm),气化室温度为200 ℃,FID 检测器温度为200 ℃,柱温升温速率为3 ℃/min,最终达到150 ℃;使用LD-乳酸试剂盒(南京建成生物工程研究所有限公司)测定乳酸含量;NH3-N 的含量采用次氯酸苯酚比色法测定。
1.4.3 青贮微生物数量测定
将上一步所得滤液连续稀释至原滤液的1/107,取100 μL 涂布在De Man Rogosa Sharp 培养基(MRS)上(青岛海波生物技术有限公司),在30 ℃恒温培养箱中孵育72 h,测定青贮饲料中的乳酸菌含量,同样取100 μL 涂布在孟加拉红琼脂培养基(青岛海波生物技术有限公司)和伊红美蓝琼脂培养基(广东环凯微生物科技有限公司)上,分别在28 ℃和37 ℃恒温培养箱中培养72 h,测定霉菌含量和肠球菌含量。
1.4.4 青贮有氧稳定性的测定
在青贮60 d结束时打开青贮袋,将每个青贮袋中的青贮饲料倒入一个5 L的玻璃瓶中,松散地放置,将温度计插入青贮饲料的中心,记录青贮饲料的发酵温度,同时将三个温度计放置在外部环境中,记录环境温度,记录的好氧稳定性为青贮饲料内部温度高于环境温度2 ℃的时间[10]。
1.5 数据分析
试验数据用SPSS 24.0 进行双因素方差分析(Tway ANOVA),使用LSD法进行多次比较,P<0.05表示差异显著。
2 结果与分析
2.1 苜蓿青贮常规营养成分
如表1所示,各组DM 随时间变化均有所下降,各组干物质在第60 天均显著低于第0 天(P<0.05),在第60 天时,试验组DM 含量显著高于CON 组(P<0.05),但各试验组之间差异不显著(P>0.05);时间和处理对各组Ash 含量影响较小,各组第60 天和第0 天相比差异不显著(P>0.05),第60天时各处理间差异同样不显著(P>0.05);各组的CP 含量随时间变化均有所降低,在第60 天时均显著低于第0 天(P<0.05),在第60 天时,CB 组和S3组显著高于其他组(P<0.05);各组的无氮浸出物受时间和处理的影响较小,第60天和第0天相比差异不显著(P>0.05),第60天时各组之间差异不显著(P>0.05);各组的NDF 和ADF 随时间变化均显著下降(P<0.05),在第60 天时各组NDF 之间无显著差异(P>0.05),试验组ADF显著低于对照组(P<0.05)。各组的WSC 随时间变化均有所下降,在第60 天均显著低于第0 天(P<0.05),在第60 天时CB、S2、S3 组均显著高于对照组(P<0.05)。
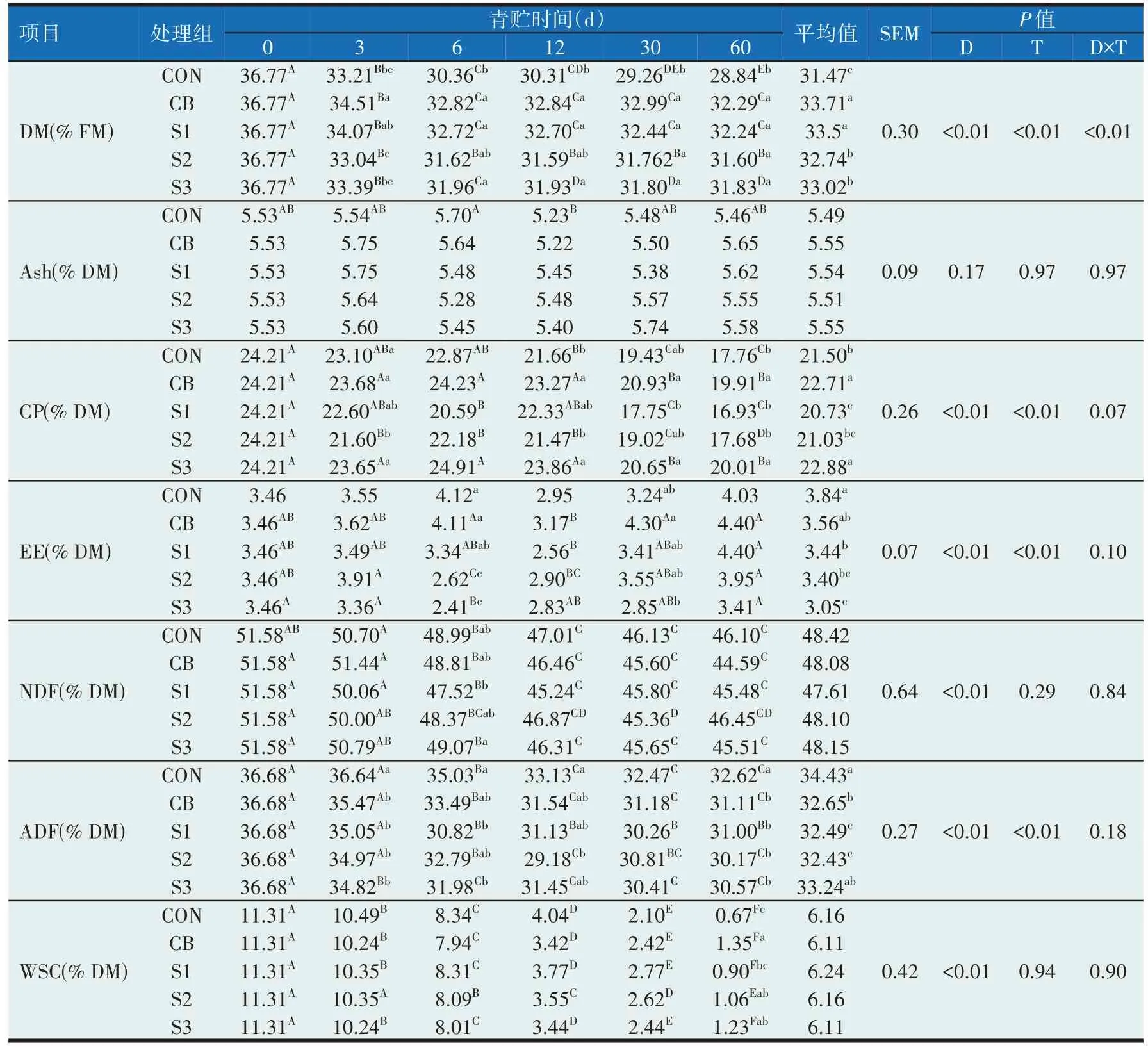
表1 青贮苜蓿化学成分的动态变化
2.2 青贮苜蓿的发酵品质
如表2 所示,CON、S1、S2 组和S3 组的pH 随时间变化先升高后降低,除CON 组和S1 组外,其他组的pH 在第60 天显著下降(P<0.05),CB 组和S3 组的pH显著低于其他组(P<0.05);各组乳酸含量均随时间的变化而先升高后降低,第60 天显著高于第0 天(P<0.05),其中S3 组显著高于其他各组(P<0.05);各组乙酸含量随时间变化逐渐升高,第60天显著高于第0天(P<0.05),且在第60 天时,试验组显著高于CON 组(P<0.05);各组的NH3-N 含量随时间变化均有所升高,在第60天时均显著高于第0天(P<0.05),在第60天时,CB、S2和S3组显著低于CON组(P<0.05)。

表2 青贮苜蓿发酵品质的动态变化
2.3 苜蓿青贮的微生物数量
由表3可知,添加乳酸菌后,第3天各组乳酸菌含量达到1×106CFU/g以上,在第12天时达到1×1010CFU/g以上,并且CB、S2、S3组乳酸菌含量显著高于其他组(P<0.05),在第30 天开始下降,在第60天降至1×106CFU/g左右,各组乳酸菌含量在第60天时均显著高于第0 天(P<0.05),各组的乳酸菌含量显著高于CON 组(P<0.05);肠球菌在0~6 d 持续增加,在第12 天开始减少,第60 天肠球菌数量降至最低浓度1×105CFU/g 左右,各组均显著低于第0 天(P<0.05),CON 组的肠球菌浓度显著高于其他组(P<0.05)。

表3 添加乳酸菌后苜蓿青贮饲料中乳酸菌、肠球菌和霉菌数量的变化(lg CFU/g FM)
2.4 添加不同乳酸菌对苜蓿青贮有氧稳定性的影响
由图1 可知,青贮苜蓿开袋60 d 后,CON 组的温度在126 h 时比环境温度高出2 ℃,S1 组的温度在162 h时比环境温度高出2 ℃,而CB、S2组和S3组的添加量没有达到高于环境温度2 ℃,直到开袋后200 h。
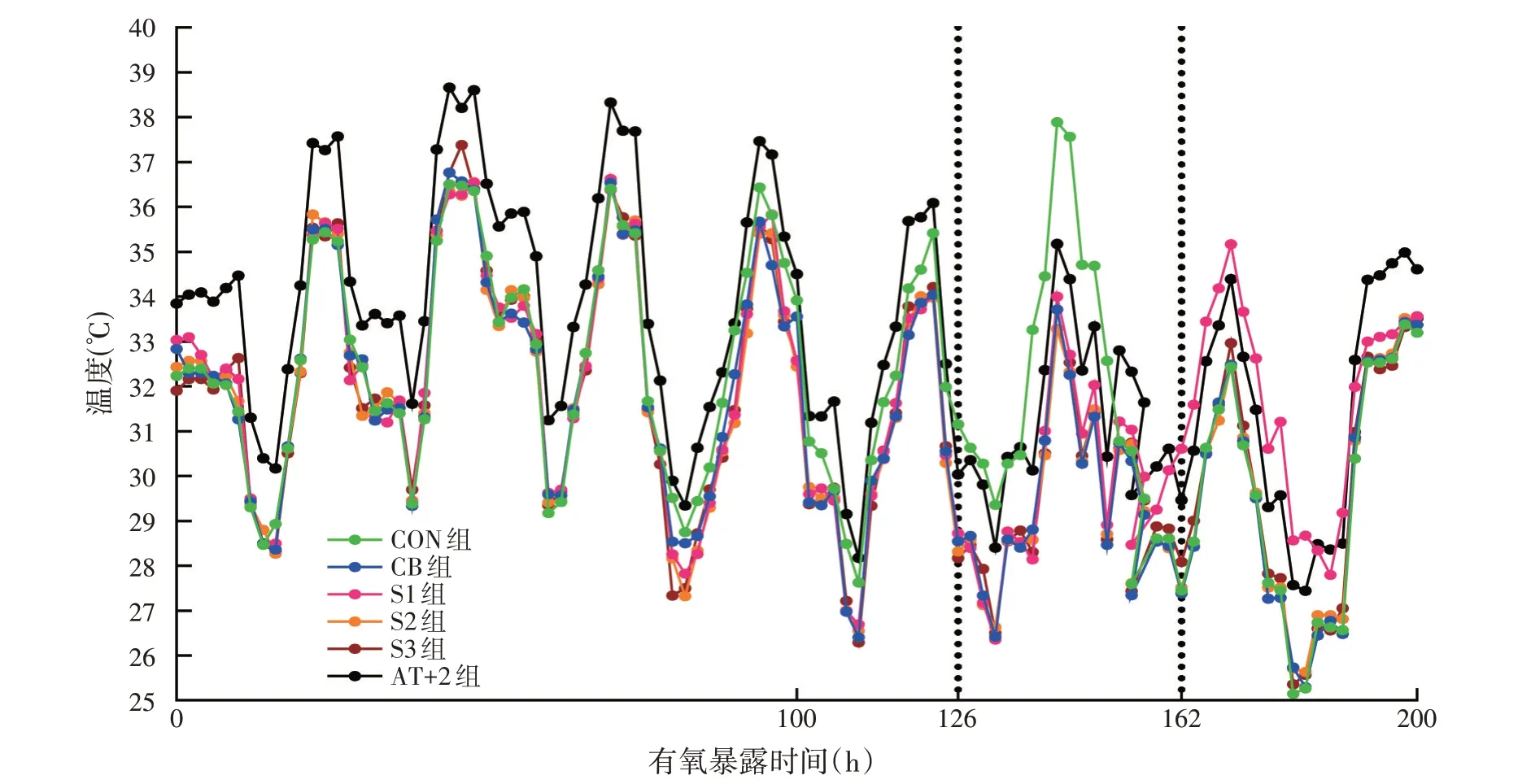
图1 苜蓿青贮过程中温度的动态变化
3 讨论
青贮饲料是一种相对简单有效的饲料资源保存方法。青贮饲料的发酵分为四个阶段:①饲料收获后发酵筒仓中的初始好氧阶段;②乳酸菌生长的发酵阶段;③发酵稳定性阶段;④开仓阶段。减少饲料干物质损失是青贮饲料的必要条件,在本研究中,尽管第60天时苜蓿的干物质含量与初始值相比有所下降,但牛链球菌和植物乳杆菌的添加显著降低了苜蓿的干物损失。可能的原因是添加植物乳杆菌和牛链球菌可以降低青贮饲料中不良微生物的含量[1]。这一结果与Whiter 等[11]的研究结果一致。从本研究结果来看,青贮苜蓿的好氧细菌明显减少,但差异不显著(P>0.05)。
青贮发酵过程中的CP 损失是由于青贮饲料和青贮饲料中的微生物(如梭菌)的CP 降解过程,产生小肽和氨基酸,进一步降解为NH3-N[12]。在Ding 等[13]的研究中,添加商业植物乳杆菌、产生阿魏酯酶的植物乳杆菌和生产阿魏酯酶的细菌可以减少粗蛋白的损失,添加植物乳杆菌组的NH3-N显著低于对照组。在本试验中,CB 组和S3 组的粗蛋白含量显著高于对照组(P<0.05),可能的原因是青贮饲料的pH 影响了粗蛋白的降解,当pH 较低时,它会抑制蛋白酶的活性和蛋白质的水解。由于低WSC 含量和高缓冲能力,苜蓿青贮饲料一直具有挑战性[14]。在之前的报道中,苜蓿青贮发酵的pH 为4.29~5.01[15]。本研究中,青贮苜蓿中pH较低的S3组粗蛋白含量较高。
中性洗涤纤维是测定饲料中碳水化合物结构的重要指标。NDF 和ADF 含量过高会减少动物的采食量。Lynch 等[16]在苜蓿青贮饲料中添加乳酸菌,对NDF 的降解率没有显著影响。在本研究中,各组的ADF随着青贮时间的变化而逐渐降低,并且在60 d时ADF 含量显著低于初始ADF 含量,这与Bai 等[17]的研究结果一致。
当膳食脂质为动物提供能量时,它们的热量获得和消耗是最低的。将脂质的可消化能量或代谢能量转化为净能量的效率高于碳水化合物和蛋白质。因此,饲料中经常添加一定量的脂肪来代替碳水化合物和蛋白质,从而减少消化过程中的能量,减少热量的获得和消耗,并增加净能量,提高饲料的动物消化率[18]。在本试验中,将乳酸菌添加到苜蓿中,各组的粗脂肪含量均有所增加趋势,可能原因是青贮苜蓿中前期生长繁殖的微生物在死亡分解后,含有磷脂的双层细胞膜被释放,增加了青贮苜蓿的粗脂肪含量。
青贮饲料pH的降低是由于乳酸和乙酸的积累[1],青贮过程中的乙酸含量是一个消极的指标,代表干物质的消耗[12],然而,乙酸同样被认为是提高青贮饲料有氧稳定性的唯一物质,而乳酸是青贮饲料中浓度最高的酸,对pH 的降低也贡献最大[20]。传统青贮饲料的pH 应低于4.2,乳酸含量应为4%~6%[19]。由于苜蓿自身WSC的限制,苜蓿不能达到这一标准。在Zhao等[1]的研究中,苜蓿青贮中植物乳杆菌ZZU203 的最低pH不超过5.0,但乳酸含量可以达到干物质的6%,这与本试验的结果一致。
青贮过程中微生物区系在不断变化[21],肠球菌是发酵青贮饲料中的常见菌,肠球菌会与青贮饲料中的乳酸菌竞争WSC,导致青贮饲料气体的产生和营养价值的下降[22]。青贮苜蓿中的肠球菌在第12 天开始减少。这也是由于乳酸菌数量的增加,导致pH 下降,肠球菌数量减少。
乙酸可以提高青贮饲料的需氧稳定性。能够提高青贮饲料有氧稳定性最常见的乳酸菌是布鲁氏菌(Lactobacillus brucelli,L.brucelli)[23]。然而,L.brucelli在青贮饲料的后期产生乳酸,生产商希望在青贮饲料的前30 d生产足够的乙酸,以解决因打开筒仓而导致的需氧腐败问题[24]。研究表明,当乙酸含量为青贮玉米干物质的2.62%时,青贮的好氧稳定性可以显著提高[25]。在本试验中,苜蓿在第60天的乳酸菌添加量可以达到相同的水平,但在第30天,乙酸含量不足。
4 结论
添加牛链球菌后,苜蓿的青贮品质得到了改善,尤其是减少了DM 和WSC 的消耗,降低了青贮pH 和NH3-N 的含量,提高了LA 的含量,同时也显著降低了牧草中不利于发酵的肠球菌含量,提高了苜蓿的有氧稳定性,建议在苜蓿中添加牛链球菌作为一种新的青贮接种剂。

